النظام الإفرازي الثالث في البكتيريا
النظام الإفرازي الثالث في البكتيريا النوع الثالث من أنظمة الإفراز في الخلايا البكتيرية وغالباً يكتب Type III secretion system واختصاره TTss or T3ss ويسمى أيضاً الانجستيسوم وهو ملحق بروتيني يوجد في البكتيريا سالبة غرام.
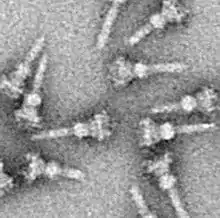
في البكتيريا المسببة للأمراض يشبه في تركيبته الإبرة، ويتم استخدامه كناقل حسي للكشف عن وجود كائنات حقيقية النوى وتفرز البروتينات التي تساعد البكتريا في نقل العدوى، حيث تفرز بروتينات تدعى المستجيبة من خلية البكتيريا مباشرة إلى داخل خلية العائل حقيقية النوى، والتي بدورها تنتج عدداً من التأثيرات التي تساعد مسبب المرض على البقاء والمقاومة والهروب من الاستجابة المناعية.
نظرة عامة
أصيغ المصطلح النظام الافرازي الثالث في العام 1993 ويتميز هذا النظام من بين خمسة أنظمة أخرى على الأقل موجودة في البكتيريا سالبة غرام.كما أن العديد من البكتيريا الحيوانية والنباتية لديها نظام مشابه لهذا النظام، وهذه الأنظمة تتشابه نتيجة لاختلاف وتباين التطور وتحليل النشوء والذي يدعم بدوره قدرة البكتيريا سالبة غرام على نقل الجينات المنتجة للنظام الافرازي الثالث إلى الانواع الأخرى من الكائنات. العديد من هذه الأنظمة الافرازية الثالثة تم دراستها وبحثها في حالات بكتيريا "الشيغيلا" التي تسبب الزحار، "السلامونيلا " المسببة لحمى التيفوئيد وبكتيريا تدعى " ايشيريشا كولاي" التي تتواجد في الأمعاء وتسبب التسمم الغذائي وبكتيريا "فايبريو أو الضمة " والتي تسبب التهاب المعدة والأمعاء والاسهال وبكتيريا " البيركهولديرية" المسببة للرعام، وبكتيريا "يرسينيا" المسببة للطاعون، بكتيريا "الكلاميديا "تسبب الأمراض المنقولة جنسيا، البكتيريا الزائفة: تصيب البشر والحيوانات والنباتات و مسببات الأمراض الإيروينية أي في النباتات، و "الرالستونيا " و "زانثوموناس".
يتكون هذا النظام تقريبا من 30 بروتين مختلف، مما يجعله واحد من أنظمة إفراز الأكثر تعقيدا. تظهر تركيبته العديد من أوجه التشابه مع أسواط البكتيرية (طويلة، جامدة، التراكيب الخارجية على غلاف الخلية المستخدمة للحركة). بعض من البروتينات المشاركة في هذا النظام تشارك سلاسل من الحموض الأمينية المماثلة في تركيبتها للبروتينات السوطية. بعض من هذه البكتيريا تمتلك T3SS لديها أسواط وكذلك هي متحركة مثل السالمونيلا، والبعض الآخر لا، مثل بكتيريا الشيغلا.
على العموم، يستخدم النوع الثالث من أنظمة الإفراز لإفراز البروتينات المرتبطة بالعدوى ومكونات سوطية، لذلك يتم غالبا استخدام مصطلح "النوع الثالث من أنظمة الإفراز للتعبير عما يتعلق بالعدوى. كما أن الأسواط البكتيرية لديها خصائص قديمة مشتركة مع النوع الثالث من أنظمة الإفراز.
ويلعب هذا النظام دور مهم في احداث المرض ونقل العدوى لدى البكتيريا المسببة للمرض، وإذا حدث أي خلل في هذا النظام قد يفقد ذلك البكتيريا قدرتها على احداث المرض
وقد أشير إلى أن بعض سلالات الغير غازية من البكتيريا سالبة الجرام[1] قد فقدت T3SS لأن النظام لم يعد قابلا للاستخدام. على الرغم من المضادات الحيوية التقليدية كانت فعالة ضد هذه البكتيريا في الماضي، إلا أنها أظهرت مقاومة مستمرة لهذه المضادات. فهم الطريقة التي يعمل بها T3SS وتطوير عقاقير تستهدف على وجه التحديد أصبحت هدفا هاما للعديد من المجموعات البحثية في جميع أنحاء العالم منذ أواخر التسعينيات من القرن الماضي
التركيب
البروتينات البكتيرية التي يجب ضخها تمر من السيتوبلازم البكتيري من خلال الإبرة مباشرة إلى السيتوبلازم المضيف. ثلاثة اغشية تقسم السيتوبلازمين: الغشاء المزدوج (العضو الداخلي والخارجي) من البكتريا سالبة غرام وغشاء النواة. الإبرة تزود مرور سهل من خلال اغشية غير منفذة وذات اختيار عالي. بكتيريا واحدة يمكن أن يكون لها مئات من تجمعات الإبر التي تنتشر عبر الغشاء. وقد اقترح ان تجمع الإبرة هو سمة عالمية للنظام الافرازي الثالث لجميع البكتيريا المسببة للمرض.
يبدأ مجمع الإبرة من سيتوبلازم البكتريا ويمر عبر غشائيين ويبرز من الخلية. الجزء المتصل في الغشاء هو قاعدة النظام الافرازي الثالث. الجزء خارج الخلية هو الإبرة ويسمى بالقضيب الداخلي الذي يربط الإبرة بالقاعدة. على الرغم من ان الإبرة هي الجزء الأكبر والمسيطر للنظام الافرازي الثالث ولكن هي مصنوعة من أجزاء من البروتينات الواحدة. لذلك اغلبية بروتينات النظام الافرازي الثالث التي تبني القاعدة هي التي تفرز في المضيف. كما ذكر سابقا الإبرة تشارك أوجه شبه مع أسواط البكتيريا.بشكل مخصص، قاعدة الإبرة تشبه كثيرا في تركيبها قاعدة سوط البكتيريا، الإبرة نفسها مماثلة لمعلاق السوط التركيب الذي يربط القاعدة مع خيوط السوط.
القاعدة تتكون من عدة حلقات دائرية وهي أول جزء تم بناؤه في هيكل مجمع الإبرة الجديد.عندما تكتمل القاعدة، تعمل بدور آلة الضخ للبروتينات الخارجية (المؤشر). عندما يكتمل تركيب الإبرة بشكل كامل، يتحول النظام حتى يضخ البروتينات المفروض نقلها إلى الخلايا المضيفة. الإبرة معروف انها تبنى من القاعدة إلى القمة.البروتينات كوحدة البناء الصغرى للابرة تتجمع فوق بعضها البعض. وبذلك الوحدة التي في قمة الإبرة هي آخر وحدة يتم اضافتها. الوحدة الجزئية للإبرة هي واحدة من اصغربروتينات النظام الافرازي الثالث ويتراوح قياسها 9 كيلو دالتون تقريبا.
100-150 جزء يكون كل ابرة.
قياس ابرة النظام الافرازي الثالث يتراوح تقريبا ما بين 60 -80 نانو ميتر في الطول و 8 نانو ميتر في العرض الخارجي. يجب أن يكون هناك طول أدنى للإبرة من اجل ان لا تتدخل التراكيب الخارجية الأخرى للبكتيريا في الإفراز (الالتصاق، طبقة عديدات سكر شحمية). قطر محيط مدخل الإبرة هو 88 نانو ميتر اغلب البروتينات المؤثرة المنطوية هي كبيرة جدا لتمر من خلال فتحة الإبرة. ولهذا اغلب البروتينات المفرزة يجب أن تمر من خلال الإبرة وهي غير منطوية، وهذه المهمة يتم تنفيذها من قبل انزيم الادينوسين ثلاثي الفوسفات في قاعدة هيكل الإبرة.
بروتينات T3SS
يمكن تصنيف بروتين النظام الثالث من الإفراز إلى ثلاثة فئات:
- البروتينات البنيوية: تبني القاعدة، القضيب الداخلي والإبرة
- البروتينات المؤثرة: يتم افرازها في الخلية المضيفة، و تبدأ بعملية العدوى وكما تثبط الدفاع عند الخلية المضيفة.
- chaperones:
تربط المؤثرات في سيتوبلازم البكتيريا، بحيث تقوم بحمايتهم من التجمع والتحلل وتوههم نحو مجمع الإبرة
معظم جينات بروتين (T3SS) يكون موقعها ال (operons), هذه ال (operons)تقع على كروموسوم البكتيريا في بعض الأنواع، أو في بعض البلازميد المخصصة في أنواع أخرى. على سبيل المثال، السالمونيلا تملك منطقة كروموسومية تكون فيها جينات (T3SS) متجمعة، فتسمى "جزيرة السالمونيلا الممرضة" (SPI). أما بكتيريا الشيغيلا، تملك بلازميد ممرض كبير جداً حيث تقيم فيه جميع جينات (T3SS)ز من المهم ملاحظة أن هناك الكثير من الجزر الممرضة والبلازميدات تحتوي مواد تسمح للجينات المتكررة الأفقية أن تنتقل من الجزيرة\البلازميد إلى نوع جديد.
البروتينات المؤثرة التي يتم افرازها عب الإبرة تحتاج إلى تنظيم من النظام، بما أن هذه البروتينات تقوم بالطفو معاً في الستوبلازم بالإضافة إلى اّلاف البروتينات الأخرى.التنظيم هذا يتم من خلال "إشارة افراز"-إشارة الإفراز هي سلسلة قصيرة من الحموض الأمينية تقع في بداية (نهاية-N) (N-terminus) من البروتين "عادة في أول 20 حمض أميني"- والتي يستطيع مجمع الإبرة التعرف عليها. على عكس أنظمة الإفراز الأخرى وإشارة الإفراز لبروتين (T3SS)لا يثم ازالتها أو قصها من البروتين.
الحث على الإفراز
هناك طرق مختلفة لحث البكتيريا على الإفراز، البكتيريا عندما تصل الإبرة بالخلية الهدف (المضيفة) يتم تحفيز نظام الإفراز للبروتين عندها، وهذه الطريقة ليست معروفة عند الكل. وايضا هناك طرق أخرى للإفراز ومنها أن ترفع البكتيريا ايونات الكالسيوم في الوسط التي تنمو فيه وذلك يتم بإضافة الصبغة العطرية (الكونغو) إلى وسط النمو على سبيل المثال (حمض ثنائي أمين إيثيلين رباعي حمض الأسيتيك).وتستخدم البكتيريا هذه الاساليب وغيرها في المختبرات لتحث على الإفراز للمواد عند البكتيريا.
هناك أيضا طرق أخرى مختلفة عن طريقة الإبرة وهي أن تتأثر البكتيريا بعوامل خارجية في المختبرات. البكتيريا لديها القدرة أن تستشعر الحرارة ودرجة الحموضة ومستوى الأكسجين والأسموزية (بالإنجليزية osmotic concentrationn), وهذا الإستشعار يجعلها تقرر أن تُفَعّل نظام الإفراز للمواد لديها أم لا. فعلى سبيل المثال، بكتيريا السلمونيا تستطيع أن تتكاثر وتعيش في الأمعاء الدقيقة بشكل أفضل من عيشها في الأعور، وهذه البكتيريا قادرة على معرفة مكان وجودها بفضل ايونات موجودة في هذه المناطق. فالأمعاء الدقيقة تحتوي على أيونات الفورمات (بالإنجليزية formate) والأسيتات، أما الأعور لا يحتوي على هذه الأيونات، فالبكتيريا قادرة على استشعار هذه الأيونات ومعرفة مكان وجودها بواستطهم، فتُفَعّل البكتيريا نظام الإفراز عندها في الأمعاء الدقيقة. وهناك جزيئات في الأعور مثل البروبينات (بالإنجليزية Propionate) والبيوتيرات (بالإنجليزية Butyrate), هذه الأيونات تثبط نظام الإفراز عند البكتيريا، فلهذا السبب لا تعيش بشكل أفضل في الأعور. أيون الكوليسترول، الدهون مثلا موجود في معظم الخلايا حقيقية النوى فهذا قادر على تثبيط نظام الإفراز لدى البكتيريا.
وهذه كلها عوامل خارجية تؤثر على نظام الإفراز لدى البكتيريا، فتؤثر عليها إما بشكل مباشر أو من خلال آلية وراثية. هناك العديد من عوامل النسخ التي تنظم عملية نسخ الجين المسؤول عن الإفراز لإفراز البروتين. بعض بروتينات التشابرون تستطيع الربط على الجين كعامل نسخ فتحفز عملية إنتاج البروتين. هناك البروتينات المؤثرة، هذه البروتينات تنظم عملية التعديل وعملية النقل والإفراز. فعندما تريد الخلية ان تنقل المواد عن طريق نظام الإفراز، تقوم بربط البروتينات المؤثرة على بروتين التشابريون، وإذا أصبح حاجة للنقل تقوم بفك البروتينات المؤثرة عن التشابريون، فالتشابريون ينظم للخلية عملية النسخ.
هناك أيضا نظام مشابه لنظام الإفراز للبروتين في البكتيريا. هذا النظام يُمكّن الغشاء الداخلي والخارجي من الخلايا البكتيرية السالبة في المساعدة في انبعاث الحويصلات من الغشاء الداخلي للخلايا البكتيرية، وهكذا يتم تسليم الإفرازات من الخلايا البكتيرية إلى الخلايا حقيقية النوى.
عدوى بواسطة نظام الإفراز (بروتينات المؤثرة)
البكتيريا تمتلك بروتينات تُدعى بالبروتينات المؤثرة، فتقوم البكتيريا بفرزها إلى الخلايا المضيفة.وهذا البروتين يدخل إلى الخلية المجاورة عن طريق إدخال الإبرة لخلية البكتيريا في قاعدة الخلية المضيفة ويصنع طريقه داخل الإبرة إلى داخل الخلية المضيفة. الطريق الذي يشقه هذا البروتين إلى الخلية المضيفة غير معروف، كانوا يعتقدوا سابقا أن الإبرة نفسها قادرة على عمل ثقب في غشاء الخلية المضيفة، ولكن هذه النظرية رُفضت، أصبح الآن واضح ان بعض البروتينات المؤثرة تُفرز في البداية من البكتيريا وتقوم بإنشاء قنوات أو فتحات في غشاء الخلية المضيفة، لتسمح بأنواع أخرى من البروتينات المؤثرة بالدخول . هناك أنواع من البكتيريا يوجد فيها طفرات في مجموعة البروتينات، بحيث قادرة على إفراز البروتينات ولكن غير قادرة على تسليمهم إلى الخلايا المضيفة. بشكل عام كل نظام افراز يحتوي على ثلاث أنواع من البروتينات المؤثرة، وبعض منهم يتصرف كوظيفتين، وظيفة عمل فتحات في الغشاء وأيضا الدخول إلى الخلية المضيفة وتقوم بدور المؤثرات.
البروتينات المؤثرة قادرة على التلاعب بالخلية المضيفة بطرق مختلفة، ومنها تعزِّز امتصاصها للخلية البكتيرية، العديد من البكتيريا التي تمتلك نظام الإفراز يجب أن تدخل إلى الخلية المضيفة حتّى تتضاعف وتنشر العدوى. البروتينات المؤثرة التي تقوم البكتيريا بإفرازها تحث الخلايا المضيفة على بلعمة خلية البكتيريا. وللقيام بهذا العمل، البروتينات المؤثرة تتلاعب بخيوط الآكتين المبلمرة في الخلايا المضيفة، والآكتين هو من مكونات الهيكل الخلوي وهو يشارك في قدرة الخلية على الحركة وتغيير شكلها . وبمجرد دخول الخلية
البكتيرية إلى الخلية المضيفة، فإنها قادرة على افراز مؤثرات أخرى بسهولة أكبر، ويمكن أن تخترق الخلايا المجاورة وسرعان ما تصيب النسيج كله.
البروتينات المؤثرة أيضا تُؤثر على دورة حياة الخلية المضيفة من خلال قيادها إلى عملية الموت البطيء (الإنتحار). واحد من الأبحاث ipab على البروتينات هو بروتين
هذا يُفرز من بكتيريا (شايجيلا الفلكسنرية)، هذا البروتين له وظيفة مزدوجة واحدة منها هي عمل فتحات في غشاء الخلية المضيفة، وأخرى بممارسة آثار ضارة متعددة على الخلية المضيفة. وقد ثبت أن هذا البروتين يقود الخلية المضيفة إلى عملية الموت البطيء بواسطة جزيئات كبيرة تدعى الخلايا الاكولة بعد قيامها بعملية البلعمة . وقد تم التحقق مؤخرا ان البروتين يتفاعل مع كاسباس ليقود الخلية إلى الموت البطيء وهو بروتين تنظيمي كبير في الخلايا حقيقية النوى.
هناك أيضا فوائد أخرى للبروتينات المؤثرة في تعمل كعامل نسخ فتحفز نسخ جينات الخلايا التي تدخل إليها . فعندما تقوم الخلية البكتيرية بحقن هذا البروتين إلى خلية نباتية، فإنه يدخل إلى نواتها ويحفز عملية نسخ الجين ويساهم في العدوى .وقد تم تحسين كيفية فهم تأثير البروتينات، وكيف تغير نسخ الجينات في خلايا النباتات العائل.
قضايا عالقة:
منذ منتصف التسعينات تم نشر مئات المقالات عن (T3SS). بالرغم من ذلك، لا يزال هناك العديد من القضايا العالقة والغير محلولة حول هذا النظام:
- بروتين (T3SS): بين كل 30 بروتين (T3SS) هناك أقل من 10 بروتينات في كل كائن يتم الكشف عنها مباشرة من خلال استخدام أساليب الكيمياء الحيوية. باقي البروتينات، تكون ربما نادرة، تم اثبات صعوبة الكشف عنها ولا تزال بروتينات نظرية (رغم أنه تم إجراء الدراسات الجينية بدلا من دراسات الكيمياء الحيوية على العديد من بروتينات\جينات (T3SS) ). بالإضافة إلى ذلك، فإنّ موقع كل بروتين على حدى ليس معروفاً تماماً.
- طول الإبرة: من الغير معروف كيف تعرف البكتيريا أن الإبرة الجديدة قد وصلت الطول المناسب . توجد العديد من النظريات، من بينهم وجود بروتين حاكم “ruler protein” الذي يربط بطريقة أو بأخرى رأس وقاعدة الإبرة . أضافة احادية (monomers) جديدة إلى رأس الإبرة يتطلب امتداد البروتين الحاكم وبذلك يعطي إشارة لطول الإبرة إلى القاعدة.
- علم الطاقة: القوة التي تحرك البروتين داخل الإبرة غير معلومة تماماً . إحدى ال (ATPase)يرتبط بقاعدة بروتين (T3SS)و يشارك في توجيه البروتين في الإبرة، لكنه ليس واضحاً إذا كان يزودها بالطاقة للانتقال.
- إشارة الإفراز: كما ذكر أعلاه، ان وجود إشارة افراز في المؤثرات هو شيء معروف . هذه الإشارة تسمح للنظام أن يميّز بروتينات نقل (T3SS) عن باقي البروتينات. لكن فهم طبيعة هذه الإشارة ومتطلباتها واّليه تعرّفها لا يزال ضعيفاً. لكن وسائل توقع أي من بروتينات البكتيريا يمكنه الانتقال عن طريق النظام الثالث من الإفراز تم تطويرهم مؤخراً.
- تفعيل الإفراز: على البكتيريا أن تعرف ما هو الوقت الصحيح لافراز المؤثرات . الإفراز الغير ضروري وهو حين تفرز البكتيرا ولا يكون هناك أي خلايا مضيفة مجاورة، هذا النوع من الإفراز يعتبر اسراف للبكتيريا من حيث الطاقة والموارد . البكتيريا قادرة على تعريف الاتصال بين الإبرة والخلية المضيفة، كيف يحصل هذا لا يزال طور البحث، والطريقة أو الاسلوب المستخدم ربما يعتمد على العوامل المسببة للأمراض . بعض النظريات تفترض تغيّر دقيق في التكوين الجزئي لشكل الإبرة أثنائ اتصالها مع الخلية المضيفة، هذا التغيّر ربما يعمل كاشارة للقاعدة حتى تبدأ الإفراز . وقد تم اكتشاف اسلوب واحد من اساليب التعرّف في السالمونيلا، ويعتمد هذا الاسلوب على استشعار درجة حموضة العصارة الخلوية للخلية المضيفة خلال الجزيرة الامراضية T3SS " the pathogenicity island 2-encoded T3SS” من اجل التبديل في افرازات المؤثرات.
- ارتباط ال (chaperones): انه ليس من المعروف متى ترتبط ال (chaperopns) في المستجي "سواء أثناء أو بعد الترجمة" وكيف تنفصل عن مؤثراتها قبل الإفراز.
- آليات عمل المؤثرات: رغم أنه تم اكتشاف الكثير من بداية القرن الواحد والعشرين عن الطرق التي تقوم فيها مؤثرات ال (T3SS) بالتلاعب في الخلية المضيفة، لا تزال معظم التأثيرات والمسارات غير معروفة حتى اللحظة.
- التطور: كما ذكر سابقاً، (T3SS) يرتبط ارتباطاً وثيقاً بسوط البكتيريا . هناك ثلاث فرضيات متنافسة: أولها، أن السوط تطور أولاً ثم T3SS اشتق من هذا شكل السوط . الثانية، أن الT3SS تطورت أولاً ثم اشتق السوط من شكلها، والثالثة، أن الشكلين "السوط و T3SS" تم اشتقاقهما من سلف مشترك . كان هناك الكثير من الجدل حول الفرضيات المختلفة بما أن الفرضيات الثلاثة توضح وتشرح التماثل البروتيني بين الشكلين، وكذلك التنوع الوظيفي لهما . ومع ذلك، أدلة التطور الجيني تفضل الفرضية التي تفترض أن الT3SS تم اشتقاقه من السوط البكتيري، من خلال عملية تقوم على فقدات الجينات الأولية واكتساب جينات جديدة . الخطوة الرئيسية في العملية الأخيرة هي تطويع ال (secretins) إلى (T3SS), وهو الحدث الذي يحدث أكثر بثلاث مرات على الأقل في هذا النظام عن النظم الأخرى المرتبطة بالغشاء.
التسميات لبروتينات T3SS
منذ بداية عام 1990 أنواع البروتينات T3SS الجديدة وجدت في مختلف أنواع البكتيريا بمعدل ثابت. وقد أعطيت اختصارات بشكل مستقل لكل سلسلة من البروتينات في كل كائن حي، وعادة لا تكشف الأسماء الكثير عن وظيفة البروتين. وفيما بعد إتضح أن بعض البروتينات المكتشفة بشكل مستقل في مختلف أنواع البكتيريا تكون متماثل. الأسماء السابقة، مع ذلك، معظمها قد تم الإبقاء عليه، والأمر الذي قد يؤدي إلى ارتباك. على سبيل المثال: البروتينات Sic A، Lpg C وSyc D هي متماثلة من السالمونيلا، الشيجلا ويرسينيا على التوالي، ولكن الحرف الأخير ("الرقم التسلسلي") باسمائهم لا تظهر ذلك.

وفيما يلي ملخص لأكثرأسماء سلاسل البروتينية شيوعا في العديد من الأنواع التي تحتوي على T3SS. لاحظ أن هذه الأسماء تشمل البروتينات التي تشكل آلية T3SS فضلا عن البروتينات المستجيبة المفرزة:
- يرسينيا
- Yop: البروتين الخارجي ليرسينيا
- Ysc إفراز يرسينيا (عنصر)
- Ypk: انزيم تحليل لبروتين يرسينيا
- Yop: البروتين الخارجي ليرسينيا
- السالمونيلا
- Spaعرض سطح الأجسام المضادة
- Sic: مرافق الغزو سالمونيلا
- Sip: بروتين الغزو سالمونيلا
- Pho-P: Prg –تثبيط الجينات
- Inv: الغزو
- Org: جينات تنظم الأكسجين
- Ssp : بروتينات مفرزة سالمونيلا
- Iag : الجينات المصاحبة للغزو
- الشيجلا
- Ipg : غزو جينات البلازميد
- Ipa: غزو اجسام مضادة البلازميد
- Mxi : التعبير عن غشاء IPA
- Spa: عرض سطح الاجسام المضادة
- Osp: البروتين الخارجي للشجيلا
- بكتيريا القولونية
- Tir: مستقبلات intimin موجهه
- Sep: إفراز بروتينات لبكتيريا القولونية
- Esc: إفراز القولونية (عنصر)
- Esp: إفراز البروتين القولونية
- Ces: المرافق لافراز القولونية
- السودوموناس
- Hrp: استجابة ذات حساسية العالية ومرضية
- Hrc: استجابة ذات حساسية عالية محفوظة (أو الحفظ HRP)
- البكتيريا العصوية
- Nop: البروتين Nodulation
- Rhc: البكتريا العصوية المحفوظة
- في العديد من أنواع :
- Vir: القدرة الامراضية
وبعد هذه الاختصارات من حرف أو رقم، الحروف عادة تدل على "الرقم التسلسلي": إما الترتيب الزمني للاكتشاف أو الترتيب الفعلي لظهور هذا الجين في مشغل (أحياء) . الأرقام، حالة نادرة، دلالة على الوزن الجزيئي للبروتين في كيلو دالتون، أمثلة: IpaA، IpaB، IpaC, MxiH، MxiG، MxiM. Spa9 و Spa47.
تظهر عدة عناصر أساسية في جميع T3SSs: أحادي الإبرة، العصا الداخلي للإبرة، البروتينات الحلقة، وموجهين اثنين، بروتين إبرة طرف، والبروتين الحاكم (والذي يعتقد أنه يقوم بتحديد طول الإبرة، انظر أعلاه). وال ATPase، التي تمد الطاقة للإفراز. ويبين الجدول التالي بعض هذه البروتينات الأساسية في أربعة البكتيريا التي تحتوي على T3SS:
| وظيفة /جنس ↓ | بكتيريا القولونية | شجيلا | سالمونيلا | يرسينيا |
| أحادي الإبرة | EscF | MxiH | PrgI | YscF |
| عصا الداخلي | EscI | MxiI | PrgJ | YscI |
| بروتين إبرة الطرف | EscA | IpaD | SipD | LcrV |
| موجه | EscD | IpaB | SipB | YopB |
| موجه | EscB | IpaC | SipC | YopD |
| مرافق للموجهين | CesD | IpgC | SicA | SycD |
| ATPase | SepB (EscN) | Spa47 | InvC | YscN |
| بروتين الحاكم | Orf16 | Spa32 | InvJ | YscP |
| تحول | EscU | Spa40 | SpaS | YscU |
| حماية البوابة | SepL | MxiC | InvE | YopN (TyeA) |
الأساليب المستخدمة في بحوث النوع الثالث من أنظمة الإفراز
عزل مجمع الإبرة لل T3SS
وقد شكلت عزل هيكل الغشاء الكبيرة، الضعيفة، النافرة من الماء من خلايا اعتبر تحديا لسنوات عديدة. بحلول نهاية عام 1990s، ومع ذلك، فقد تم تطوير عدة طرق لعزل T3SS NCs. في عام 1998 تم عزل أول NCs من السالمونيلا التيفيميوريم.[2]
للعزل، وتزرع البكتيريا في كمية كبيرة من وسط سائل للنموحتى تصل إلى مرحلة اللوغارتمي. ثم يتم استخدام جهاز الطرد المركزي فيه؛ يتم التخلص من السائل(الوسط) والراسب الملتصق (البكتيريا) يتم اعادته إلى وضع السائل في تحلل العازلة عادة تحتوي على الليزوزيم وأحيانا المواد مثل LDAO أو تريتون X-100. هذا المخزن المؤقت يتحلل جدار الخلية. بعد عدة جولات من تحلل والغسل، يتعرض البكتيريا المفتوحة إلى سلسلة من ultracentrifugations. هذا العلاج إثراء لهياكل الجزيئات الكبيرة وتخلص من مكونات الخلية الصغيرة. اختياريا، يتعرض المحللة النهائي لمزيد من التنقية باستخدام CSCL التدرج الكثافة.
نهج إضافية لمزيد من تنقية يستخدم قابلية عالية من التقارب اللوني. ويتم إنتاج البروتينات T3SS المؤتلف التي تحمل علامة البروتين (علامة الحامض الاميني، على سبيل المثال) يتم انتاجه عن طريق الاستنساخ الجزيئي ثم قدم (تحول) في ابحاث البكتيرية . بعد عزل NC الأولية، كما هو موضح أعلاه، يتم تمرير المحللة من خلال عمود المغلفة مع الجسيمات مع قابلية عالية إلى العلامة (في حالة من علامات الحامض الاميني: أيونات النيكل). يتم الاحتفاظ البروتين الموسومة في العمود، ومعها مجمع إبرة بأكمله. درجة عالية من النقاء يمكن تحقيقه باستخدام مثل هذه الأساليب. هذا النقاء ضروري لكثير من المقايسات الحساسة التي استخدمت لتوصيف NC.
كانت معروفة النوع الثالث من المستجيبات منذ بداية 1990s، ولكن الطريقة التي يتم تسليمها إلى الخلايا المضيفة لغزا كاملة. والتماثل بين العديد من سوطي والبروتينات T3SS قاد الباحثين إلى الاشتباه بوجود هيكل T3SS الخارجي مشابه للسوط، تحديد والعزل اللاحق للبنية إبرة يمكن الباحثين إلى:
- تميز هيكل ثلاثي الأبعاد من NC في التفاصيل، وخلال هذه استخلص استنتاجات بشأن آلية إفراز (على سبيل المثال، أن العرض الضيق من الإبرة يتطلب تتكشف من المؤثرات قبل إفراز)،
- تحليل مكونات البروتين فيNC، وذلك عن طريق إخضاع الإبر معزولة لتحليل البروتين (انظر أدناه)،
- تعيين أدوار لمختلف مكونات NC، وهذا عن طريق التخلص من الجينات T3SS، عزل NCs من البكتيريا محورة ودراسة التغيرات التي تسببها الطفرات
المجهر، البلورات، والحالة الصلبة الرنين المغناطيسي النووي
كما هو الحال مع معظم جميع البروتينات، فإن تمييز وتصوير T3SS ممكن فقط باستخدام المجهر الإلكتروني. وأظهرت الصور الأولى من البلاغات المعروفة بمجمع الإبرة عام 1998 تركيبة الخيوط الابرية في هذا النظام الخارجة من جدار الخلية البكتيرية، كما وأظهرت البلاغات الحية والمسطحة معزولة ثنائية الأبعاد. في عام 2001 صور من البلاغات من بكتيريا الشاغيلا الفلكسنرية تم تحليلها رقميا للحصول على أول هيكل شبه ثلاثي أبعاد التركيبة والهيكل الحلزوني من البلاغات (مجمع الإبرة) من بكتيريا الشيغيلا الفلكسنرية تم توضيحها بدرجة وضوح 16أنجستروم باستخدام حيود الأشعة السينية على الألياف. عام 2003، وبعد ذلك بعام تم نشر 17 ألف هيكل ثلاثي أبعاد من البلاغات من بكتيريا السالمونيلا تيفيميوريم . وقد سمح التقدم والنهج الحديثة إلى ايجاد الصورثلاثية الأبعاد عالية الدقة من مجمع الإبرة .
وقد تبلور العديد من بروتينات النظام الثالث T3SS على مر السنين. وتشمل هذه البروتينات الهيكلية لمجمع الإبرة والبروتينات المؤثرة والمرافقة الغشائية. وكانت الوحدة التركيبية الأولى في إبرة النظام البروتيني تدعى "بزال"BsaL من بكتيريا "بيركولديريا بسيدومالي". لاحقا التركيب البلوري للMixH من بكتيريا الشيغيلا فلكسنريه تم حله في عام 2006.
في عام 2012، مزيج من (نواتج إبرة النظام من النوع الطبيعي المؤتلف مع حالة صلبة من الوحدة التركيبية الصغرى، المجهرالإلكتروني ونموذج روسيتا) أظهر supramolecular والتركيب الذري الكامل في نهاية المطاف في ابرة النظام الافرازي الثالث لدى بكتيريا السالمونيلا التيفيميوريم. كما كشف هذا النموذج نهاية مجموعة الحموض الأمينية الممتدة على سطح الإبرة
مثبطات النوع الثالث من أنظمة الإفراز
وقد تم اكتشاف عدد قليل من المركبات التي تمنع النوع الثالث من أنظمة الإفراز T3SS في البكتيريا سالبة الجرام، بما في ذلك " جوادينوماين "التي تنتج بشكل طبيعي من أنواع البكتيريا السبحية.
دراسات الوراثة والوظيفة
النظام الافرازي الثالث في كثير من البكتريا تم تعديله من قبل الباحثين. مراقبة تأثير التعديل الفردي يمكن أن يستخدم للتعمق في دور كل جزء من النظام. امثلة على التعديلات هي:
- حذف واحد أو أكثر من جينات النظام الافرازي الثالث (الجينات المخرجة).
- الافراط في التعبير لجينات النظام الافرازي الثالث (بمعنى آخر إنتاج في جسم الكائن الحي بروتينات النظام الافرازي الثالث بكميات حجمها أكبر من المعتاد).
- تغيرات في نقطة أو منطقة معينة في جينات أو بروتينات النظام الافرازي الثالث .هذه التغيرات تتم من اجل معرفة وظيفة احماض أمينية أو مناطق معينة في البروتين.
- ادخال جين أو بروتين من نوع واحد من البكتيريا إلى آخر (فحص تداخل متكامل). وهذا يتم من اجل فحص الاختلافات والتشابهات بين اثنيتن من بروتينات النظام الافرازي الثالث .
التعديلات لأجزاء النظام الافرازي الثالث يمكن أن يكون لها تأثيرات على عدة جوانب للوظائف البكتيرية والمرضية. امثلة على تأثيرات محتملة:
- قدرة البكتيريا إلى اقتحام خلايا المضيف في حالة مسببات الامراض داخل الخلايا وهذا يمكن قياسه باستخدام قياس الغزو (بالإنجليزية invasion assay)(فحص الحماية من الجنتامايسين)(بالإنجليزية gentamicin protection assay).
- القدرة على التداخل البكتيري للعيش بين الخلايا المضيفة.
- قدرة البكتيريا على قتل الخلايا المضيفة. ويمكن أن يقاس هذا الأمر من خلال عدة طرق، على سبيل المثال من خلال فحص افراز الLDH، حيث انزيم ال LDH، الذي يرشح من الخلايا الميتة يحدد من خلال قياس النشاط الأنزيمي.
- قدرة النظام الافرازي الثالث لافراز بروتين معين أو افراز كل البروتينات. من اجل فحص هذا، عملية الإفراز تتم في بكتيريا تنمو في وسط سائل. لاحقا يتم فصل البكتيريا والوسط عن طريق الطرد المركزي. بعدها، جزء من الوسط (السائل الطائف) يتم فحصه لوجود البروتينات المفرزة. من اجل منع بروتين يفرز بالعادة من عملية الإفراز، يمكن ربط جزيء كبير معه بشكل اصطناعي . لاحقا، إذا بقيت البروتينات غير المفرزة عالقة في قاع مركب الإبرة، فيمكن القول ان عملية الإفراز محظورة بشكل فعال.
- قدرة البكتيريا على تجميع مركب الإبرة كاملا .يمكن ل NCs ان تفصل من البكتيريا المعدلة وفحصها عن طريق المجهر . على اية حال، لا يمكن دائما للتعديلات الثانوية الصغيرة ان تكتشف من خلال المجهر .
- قدرة البكتيريا أن تصيب الحيوانات أو النباتات. حتى إذا البكتيريا المعدلة ظهر في المختبر انه يمكنها التأثير على الخلايا المضيفة، قدرتها على تحمل الإصابة في عضو حي لا يمكن تجاهلها.
مستويات التعبير للجينات الأخرى. هذا يمكن فحصه من خلال عدة طرق، لا سيما، northern blot و RT-PCR . مستويات التعبير للجينوم بأكمله يمكن فحصها بواسطة microarray . العديد من النوع الثالث من عوامل النسخ و الشبكات المنتظمة تم اكتشافها باستخدام هذه الطرق.
- نمو ولياقة
- البروتينات :
- قد استخدمت عدة أساليب من أجل التعرف على مجموعة من البروتينات التي تكون النظام الافرازي الثالث T3SS. عزل مجمع الإبرة يمكن فصلها مع نظام الفصل الكهربائي الهلامي. اللقطع التي تظهر بعد صبغها يمكن تميزها بشكل فردي من هلام وتحليلها باستخدام تسلسل البروتين وبالانجليزية (Protein sequencing)وقياس الطيف الكتلي بالإنجليزية (Mass spectrometry). المكونات الهيكلية لمجمع الإبرة يمكن فصلها عن بعضها البعض (جزء الإبرة عن جزء القاعدة، على سبيل المثال)، ومن خلال تحليل تلك الأجزاء يمكن معرفة البروتينات المشاركة في النظام واستخلاصها. بدلا من ذلك، الابرالمعزولة يمكن تحليلها مباشرة من قبل قياس الطيف الكتلي، دون الكهربائي مسبق، من أجل الحصول على صورة كاملة للبروتيوم بالإنجليزية (proteome)
مراجع
- Donmazov, Samir؛ Piskin, Senol؛ Pekkan, Kerem (01 يونيو 2015)، "Noninvasive in vivo determination of residual strains and stresses"، Journal of Biomechanical Engineering، 137 (6): 061011، doi:10.1115/1.4030071، ISSN 1528-8951، مؤرشف من الأصل في 13 يناير 2017.
{{استشهاد بدورية محكمة}}: الوسيط غير المعروف|ببمد=تم تجاهله (مساعدة) - Kubori T, Matsushima Y, Nakamura D, Uralil J, Lara-Tejero M, Sukhan A, Galán JE, Aizawa SI (1998). "Supramolecular structure of the Salmonella typhimurium type III protein secretion system". Science. 280 (5363): 602–605
- بوابة علم الأحياء