بروتين كيناز منشط بالميتوجين
بروتين الكيناز المنشط بالميتوجين (بالإنجليزية: Mitogen-activated protein kinase) أو اختصارا MAPK، هو نوع من البروتين كيناز خاص بأحماض السيرين الثريونين الأمينية. تشارك بروتينات الكيناز المنشطة بالميتوجين في توجيه استجابة الخلايا لمجموعة متنوعة من المحفزات، مثل الميتوجينات، الصدمات التناضحية، الصدمات الحرارية والسيتوكينات المحرضة على الالتهاب. كما تقوم أيضا بتنظم وظائف الخلية المختلفة بما في ذلك التكاثر الخلوي، التعبير الجيني، التمايز الخلوي، التفتل، استمرار الخلايا، والاستماتة.[1]
يمكن العثور على بروتينات الكيناز المنشطة بالميتوجين فقط عند حقيقيات النوى، لكنها تكون مجابهة ومتنوعة إلى حد ما في جميع الحيوانات والفطريات والنباتات، وحتى في مجموعة من حقيقيات النوى أحادية الخلية.
ينتمي بروتين الكيناز المنشط بالميتوجين إلى مجموعة تدعى باسم كيناز الCMGC التي هي اختصار لأسماء الكيناز الأربعة المكونة للعائلة (CDK/MAPK/GSK3/CLK). أقرب عائلة للبروتين كيناز المنشط بالميتوجين هي عائلة الكيناز المعتمد على السيكلين (CDKs).[2]
الاكتشاف
أول بروتين كيناز منشط بالميتوجين تم اكتشافه كان هو ERK1 (بروتين كيناز 3 منشط بالميتوجين) عند الثدييات. نظرا لأن كلا من الERK1 وقريبه ERK2 (بروتين كيناز 1 منشط بالميتوجين) يشتركون في عملية تأشير عامل النمو، فقد سميت هذه العائلة باسم «المنشطة بالميوجين». مع اكتشاف أعضاء آخرين من نفس العائلة، عند كائنات بعيدة (عند النباتات على سبيل المثال)، أصبح من الواضح وبشكل متزايد أن هذا الاسم هو في الواقع تسمية خاطئة، ذلك أن معظم بروتينات الكيناز المنشط بالميتوجين تشارك فعليا في الاستجابة لمنبهات الإجهاد اللاأحيائي التي من المحتمل أن تكون غير ضارة (فرط التناضح، الإجهاد المؤكسد، تلف الحمض النووي، انخفاض الأسمولية، العدوى، وما إلى ذلك). نظرا لأن النباتات لا يمكنها «التهرب» من الإجهاد، فإن النباتات الأرضية تمتلك بالمقارنة مع الكائنات الأخرى أكبر عدد من جينات البروتين كيناز المنشط بالميتوجين. وبالتالي، فإن دور كناز ERK1 أو ERK2 كمنظم لتكاثر الخلايا عند الثديات ليس له وظائف عامة فحسب، بل له وظيفة متخصصة للغاية.
الأنواع
تتوفر معظم البروتينات كيناز المنشط بالميتوجين على عدد من الخصائص المشتركة، على غرار التنشيط الذي يعتمد على حدثي فسفرة، وبنية مسار ثلاثية المستويات بالإضافة إلى مواقع متطابقة للتعرف على الركيزة. وهذه هي بروتينات الكيناز المنشطة بالميتوجين «الكلاسيكية». في المقابل لا تتوفر مجموعة أخرى على مواقع فسفرة مزدوجة، وتشكل مسارات على مستويين فقط، كما وتفتقر إلى الوظائف التي تتطلبها بروتينات الكيناز المنشط بالميتوجين الأخرى للارتباط بالركيزة. عادة ما يشار إليها باسم بروتينات الكيناز المنشطة بالميتوجين «غير النمطية».[3] لم يتضح بعد ما إذا كانت هذه البروتيناة غير النمطية تشكل مجموعة واحدة على عكس تلك الكلاسيكية.
متتاليات التأشير
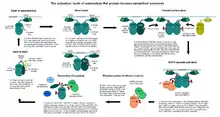
تشكل بروتينات الكيناز المنشطة بالميتوجين عادة مسارات متعددة المستويات، وتتلقى مدخلات من عدة مستويات أعلى من كيناز الMAP الفعلي. على عكس آلية تفعيل بروتينات الكيناز المنشطة بالميتوجين وبروتينات 4 كيناز المنشطة بالميتوجين البسيطة نسبيا والتي تعتمد على الفسفرة، تمتلك بروتينات 3 كيناز المنشطة بالميتوجين آلية تنظيم معقدة بشكل مذهل. تتطلب العديد من بروتينات كيناز المنشطة بالميتوجين المعروفة، مثل c-Raf أو MEKK4 أو MLK3 خطوات متعددة لتنشيطها. هي في العادة إنزيمات يتم التحكم فيها بشكل تفارغي، يتم حظرها بإحكام في حالة عدم نشاطها عن طريق آليات متعددة.
يتم في الخطوة الأولى الحد من فاعلية المثبط الذاتي الخاص بها عن طريق ربيطة أصغر (مثل الراس بالنسبة لـc-Raf أو GADD45 بالنسبة لـMEKK4 [6] أو البروتين 42 المتحكم في انقسام الخلية (Cdc42) في حالة الـMLK3.[7] يحدث هذا عادة (ولكن ليس دائما) على مستوى غشاء الخلية، حيث ترتبط معظم منشطاتها (لاحظ أن البروتينات G الصغيرة ترتبط بشكل أساسي مع الغشاء لأسباب تتعلق بعملية البرنلة (بالإنجليزية: prenylation)). يتبع هذه الخطوة تجانس وتغاير لنطاقات الكيناز التي تصير بعد هذه اللحظة من المكن الوصول إليها. تكشف البنى المعقدة التي تم تحديدها مؤخرا أن الدايمرات تتشكل في اتجاه يجعل كلا منطقتي ربط الركيزة خالية.[8] أهم من ذلك، يفرض حدث الدايمرة (بالإنجليزية: dimerisation) هذا على مجالات بروتينات 3 كيناز المنشطة بالميتوجين تبني شكل نشط جزئيا. لا يتحقق النشاط الكامل إلا عندما تتحول هذه الدايمرات إلى فسفوريل على مستوى حلقات التنشيط الخاصة بها. يمكن أيضا تحقيق هذه الخطوة الأخيرة أو المساعدة على تحقيقها عن طريق بروتينات الكيناز المساعدة (بروتينات 4 كيناز المنشطة بالميتوجين). بمجرد أن يصبح بروتين 3 كيناز المنشط بالميتوجين نشطا تماما، فإنه يمكن أن يفسفر ركائز بروتينات 2 كيناز المنشطة بالميتوجين الخاصة بها، والتي تعمل بدورها على فسفرة ركائز بروتين كيناز المنشط بالميتوجين الخاصة بها.
عند الحيوانات
عند الثديات، يعد مسار 1 كيناز منظم بإشارات خارج خلوية أو 2 كيناز منظم بإشارات خارج خلوية (ERK1/2) النظام الأكثر تميزا لبروتينات كيناز المنشطة بالميتوجين. أهم منشطات المنبع لهذا المسار هي بروتينات الراف (A-Raf، أو B-Raf أو c-Raf)، بالإضافة إلى الوسطاء الرئيسيين في عملية الاستجابة لعوامل النمو (عامل نمو البشرة، عامل نمو الأورام الليفية، عامل النمو المشتق من الصفيحات، وغيرها)؛ لكن في المقابل يمكن لبروتينات 4 كيناز المنشطة بالميتوجين الأخرى مثل "c-Mos" و"Tpl2/Cot" أن تلعب نفس الدور. تعمل جميع هذه الإنزيمات فسفرة وبالتالي تنشيط بروتين 2 كيناز 1 مزدوج الخاصية والمنشط بالميتوجين (MKK1) و\أو بروتين 2 كيناز 2 مزدوج الخاصية والمنشط بالميتوجين (MKK2)، والتي هي بدورها منشطات محددة للغاية لكل من بروتين كيناز 3 المنشط بالميتوجين (ERK1) وبروتين كيناز 1 المنشط بالميتوجين (ERK2). تحتوي هذه الفسفوريلايت الأخير على عدد من الركائز المهمة في عملية تكاثر الخلايا، وتقدم دورة الخلية، وكذا انقسام الخلايا وتمايزها (ريبوسوم إس 6 كيناز (RSK)، عامل النسخ Elk-1، وغيرها).
عند النباتات
على الرغم من توفر النباتات على العدد الأكبر لجينات بروتين كيناز المنشط بالميتوجين، إلا أن دراسة مسارات بروتين كيناز المنشط بالميتوجين عندها تمت بوثيرة أقل من تلك التي من أصل حيواني أو فطري. مع أن إشاراتها تبدو معقدة للغاية، فإن إنزيمات بروتين 3 كيناز المنشط بالميتوجين وبروتين 4 كيناز المنشط بالميتوجين وبروتين 6 كيناز المنشط بالميتوجين لدى نبات رشاد أذن الفأر، على سبيل المثال هي واسطات رئيسية في الاستجابة للصدمات التناضحية والإجهاد التأكسدي وكذا الاستجابة للبرد والمشاركة في الاستجابات المضادة للأمراض.[9][10] بالإضافة إلى ذلك، فهي تشارك أيضا في عملية التشكل الحيوي، ذلك أن بروتينات 4 كيناز المنشطة بالميتوجين الطافرة تؤدي إلى حدوث حالة من التقزم الشديد.[11]
انظر أيضا
مراجع
- Pearson G, Robinson F, Beers Gibson T, Xu BE, Karandikar M, Berman K, Cobb MH (أبريل 2001)، "Mitogen-activated protein (MAP) kinase pathways: regulation and physiological functions"، Endocrine Reviews، 22 (2): 153–83، doi:10.1210/er.22.2.153، PMID 11294822.
- Manning G, Whyte DB, Martinez R, Hunter T, Sudarsanam S (ديسمبر 2002)، "The protein kinase complement of the human genome"، Science، 298 (5600): 1912–34، doi:10.1126/science.1075762، PMID 12471243.
- Coulombe P, Meloche S (أغسطس 2007)، "Atypical mitogen-activated protein kinases: structure, regulation and functions"، Biochimica et Biophysica Acta، 1773 (8): 1376–87، doi:10.1016/j.bbamcr.2006.11.001، PMID 17161475.
- Matallanas D, Birtwistle M, Romano D, وآخرون (مارس 2011)، "Raf family kinases: old dogs have learned new tricks"، Genes Cancer، 2 (3): 232–60، doi:10.1177/1947601911407323، PMC 3128629، PMID 21779496.
- Alexa A, Varga J, Reményi A (نوفمبر 2010)، "Scaffolds are 'active' regulators of signaling modules"، FEBS J.، 277 (21): 4376–82، doi:10.1111/j.1742-4658.2010.07867.x، PMID 20883493.
- Miyake Z, Takekawa M, Ge Q, Saito H (أبريل 2007)، "Activation of MTK1/MEKK4 by GADD45 through induced N-C dissociation and dimerization-mediated trans autophosphorylation of the MTK1 kinase domain"، Molecular and Cellular Biology، 27 (7): 2765–76، doi:10.1128/MCB.01435-06، PMC 1899887، PMID 17242196.
- Du Y, Böck BC, Schachter KA, Chao M, Gallo KA (ديسمبر 2005)، "Cdc42 induces activation loop phosphorylation and membrane targeting of mixed lineage kinase 3"، The Journal of Biological Chemistry، 280 (52): 42984–93، doi:10.1074/jbc.M502671200، PMID 16253996.
- Rajakulendran T, Sahmi M, Lefrançois M, Sicheri F, Therrien M (سبتمبر 2009)، "A dimerization-dependent mechanism drives RAF catalytic activation"، Nature، 461 (7263): 542–5، doi:10.1038/nature08314، PMID 19727074.
- Sinha AK, Jaggi M, Raghuram B, Tuteja N (فبراير 2011)، "Mitogen-activated protein kinase signaling in plants under abiotic stress"، Plant Signaling & Behavior، 6 (2): 196–203، doi:10.4161/psb.6.2.14701، PMC 3121978، PMID 21512321.
- Rodriguez MC, Petersen M, Mundy J (2010)، "Mitogen-activated protein kinase signaling in plants"، Annual Review of Plant Biology، 61: 621–49، doi:10.1146/annurev-arplant-042809-112252، PMID 20441529.
- Kosetsu K, Matsunaga S, Nakagami H, Colcombet J, Sasabe M, Soyano T, Takahashi Y, Hirt H, Machida Y (نوفمبر 2010)، "The MAP kinase MPK4 is required for cytokinesis in Arabidopsis thaliana"، The Plant Cell، 22 (11): 3778–90، doi:10.1105/tpc.110.077164، PMC 3015120، PMID 21098735.
- بوابة علم الأحياء
- بوابة علم الأحياء الخلوي والجزيئي