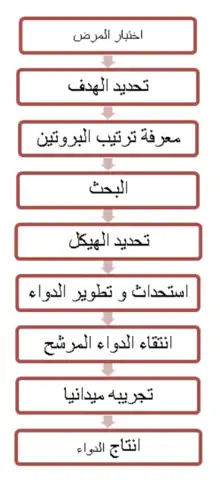
تصميم دواء
تصميم الدواء (بالإنجليزية: drug design) ، كما يشار إليه أحيانا بتصميم الأدوية العقلاني (أو المنطقي) أو تصميم الأدوية القائم على الهيكلية، هو عملية مبتكرة لإيجاد أدوية جديدة مبنية على معرفة الهدف البيولوجي.[1]
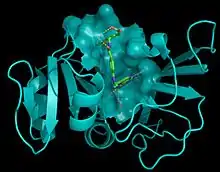
هذا الهيكل يساعد على فهم طريقة عمل الدواء.
هذا الدواء الذي يتم تصميمه هو عادة ما يكون جزيء عضوي صغير يقوم بتنشيط أو تثبيط وظيفة من جزيء حيوي مثل البروتين ممّا يؤدي بدوره إلى فوائد علاجية للمريض.
بمعنى بسيط، تصميم الادوية ينطوي على تصميم جزيئات صغيرة تتكامل في الشكل وفي الشحنة الكهربائية مع الهدف الجزيئي البيولوجي وتتفاعل معه.
تصميم الأدوية يعتمد بشكل شائع على تقنيات النمذجة الحاسوبية ولكن لا يعتمد بالضرورة على الحاسوب.[2]
والدواء هو جزيء عضوي صغير له دور في تنشيط جزيء حيوي آخر أو منع وظيفته مثل البروتين , مما يؤدي إلى فائدة علاجية للمريض. ويمكن أن نبسط المعنى السابق لتصميم الدواء بقولنا إنه يتضمن تصميم الجزيئات التي ترتبط بالهدف الحيوي الجزيئي وتتفاعل معه، وهي مكملة له في الشكل والشحنة . وغالباً ما يستخدم الحاسوب في تصميم الدواء _ ويسمى هذا النوع من التصميم بتصميم الدواء بمساعدة الحاسوب ولكن ليس من الضروري أن يعتمد عليه بشكل كلي.[3]
ويعتمد تصميم الدواء على معرفة الهيكل ثلاثي الأبعاد للهدف الجزيئي الحيوي والمعروف بتصميم الأدوية القائمة على الهيكل الحيوي، وأيضاً يعتمد على الجزيئات الصغيرة و(المستحضرات الصيدلانية ( خاصة الأجسام العلاجية المضادة. لهذا فالبعض يرى أن عبارة ( تصميم الدواء ) تعد - إلى حد ما - تسمية غير دقيقة والتسمية الأكثر دقة هي (تصميم الجزيء) الذي سيرتبط بإحكام مع الهدف المحدد.
وعلى الرغم من أنَ تقنية التصميم تكون ناجحة، إلاَ أن هناك العديد من الخصائص الأخرى التي يجب أن يكون لها الأهمية الأولى لكي يعد الدواء آمنا وفعَالا قبل تصميمه , ( مثل التوافر الحيوي , عمر النصف , عمليات الأيض , الآثار الجانبية وغيرها.. ) , ومع ذلك هناك خصائص أخرى يصعب التنبؤ بها باستخدام هذه التقنية.
ونظراً لارتفاع معدلات الاستنزاف -attrition rates– أثناء تصميم الدواء، فإنه يجب أن يكون الانتباه مركزاً على الخصائص الفيزيائية والكيميائية المتوقع أن تؤدي إلى مضاعفات أقل، وبهذا تتم الموافقة عليه و إدراجه في الأسواق.
أهداف الدواء
الهدف الجزيئي الحيوي : هو جزيء رئيسي يشارك في مسار أيضي معين، أو في مسار الإشارات المرتبطة بحالة مرضية ( أو أمراض) معينة، أو المرتبطة بالإصابة بميكروب ما أو ببقاء هذا الميكروب على قيد الحياة (مثل البروتين أوالحمض النووي )
وهناك جزيئات صغيرة ( مثل المستقبلات "receptor " , والمنبهات "agonists " ,والمضادات " antagonists " , والمنبهات العكسية "inverse agonist " , والمعدلات " modulator " , ومنشطات الإنزيم " enzyme activator " , والمثبطات "inhibitor " , والقنوات الأيونية " openers or blockers ion channel " ) ويجب أن تكون مكملة لموقع الارتباط الموجود على الهدف
ويتم تصميم الدواء بحيث لا يؤثر على جزيئات مهمة أخرى ( يُصمم لهدف معين دون غيره ), فتفاعل الدواء مع هدف غير مرغوب به يؤدي إلى ظهور آثار جانبية غير مرغوبة، ويعود ذلك إلى تشابه مواقع الارتباط، فيرتبط الدواء بهدف مشابه لموقع ارتباطه الأصلي مما يؤدي إلى ظهور تلك الآثار.
وبشكل عام، فالدواء ينتج من التفاعلات الكيميائية لكن الدواء المعتمد على البوليمر الحيوي ( المنتجات الصيدلانية الحيوية ) ينتج من العمليات الحيوية التي تزداد شيوعاً.
اكتشاف الأدوية المنطقية
بالمقارنة مع الطرق التقليدية لاكتشاف الدواء التي تعتمد على اختبارات التجربة والخطأ للمواد الكيميائية، فإن تصميم الدواء المنطقي ( reverse pharmacology ) يبدأ مع فرضية تعديل الهدف الحيوي الذي يمكن أن يكون له قيمة علاجية. ويوجد جزئين أساسيين من المعلومات المطلوبة لاختيار الهدف (target)، أولهما: أن يكون هناك دليل لتعديل الهدف وعليه يتم تعديل المرض[8].، وثانيهما: أن يكون الهدف قابلا للتدمير، بمعنى أن يكون له القدرة على الارتباط بجزيئات صغيرة لها القدرة على تغيير نشاطه [9], ويجب أن تكون مواصفات المركب الذي تم اختياره كدواء مشابهة لمواصفات الدواء وفقا للمنظمات العالمية، مثل أن يكون له آثار جانبية أقل وأن يكون أكثر استقراراً.
وبناء على ذلك، فهناك العديد من الطرق لتقييم ما إذا كان هذا المركب يستحق أن يكون دواء أو لا، مثل قاعدة ليبينسكي الخمسية Lipinski's Rule of Five
تصميم الدواء بمساعدة الحاسوب
يكمن الهدف الأساسي من تصميم الدواء في معرفة ما إذا كان الجزيء يرتبط بقوة وبكيفية معينة مع الهدف، وغالباً ما تستخدم الميكانيكيا الجزيئية أو الديناميكيا الجزيئية لتقدير قوة التفاعل بين الجزيئات الصغيرة وبين الهدف البيولوجي. وتستخدم هذه الطرق أيضاً لمعرفة شكل الجزيء وطريقة تغيره أثناء ارتباطه بالهدف الحيوي، ومن الضروري معرفة مدى تآلف الجزيء مع مكان ارتباطه على الهدف , [11] وتقنية التصميم هذه توفر الكثير من الوقت والمال.
وتصميم الدواء بمساعدة الكمبيوتر يمر بعدة مراحل منها:
الرسم الخيالي الناجح للدواء virtual screening :أي يجب على المصمم أن يرسم الدواء في مخيلته أولا، لتحديد الهياكل المحتملة لارتباطه بالهدف (structure-based design, QSAR, etc.) .
تصميم الدواء بحيث يرتبط بمكان محدد دون غيره (hit to head)
المحافظة على الخصائص المثالية للدواء خلال ارتباطه مع الهدف.
أنواع تصميم الدواء
هناك نوعان أساسيان لتصميم الدواء:
تصميم الدواء بناء على الرابط (غير مباشر)
ويعتمد على معرفة ارتباط الجزيئات بالهدف الحيوي ومعرفة جزيئات أخرى تقوم بنقل الدواء بحيث تعطي أقل هياكل ممكنة للارتباط لزيادة الانتقائية، بالإضافة إلى أنه يعتمد أيضا على العلاقة بين الخصائص المحسوبة للجزيئات والنشاط الحيوي الموضح خلال التجارب، وهو ما يسمى بـ (quantitative structure –activity relationships QSAR)، فهذه العلاقة تساعدنا في التنبؤ بنشاط المركب الجديد.
تصميم الدواء بناء على الهيكل (مباشر)
يعتمد تصميم الدواء القائم على الهيكل (أو تصميم الدواء المباشر) على معرفة بنية ثلاثية الأبعاد للهدف البيولوجي التي تم الحصول عليها من خلال أساليب متعددة، مثل: البلورات بالأشعة السينية أو الطيف الرنين المغناطيسي النووي. فاذا كان هيكل الهدف المستخدم في التجربة غير متوفر، فمن الممكن إيجاد أو خلق هيكل مماثل للهدف بناءً على هيكل البروتين المتعلق بالتجربة. وباستخدام بنية الهدف البيولوجي يمكن تصميم الدواء المرشح المتوقع أن يرتبط بتقارب عال وانتقائية للهدف عن طريق رسومات تفاعلية وتنبوء كيميائي طبي، وبدلا من ذلك يمكن استخدام العديد من الإجراءات الحسابية الآلية لترشيح أدوية أخرى.
يمكن تقسيم الطرق المستخدمة حاليا لتصميم الأدوية القائمة على التركيب إلى ثلاث فئات رئيسية، هي:
- تحديد روابط جديدة لمستقبل معين من خلال البحث في قواعد بيانات كبيرة من الهياكل ثلاثية الأبعاد من الجزيئات الصغيرة للعثور على تلك المناسبة للمستقبلات باستخدام برامج التقريب السريع (وتعرف هذه الطريقة بالفحص الظاهري.)
- تصميم دي نوفو من روابط جديدة. وفي هذا الأسلوب، يتم بناء جزيئات عن طريق تجميع القطع الصغيرة بطريقة تدريجية. يمكن أن تكون هذه القطع إما ذرات فردية أو جزيئية. والميزة الرئيسية لمثل هذه الطريقة هي أن الهياكل الجديدة، غير الواردة في أي قاعدة بيانات، يمكن اقتراحها.
- تحسين الروابط المعروفة عن طريق تقييم النظير المقترح داخل مكان الارتباط.
فوائد تصميم الدواء بواسطة الكمبيوتر
- اكتشاف أدوية جديدة.
- التخلص من المركبات التي لديها خصائص غير مرغوب فيها مثل ضعف امتصاصها أو ضعف فعاليتها.
- التعرف على الأدوية و تحسين خصائصها.
- توفير الوقت.
- تقليل التكاليف.
- تحسين نوعية حياة المريض.
أمثلة
هناك مثال خاص لتصميم الأدوية ينطوي على استخدام معلومات ثلاثية الأبعاد حول الجزيئات الحيوية التي تم الحصول عليها من تقنيات مثل البلورات بالأشعة السينية وطيف الرنين المغناطيسي النووي. وأغلب الأدوية التي صممت عن طريق الحاسوب اعتمدت بشكل أساسي على الهيكل، منها:
كربونبك انهيدراز مثبط دورزولاميد، الذي تمت الموافقة عليه في عام 1995
ايماتينيب (مثبط تايروسين كاينيز ) : يختلف كثيرا عن أدوية السرطان الأخرى حيث إن معظم العوامل المستخدمة بالعلاج الكيميائي تهدف إلى انقسام الخلايا السرطانية بسرعة دون التفريق بينها وبين الخلايا السليمة الأخرى.
مضادات الذهان غير التقليدية ( سيميتيدين ) .
سايكلو اوكسيجيناز-2 (COX-2 INHIBITOR ) .
انفوفيرتيد.
الزولبيديم، زوبيكلون.
مثبطات امتصاص السيروتينين الانتقائية وهي مجموعة من مضادات الاكتئاب.
زاناميفير ( مضاد للفيروسات ) .
اقرأ أيضًا
ألمراجع
- Madsen, Ulf; Krogsgaard-Larsen, Povl; Liljefors, Tommy (2002)، Textbook of Drug Design and Discovery، Washington, DC: Taylor & Francis، ISBN 0-415-28288-8.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Cohen, N. Claude (1996)، Guidebook on Molecular Modeling in Drug Design، Boston: Academic Press، ISBN 012178245x.
{{استشهاد بكتاب}}: تأكد من صحة|isbn=القيمة: invalid character (مساعدة) - Madsen, Ulf؛ Krogsgaard-Larsen, Povl؛ Liljefors, Tommy (2002)، Textbook of Drug Design and Discovery، Washington, DC: Taylor & Francis، ISBN 0-415-28288-8.
- بوابة صيدلة
- بوابة الكيمياء
- بوابة تصميم
- بوابة الكيمياء الحيوية