مرض الكلى المزمن
مرض الكلى المزمن (بالإنجليزية: Chronic kidney disease) هو نوع من أمراض الكلى يحدث فيه فقدان تدريجي لوظائف الكلى على مدى أشهر إلى سنوات.[1][2] في البداية لا توجد أعراض بشكل عام؛ في وقت لاحق، قد تشمل الأعراض تورم الساق والشعور بالتعب والقيء وفقدان الشهية والارتباك. تشمل المضاعفات زيادة خطر الإصابة بأمراض القلب وارتفاع ضغط الدم وأمراض العظام وفقر الدم.[3][4][5]
| مرض الكلى المزمن | |
|---|---|
| معلومات عامة | |
| الاختصاص | طب الكلى |
| من أنواع | قصور كلوي، واعتلال الكلية، ومرض |
| الإدارة | |
| أدوية | ديهيدروتاكيستيرول، وكربونات الكالسيوم، وهيدروكسيد المغنسيوم، وبوميتانيد، وأسيتات الكالسيوم، وكوليكالسيفيرول، وفوروسيميد، وحمض الإيثاكرينيك ، وماغالدرات ، وتوراسيميد، وإيبويتين ألفا، وباريكالسيتول، وسيفيلامير
|
تشمل أسباب مرض الكلى المزمن مرض السكري، وارتفاع ضغط الدم، والتهاب كبيبات الكلى، ومرض الكلى المتعدد الكيسات.[6] تشمل عوامل الخطر وجود تاريخ عائلي للإصابة بمرض الكلى المزمن. يتم التشخيص عن طريق اختبارات الدم لقياس معدل الترشيح الكبيبي المقدر، واختبار البول لقياس الألبومين. يمكن إجراء خزعة بالموجات فوق الصوتية أو خزعة الكلى لتحديد السبب الأساسي. العديد من أنظمة التدريج المعتمدة على الخطورة قيد الاستخدام.[7][8]
يوصى بفحص الأشخاص المعرضين للخطر.[9] قد تشمل العلاجات الأولية أدوية لخفض ضغط الدم وسكر الدم والكوليسترول.[10] مثبطات الإنزيم المحول للأنجيوتنسين أو مضادات مستقبلات الأنجيوتينسن II هي بشكل عام عوامل الخط الأول للتحكم في ضغط الدم، لأنها تبطئ تقدم مرض الكلى وخطر الإصابة بأمراض القلب.[11] يمكن استخدام مدرات البول العروية للسيطرة على الوذمة، وإذا لزم الأمر، لزيادة خفض ضغط الدم.[12] يجب تجنب مضادات الالتهاب غير الستيروئيدية.[10] تشمل التدابير الأخرى الموصى بها الحفاظ على النشاط، وبعض التغييرات الغذائية مثل اتباع نظام غذائي قليل الملح والكمية المناسبة من البروتين.[13] قد تكون هناك حاجة أيضًا إلى علاجات فقر الدم وأمراض العظام.[14][15] يتطلب المرض الشديد غسيل الكلى أو غسيل الكلى البريتوني أو زرع الكلى للبقاء على قيد الحياة.[16]
أصاب مرض الكلى المزمن 753 مليون شخص على مستوى العالم في عام 2016: 417 مليون أنثى و 336 مليون ذكر.[17] في عام 2015 تسببت في 1.2 مليون حالة وفاة، ارتفاعًا من 409000 في عام 1990.[18] الأسباب التي تساهم في أكبر عدد من الوفيات هي ارتفاع ضغط الدم عند 550.000، يليه مرض السكري عند 418.000 والتهاب كبيبات الكلى عند 238.000.[6]
الأسباب
الأسباب الثلاثة الأكثر شيوعًا لمرض الكلى المزمن بترتيب تواترها اعتبارًا من عام 2015 هي داء السكري وارتفاع ضغط الدم والتهاب كبيبات الكلى.[19] يعاني حوالي واحد من خمسة بالغين يعانون من ارتفاع ضغط الدم وواحد من ثلاثة بالغين مصابين بداء السكري من مرض الكلى المزمن. إذا كان السبب غير معروف، فإنه يسمى مجهول السبب.[20]
حسب الموقع التشريحي
- تشمل أمراض الأوعية الدموية أمراض الأوعية الدموية الكبيرة مثل تضيق الشريان الكلوي الثنائي ومرض الأوعية الدموية الصغيرة مثل اعتلال الكلية الإقفاري ومتلازمة انحلال الدم اليوريمية والتهاب الأوعية الدموية.
- يتألف مرض الكبيبات من مجموعة متنوعة ويتم تصنيفها إلى: [بحاجة لمصدر]
- مرض الكبيبات الأولي مثل تصلب الكبب الكلوية القطاعي البؤري واعتلال الكلية بالجلوبيولين المناعي أ
- مرض الكبيبات الثانوي مثل اعتلال الكلى السكري والتهاب الكلية الذئبي
- يشمل الأمراض الأنبوبية البينية التهاب الكلية الأنبوبي الخلالي المزمن الناجم عن الأدوية والسموم، واعتلال الكلية الارتجاعي.
- اعتلال الكلية الانسدادي، كما يتجلى في حصوات الكلى الثنائية وتضخم البروستاتا الحميد في غدة البروستاتا. نادرًا ما تسبب الديدان الدبوسية التي تصيب الكلى اعتلال الكلية الانسدادي.
آخري
- مرض وراثي خلقي مثل مرض الكلى المتعدد الكيسات أو متلازمة الحذف الصغير 17q12.
- اعتلال الكلية في أمريكا الوسطى، هو «شكل جديد من أمراض الكلى يمكن أن يسمى اعتلال الكلية الزراعي». لوحظ عدد كبير وغير مبرر حتى الآن من حالات مرض الكلى المزمن الجديدة، والتي يشار إليها باسم اعتلال الكلية في أمريكا الوسطى، بين العمال الذكور في أمريكا الوسطى، وخاصة في حقول قصب السكر في الأراضي المنخفضة في السلفادور ونيكاراغوا. الإجهاد الحراري الناجم عن ساعات طويلة من العمل بالقطعة عند متوسط درجات حرارة عالية من حوالي 36 درجة مئوية، وكذلك المواد الكيميائية الزراعية.
العلامات والأعراض
لا تظهر أعراض مرض الكلى المزمن في البداية، وعادة ما يتم اكتشافه في الفحص الروتيني لعمل الدم إما عن طريق زيادة الكرياتينين في الدم أو البروتين في البول. مع انخفاض وظائف الكلى، قد تظهر المزيد من الأعراض غير السارة:[21]
- ضغط الدم يرتفع بسبب الحمل الزائد للسوائل وإنتاج الهرمونات النشطة في الأوعية التي تفرزها الكلى عبرنظام الرينين-أنجيوتنسين، مما يزيد من خطر الإصابة بارتفاع ضغط الدم وفشل القلب.
- اليوريا تتراكم، مما يؤدي إلى تنترج الدم وفي نهاية المطاف يوريمية الدم (أعراض تتراوح من الخمول إلى التهاب التامور واعتلال دماغي). نظرًا لتركيزها الجهازي العالي، تفرز اليوريا في العرق المفرز بتركيزات عالية وتتبلور على الجلد مع تبخر العرق («الصقيع اليوريمي»).
- البوتاسيوم يتراكم في الدم (فرط بوتاسيوم الدم مع مجموعة من الأعراض بما في ذلك الشعور بالضيق وعدم انتظام ضربات القلب القاتلة). عادة لا يتطور فرط بوتاسيوم الدم حتى ينخفض معدل الترشيح الكبيبي إلى أقل من 20-25 مل/ دقيقة/ 1.73 م 2، وعند هذه النقطة تنخفض قدرة الكلى على إفراز البوتاسيوم. يمكن أن يتفاقم فرط بوتاسيوم الدم في مرض الكلى المزمن بسبب حموضة الدم (مما يؤدي إلى تحول البوتاسيوم خارج الخلية) ونقص الأنسولين.[22]
- قد تتراوح أعراض الحمل الزائد للسوائل من الوذمة الخفيفة إلى وذمة الرئة التي تهدد الحياة.
- فرط فوسفاتات الدم ينتج عن سوء طرح الفوسفات في الكلى. يساهم فرط فوسفات الدم في زيادة مخاطر الإصابة بأمراض القلب والأوعية الدموية عن طريق التسبب في تكلس الأوعية الدموية. تزداد التركيزات المتداولة لعامل نمو الأرومة الليفية-23 بشكل تدريجي مع انخفاض قدرة الكلى على إفراز الفوسفات مما قد يساهم في تضخم البطين الأيسر وزيادة معدل الوفيات لدى الأشخاص المصابين بمرض الكلى المزمن.[23]
- نقص كالسيوم الدم ينتج عن نقص كالسيتريول ومقاومة عمل هرمون الغدة الجار درقية. الخلايا العظمية هي المسؤولة عن زيادة إنتاج عامل نمو الأرومة الليفية-23، وهو مثبط قوي لإنزيم هيدروكسيلاز 1 (المسؤول عن تحويل كالسيفيديول إلى كالسيتريول). في وقت لاحق، يتطور هذا إلىفرط جارات الدرق الثانوي، وحثل عظمي كلوي المنشأ، وتكلس الأوعية الدموية الذي يزيد من ضعف وظائف القلب. النتيجة القصوى هي حدوث حالة نادرة تسمى التأق التكلسي.[24]
- الحماض الأيضي قد ينتج عن انخفاض القدرة على إنتاج ما يكفي من الأمونيا من خلايا النبيبات القريبة.[22] يؤثر حمض الدم على وظيفة الإنزيمات ويزيد من استثارة الأغشية القلبية والعصبية عن طريق تعزيز فرط بوتاسيوم الدم.[25]
- فقر الدم شائع ومنتشر بشكل خاص بين أولئك الذين يحتاجون إلى غسيل الكلى. إنه متعدد العوامل في السبب، ولكنه يشمل زيادة الالتهاب، وانخفاض في إريثروبويتين، وفرط حمض يوريك الدم مما يؤدي إلى تثبيط نخاع العظام. يحدث فقر الدم الناجم عن فرط التكاثر بسبب عدم كفاية إنتاج إريثروبويتين عن طريق الكلى.
- العجز الجنسي شائع جدًا لدى الرجال والنساء المصابين بمرض الكلى المزمن. يعاني غالبية الرجال من انخفاض الدافع الجنسي، وصعوبة في الانتصاب، والوصول إلى النشوة الجنسية، وتزداد المشاكل سوءًا مع تقدم العمر. تعاني غالبية النساء من مشاكل في الإثارة الجنسية، كما أن الحيض المؤلم ومشاكل ممارسة الجنس والاستمتاع به أمر شائع.[26]
- الناس المصابون بمرض الكلى المزمن يعانون من سرعة حدوث تصلب الشرايين وهم أكثر عرضة للإصابة بامراض القلب والأوعية الدموية من العامة. المرضى المصابين بمرض الكلى المزمن وأمراض القلب والأوعية الدموية يكون تقدم حالاتهم أسوأ بكثير من أولئك الذين يعانون فقط من امراض القلب والاوعية الدموية.
التشخيص
يعتمد تشخيص مرض الكلى المزمن إلى حد كبير على التاريخ والفحص ومقياس البول جنبًا إلى جنب مع قياس مستوى الكرياتينين في الدم. من المهم التفريق بين مرض الكلى المزمن والقصور الكلوي الحاد لأن القصور الكلوي الحاد يمكن أن يكون قابلاً للعكس. أحد الأدلة التشخيصية التي تساعد على تمييز مرض الكلى المزمن عن القصور الكلوي الحاد هو الارتفاع التدريجي في كرياتينين مصل الدم (على مدار عدة أشهر أو سنوات) بدلاً من الزيادة المفاجئة في كرياتينين مصل الدم (عدة أيام إلى أسابيع). لدى العديد من الأشخاص المصابين بمرض الكلى المزمن، فإن أمراض الكلى السابقة أو الأمراض الكامنة الأخرى معروفة بالفعل. يوجد عدد كبير مصاب بمرض الكلى المزمن لسبب غير معروف.[بحاجة لمصدر]
التحري
لا ينصح بفحص أولئك الذين ليس لديهم أعراض أو عوامل خطر للإصابة بمرض الكلى المزمن.[27][28] أولئك الذين يجب فحصهم هم: أولئك الذين يعانون من ارتفاع ضغط الدم أو لديهم تاريخ من أمراض القلب والأوعية الدموية، والذين يعانون من مرض السكري أو السمنة الواضحة، والذين تزيد أعمارهم عن 60 عامًا، والأشخاص من أصل أفريقي أمريكي، والذين لديهم تاريخ من أمراض الكلى في الماضي، والأشخاص الذين لديهم الأقارب الذين أصيبوا بمرض كلوي يتطلب غسيل الكلى. [بحاجة لمصدر]
يجب أن يشمل الفحص حساب معدل الترشيح الكبيبي المقدر من مستوى الكرياتينين في الدم، وقياس نسبة الألبومين إلى الكرياتينين في البول في عينة بول في الصباح الأول (وهذا يعكس كمية البروتين المسمى الألبومين في البول)، بالإضافة إلى شاشة قياس البول للكشف عن البيلة الدموية.
معدل الترشيح الكبيبي مشتق من كرياتينين المصل ويتناسب مع 1/كرياتينين، أي أنه علاقة متبادلة: كلما زاد الكرياتينين، انخفض معدل الترشيح الكبيبي. معدل الترشيح الكبيبي العادي هو 90-120 مل/دقيقة. تختلف وحدات الكرياتينين من بلد إلى آخر. ولكن نظرًا لأن الكبيبات تشكل أقل من 5٪ من كتلة الكلية، فإن معدل الترشيح الكبيبي لا يشير إلى جميع جوانب صحة الكلى ووظيفتها. يمكن القيام بذلك عن طريق الجمع بين مستوى معدل الترشيح الكبيبي والتقييم السريري للشخص، بما في ذلك حالة السوائل، وقياس مستويات الهيموغلوبين والبوتاسيوم والفوسفات وهرمون جار درقي.[بحاجة لمصدر]
الموجات فوق الصوتية
يعد تخطيط الصدى الكلوي مفيدًا لأغراض التشخيص والإنذار في أمراض الكلى المزمنة. سواء كان التغيير المرضي الأساسي هو التصلب الكبيبي أو الضمور الأنبوبي أو التليف الخلالي أو الالتهاب، فغالبًا ما تكون النتيجة هي زيادة صدى القشرة. يجب أن تكون صدى الكلى مرتبطة بتولد الصدى للكبد أو الطحال (الشكل 22 والشكل 23). علاوة على ذلك، غالبًا ما يُلاحظ انخفاض حجم الكلى والترقق القشري وخاصةً عند تقدم المرض (الشكل 24 والشكل 25). ومع ذلك، يرتبط حجم الكلى بالطول، ويميل الأشخاص القصَّر إلى امتلاك كلى صغيرة؛ وبالتالي، لا يمكن الاعتماد على حجم الكلى باعتباره المعلمة الوحيدة.
 مرض الكلى المزمن الناجم عن التهاب كبيبات الكلى مع زيادة صدى الصوت وانخفاض سمك القشرة. قياس طول الكلية على السونار موضح بعلامة "+" وخط متقطع.
مرض الكلى المزمن الناجم عن التهاب كبيبات الكلى مع زيادة صدى الصوت وانخفاض سمك القشرة. قياس طول الكلية على السونار موضح بعلامة "+" وخط متقطع.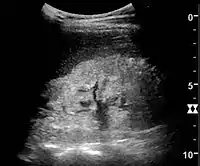 متلازمة الكلوية. الكلى مفرطة الصدى دون ترسيم القشرة والنخاع.
متلازمة الكلوية. الكلى مفرطة الصدى دون ترسيم القشرة والنخاع. التهاب الحويضة والكلية المزمن مع انخفاض حجم الكلى وترقق قشري بؤري. قياس طول الكلية على السونار موضح بعلامة "+" وخط متقطع.
التهاب الحويضة والكلية المزمن مع انخفاض حجم الكلى وترقق قشري بؤري. قياس طول الكلية على السونار موضح بعلامة "+" وخط متقطع. مرض الكلى المزمن في المرحلة النهائية مع زيادة الصدى والعمارة المتجانسة دون تمايز واضح بين الحمة والجيوب الكلوية وانخفاض حجم الكلى. قياس طول الكلية على السونار موضح بعلامة "+" وخط متقطع.
مرض الكلى المزمن في المرحلة النهائية مع زيادة الصدى والعمارة المتجانسة دون تمايز واضح بين الحمة والجيوب الكلوية وانخفاض حجم الكلى. قياس طول الكلية على السونار موضح بعلامة "+" وخط متقطع.
المراحل
| مراحل مرض الكلى المزمن | ||||||
|---|---|---|---|---|---|---|
| نسبة الألبومين / الكرياتينين | ||||||
| A1 | A2 | A3 | ||||
| طبيعي إلى معتدل الزيادة | زيادة معتدلة | زيادة شديدة | ||||
| <30 | 300-30 | >300 | ||||
| معدل الترشيح الكبيبي | ||||||
| G1 | طبيعي | ≥ 90 | 1 في حالة وجود تلف في الكلى | 1 | 2 | |
| G2 | انخفاض بشكل طفيف | 60-89 | 1 في حالة وجود تلف في الكلى | 1 | 2 | |
| G3a | انخفاض بشكل معتدل إلى معتدل | 45-59 | 1 | 2 | 3 | |
| G3b | انخفاض بشكل معتدل إلى شديد | 30-44 | 2 | 3 | 3 | |
| G4 | انخفاض شديد | 15-29 | 3 | 4+ | 4+ | |
| G5 | فشل كلوي | <15 | 4+ | 4+ | 4+ | |
| تشير الأرقام من 1 إلى 4 إلى خطر التقدم وكذلك تكرار المراقبة (عدد المرات في السنة). | ||||||
معدل الترشيح الكبيبي 60 مل/دقيقة/ 1.73 م 2 يعتبر طبيعيًا بدون أمراض الكلى المزمنة إذا لم يكن هناك تلف في الكلى.
يُعرّف تلف الكلى علامات التلف التي تظهر في الدم أو البول أو دراسات التصوير والتي تشمل نسبة الألبومين/الكرياتينين في المختبر ≥ 30. يتم تعريف جميع الأشخاص الذين لديهم معدل ترشيح الدم الكبيبي <60 مل/ دقيقة/ 1.73 م 2 لمدة 3 أشهر على أنهم مصابون بمرض كلوي مزمن.
يعتبر وجود البروتين في البول علامة مستقلة لتدهور وظائف الكلى وأمراض القلب والأوعية الدموية.
- المرحلة 1: تقلص طفيف في الوظيفة؛ تلف الكلى مع معدل الترشيح الكبيبي الطبيعي أو المرتفع نسبيًا (≥90 مل/دقيقة/1.73 م 2) وبيلة الزلال المستمرة. يُعرَّف تلف الكلى بأنه تشوهات مرضية أو علامات للضرر، بما في ذلك التشوهات في اختبارات الدم أو البول أو دراسات التصوير.
- المرحلة 2: انخفاض طفيف في معدل الترشيح الكبيبي (60-89 مل/دقيقة/1.73 م 2) مع تلف الكلى. يُعرَّف تلف الكلى بأنه تشوهات مرضية أو علامات للضرر، بما في ذلك التشوهات في اختبارات الدم أو البول أو دراسات التصوير.
- المرحلة 3: انخفاض معتدل في معدل الترشيح الكبيبي (30-59 مل/دقيقة/1.73 م 2). تميز الدلائل الإرشادية البريطانية بين المرحلة 3A (معدل الترشيح الكبيبي 45-59) والمرحلة 3B (معدل الترشيح الكبيبي 30-44) لأغراض الفحص والإحالة.
- المرحلة 4: انخفاض حاد في معدل الترشيح الكبيبي (15-29 مل/دقيقة/1.73 م 2) التحضير للعلاج باستبدال الكلى.
- المرحلة 5: فشل كلوي مؤكد (معدل الترشيح الكبيبي <15 مل / دقيقة / 1.73 م 2)، علاج دائم باستبدال الكلى، أو مرض الكلى في المرحلة النهائية.
العلاج
بصرف النظر عن السيطرة على عوامل الخطر الأخرى، فإن الهدف من العلاج هو إبطاء أو وقف تقدم مرض الكلى المزمن. يعتبر التحكم في ضغط الدم وعلاج المرض الأصلي من المبادئ العامة للعلاج.[بحاجة لمصدر]
ضغط الدم
يوصى باستخدام مثبطات الإنزيم المحول للأنجيوتنسين أو مضادات مستقبلات الأنجيوتينسن II كعوامل الخط الأول حيث تم اكتشاف أنها تعمل على إبطاء تدهور وظائف الكلى، مقارنة بالانخفاض السريع في أولئك الذين ليسوا على أحد هذه العوامل. كما وجد أنها تقلل من مخاطر الأحداث القلبية الوعائية الرئيسية مثل احتشاء عضلة القلب والسكتة الدماغية وفشل القلب والوفاة من أمراض القلب والأوعية الدموية عند مقارنتها بالدواء الوهمي لدى الأفراد المصابين بمرض الكلى المزمن. قد تكون مثبطات الإنزيم المحول للأنجيوتنسين متفوقة على حاصرات مستقبلات الأنجيوتنسين للحماية من التقدم إلى الفشل الكلوي والوفاة من أي سبب في المصابين بمرض الكلى المزمن.[11] خفض ضغط الدم العدواني يقلل من خطر وفاة الناس.
تدابير أخرى
- ينصح بالعلاج المكثف لارتفاع نسبة الدهون في الدم.[29]
- قد يؤدي اتباع نظام غذائي منخفض البروتين والملح إلى تقدم أبطأ لمرض الكلى المزمن وانخفاض في البيلة البروتينية بالإضافة إلى التحكم في أعراض مرض الكلى المزمن المتقدم لتأخير بدء غسيل الكلى. النظام الغذائي منخفض البروتين المصمم خصيصًا للحموضة المنخفضة قد يساعد في منع تلف الكلى للأشخاص المصابين بمرض الكلى المزمن. بالإضافة إلى ذلك، فإن التحكم في تناول الملح يساعد في تقليل الإصابة بأمراض القلب التاجية، وخفض ضغط الدم وتقليل البول الزلالي.
- فقر الدم - يوصى بمستوى هيموجلوبين مستهدف يبلغ 9-12 جم/ديسيلتر؛[30][31] لم يتم العثور على فائدة لرفع مستويات الهيموجلوبين إلى المعدل الطبيعي.
- توصي الدلائل الإرشادية بالعلاج بالحديد بالحقن قبل العلاج بالإريثروبويتين.
- غالبًا ما يكون استبدال إرثروبويتين ضروريًا للأشخاص المصابين بمرض متقدم.[32]
- من غير الواضح ما إذا كانت الأندروجينات تحسن فقر الدم.[33]
- يوصى باستخدام الكالسيتريول لعلاج نقص فيتامين د والسيطرة على أمراض العظام الأيضية.
- تستخدم مواد رابطة الفوسفات للتحكم في مستويات الفوسفات في الدم، والتي عادة ما تكون مرتفعة في أمراض الكلى المزمنة المتقدمة.
- قد تحسن مثبطات الفوسفوديستيراز -5 والزنك من الضعف الجنسي لدى الرجال.
تدخلات أسلوب الحياة
قد يكون للسمنة تأثير سلبي على مرض الكلى المزمن، مما يزيد من خطر تطور المرض إلى الفشل الكلوي مقارنةً بالضوابط ذات الوزن الصحي،[34] وعندما تكون في مراحل متقدمة قد تعيق أيضًا أهلية الناس لزرع الكلى.[35] تمت دراسة تدخلات إدارة الوزن لدى البالغين الذين يعانون من زيادة الوزن والسمنة المصابين بمرض الكلى المزمن (بمراحل مختلفة) لتقييم سلامتها وفعاليتها. جمعت مراجعة منهجية حديثة أدلة من 17 دراسة قيمت نمط الحياة (بما في ذلك النظام الغذائي، والنشاط البدني/التمارين الرياضية، أو الاستراتيجيات السلوكية المستخدمة في العزلة أو مجتمعة)، والأدوية (المستخدمة لتقليل الامتصاص أو قمع الشهية) والتدخلات الجراحية.[36] خلصت المراجعة إلى أن تدخلات نمط الحياة قد توفر بعض الفوائد الصحية، وهي تحسين وزن الجسم وكوليسترول البروتين الدهني منخفض الكثافة وضغط الدم الانبساطي، مقارنة بالرعاية المعتادة أو الضوابط. ما إذا كانت هذه الفوائد تمتد للمساعدة في الحد من أحداث القلب والأوعية الدموية ووظائف الكلى وخطر الموت غير مؤكد. استندت هذه الاستنتاجات إلى أدلة ذات جودة منخفضة للغاية، لذلك هناك حاجة إلى دراسات قوية في المستقبل. وبالتالي، فمن المستحسن أن تكون تدخلات إدارة الوزن فردية، وفقًا لتقييم شامل للمرضى فيما يتعلق بالحالة السريرية والدوافع والتفضيلات.[بحاجة لمصدر]
النوم
يعاني الأشخاص المصابون بمرض الكلى المزمن من اضطرابات النوم، وبالتالي لا يتمكنون من الحصول على نوم جيد. هناك العديد من الإستراتيجيات التي يمكن أن تساعد، مثل تقنيات الاسترخاء والتمارين الرياضية والعلاج بالإبر والأدوية:[37]
- التمرين: تظهر الأدلة الضعيفة أن التمرين قد يكون مفيدًا في تنظيم النوم. ومع ذلك، قد تقلل التمارين من التعب والاكتئاب لدى الأشخاص المصابين بمرض الكلى المزمن.
- العلاج بالإبر: تشير الدلائل إلى أن هذه التقنية قد يكون لها تأثيرات طفيفة على الكمون ومدة النوم، وكذلك على تقليل التعب، على الرغم من أن هذه النتائج غير موثوقة بسبب تنوع الاستنتاجات في العديد من المقالات.
على الرغم من جميع الخيارات المتاحة التي تمت دراستها حتى الآن، إلا أن الأدلة تشير إلى عدم فعالية أي منها في علاج اضطرابات النوم. هذا يعني أننا غير قادرين على استنتاج ما هو أفضل دليل لتحسين نوعية النوم في هذا النوع من السكان.
الإحالة إلى أخصائي أمراض الكلى
تختلف المبادئ التوجيهية للإحالة إلى أخصائي أمراض الكلى بين البلدان. يتفق معظمهم على أن الإحالة إلى طب الكلى مطلوبة في المرحلة 4 من كد (عندما يكون معدل الترشيح الكبيبي المقدر/ 1.73 م 2 أقل من 30 مل/دقيقة؛ أو يتناقص بأكثر من 3 مل/دقيقة/سنة).[38]
قد يكون مفيدًا أيضًا في مرحلة مبكرة عندما تكون نسبة الألبومين في البول إلى الكرياتينين أكثر من 30 مجم/مليمول، عندما يكون من الصعب التحكم في ضغط الدم، أو عندما تشير البيلة الدموية أو النتائج الأخرى إلى وجود اضطراب في الكبيبات في المقام الأول أو مرض ثانوي قابل للعلاج المحدد. تشمل الفوائد الأخرى للإحالة المبكرة لأمراض الكلى التثقيف المناسب فيما يتعلق بخيارات العلاج البديل للكلى بالإضافة إلى الزرع الوقائي، والعمل في الوقت المناسب ووضع الناسور الشرياني الوريدي في الأشخاص المصابين بمرض كلوي مزمن ويختارون غسيل الكلى في المستقبل.[بحاجة لمصدر]
العلاج البديل الكلوي
في المرحلة الخامسة من مرض الكلى المزمن، عادة ما يكون العلاج البديل للكلية مطلوبًا، في شكل غسيل الكلى أو زرع الكلى.
في مرض الكلى المزمن، تتراكم العديد من السموم البوليسية في الدم. حتى عندما يتم العلاج بغسيل الكلى، فإن مستويات السموم لا تعود إلى وضعها الطبيعي لأن غسيل الكلى ليس بهذه الفعالية. وبالمثل، بعد زراعة الكلى، قد لا تعود المستويات إلى طبيعتها لأن الكلى المزروعة قد لا تعمل بنسبة 100٪. إذا كان الأمر كذلك، فغالبًا ما يكون مستوى الكرياتينين طبيعيًا. تُظهر السموم العديد من الأنشطة السامة للخلايا في المصل ولها أوزان جزيئية مختلفة، وبعضها مرتبط ببروتينات أخرى، بالأساس الألبومين. يتم تصنيف السموم اليوريمية إلى ثلاث مجموعات على أنها مواد مذابة صغيرة قابلة للذوبان في الماء، ومذابات متوسطة الوزن الجزيئي، ومذابات مرتبطة بالبروتين. أدى غسيل الكلى بغشاء غسيل الكلى عالي التدفق، والعلاج الطويل أو المتكرر، وزيادة تدفق الدم/الديالة إلى تحسين إزالة السموم اليوريمية ذات الوزن الجزيئي الصغير والقابلة للذوبان في الماء. تتم إزالة الجزيئات ذات الوزن الجزيئي المتوسط بشكل أكثر فعالية مع غسيل الكلى باستخدام غشاء عالي التدفق وترشيح الدم وترشيح الدم. ومع ذلك، فإن علاج غسيل الكلى التقليدي محدود في قدرته على إزالة السموم البوليسية المرتبطة بالبروتين.[39]
المَآل
يزيد مرض الكلى المزمن من خطر الإصابة بأمراض القلب والأوعية الدموية، وغالبًا ما يعاني الأشخاص المصابون بمرض الكلى المزمن من عوامل خطر أخرى للإصابة بأمراض القلب، مثل ارتفاع نسبة الدهون في الدم. السبب الأكثر شيوعًا للوفاة بين المصابين بمرض الكلى المزمن هو أمراض القلب والأوعية الدموية وليس الفشل الكلوي.
ينتج عن مرض الكلى المزمن معدل وفيات أسوأ لجميع الأسباب (معدل الوفيات الإجمالي) والذي يزيد مع انخفاض وظائف الكلى.[40] السبب الرئيسي للوفاة في مرض الكلى المزمن هو أمراض القلب والأوعية الدموية، بغض النظر عما إذا كان هناك تقدم إلى المرحلة 5.
في حين أن علاجات استبدال الكلى يمكن أن تحافظ على الناس إلى أجل غير مسمى وتطيل العمر، فإن جودة حياة تتأثر سلبًا.[41][42] يزيد زرع الكلى من بقاء الأشخاص المصابين بالمرحلة الخامسة من مرض الكلى المزمن مقارنة بالخيارات الأخرى؛[43][44] ومع ذلك، فإنه يرتبط بزيادة معدل الوفيات على المدى القصير بسبب مضاعفات الجراحة. بغض النظر عن الزرع، يبدو أن غسيل الكلى المنزلي عالي الكثافة مرتبط بتحسين البقاء على قيد الحياة ونوعية حياة أفضل، بالمقارنة مع غسيل الكلى التقليدي ثلاث مرات في الأسبوع وغسيل الكلى البريتوني.[45]
الأشخاص المصابون بداء الكلى الكلوي في الكلى معرضون بشكل عام لخطر متزايد للإصابة بالسرطان. هذا الخطر مرتفع بشكل خاص لدى الشباب ويتناقص تدريجيًا مع تقدم العمر. توصي المنظمات المهنية المتخصصة الطبية بأن الأطباء لا يقومون بإجراء فحوصات روتينية للسرطان للأشخاص ذوي متوسط العمر المتوقع المحدود بسبب المرحلة النهائية لمرض الكلي لأن الأدلة لا تظهر أن مثل هذه الاختبارات تؤدي إلى نتائج أفضل.[46][47]
المراجع
- "What Is Chronic Kidney Disease? | NIDDK"، National Institute of Diabetes and Digestive and Kidney Diseases (باللغة الإنجليزية)، مؤرشف من الأصل في 20 ديسمبر 2021، اطلع عليه بتاريخ 18 يناير 2022.
- "End Stage Renal Disease (ESRD)"، www.hopkinsmedicine.org (باللغة الإنجليزية)، مؤرشف من الأصل في 25 ديسمبر 2021، اطلع عليه بتاريخ 18 يناير 2022.
- Liao, Min-Tser؛ Sung؛ Hung؛ Wu؛ Lo؛ Lu (2012)، "Insulin Resistance in Patients with Chronic Kidney Disease"، Journal of Biomedicine and Biotechnology، 2012: 691369، doi:10.1155/2012/691369، ISSN 1110-7243، PMID 22919275، مؤرشف من الأصل في 20 يناير 2022.
- "Kidney Failure"، medlineplus.gov، مؤرشف من الأصل في 18 نوفمبر 2021، اطلع عليه بتاريخ 18 يناير 2022.
- "Wayback Machine" (PDF)، web.archive.org، مؤرشف من الأصل في 13 ديسمبر 2016، اطلع عليه بتاريخ 18 يناير 2022.
{{استشهاد ويب}}: صيانة CS1: BOT: original-url status unknown (link) - "Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980–2015: a systematic analysis for the Global Burden of Disease Study 2015"، Lancet (London, England)، 388 (10053): 1459–1544، 08 أكتوبر 2016، doi:10.1016/S0140-6736(16)31012-1، ISSN 0140-6736، PMID 27733281، مؤرشف من الأصل في 13 سبتمبر 2021.
- "Summary of Recommendation Statements"، Kidney International Supplements، 3 (1): 5–14، 2013-01، doi:10.1038/kisup.2012.77، ISSN 2157-1724، PMID 25598998، مؤرشف من الأصل في 14 أغسطس 2021.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ=(مساعدة) - Fred F. (25 مايو 2017)، Ferri's Clinical Advisor 2018 E-Book: 5 Books in 1 (باللغة الإنجليزية)، Elsevier Health Sciences، ISBN 978-0-323-52957-0، مؤرشف من الأصل في 28 أغسطس 2021.
- "Chronic Kidney Disease Tests & Diagnosis | NIDDK"، National Institute of Diabetes and Digestive and Kidney Diseases (باللغة الإنجليزية)، مؤرشف من الأصل في 24 نوفمبر 2021، اطلع عليه بتاريخ 19 يناير 2022.
- "Managing Chronic Kidney Disease | NIDDK"، National Institute of Diabetes and Digestive and Kidney Diseases (باللغة الإنجليزية)، مؤرشف من الأصل في 30 ديسمبر 2021، اطلع عليه بتاريخ 19 يناير 2022.
- Xie, Xinfang؛ Liu؛ Perkovic؛ Li؛ Ninomiya؛ Hou؛ Zhao؛ Liu؛ Lv (01 مايو 2016)، "Renin-Angiotensin System Inhibitors and Kidney and Cardiovascular Outcomes in Patients With CKD: A Bayesian Network Meta-analysis of Randomized Clinical Trials"، American Journal of Kidney Diseases (باللغة الإنجليزية)، 67 (5): 728–741، doi:10.1053/j.ajkd.2015.10.011، ISSN 0272-6386، مؤرشف من الأصل في 19 يناير 2022.
- Wile, David (01 سبتمبر 2012)، "Diuretics: a review"، Annals of Clinical Biochemistry (باللغة الإنجليزية)، 49 (5): 419–431، doi:10.1258/acb.2011.011281، ISSN 0004-5632، مؤرشف من الأصل في 21 ديسمبر 2021.
- "Eating Right for Chronic Kidney Disease | NIDDK"، National Institute of Diabetes and Digestive and Kidney Diseases (باللغة الإنجليزية)، مؤرشف من الأصل في 7 ديسمبر 2021، اطلع عليه بتاريخ 19 يناير 2022.
- "Anemia in Chronic Kidney Disease | NIDDK"، National Institute of Diabetes and Digestive and Kidney Diseases (باللغة الإنجليزية)، مؤرشف من الأصل في 15 ديسمبر 2021، اطلع عليه بتاريخ 19 يناير 2022.
- "Mineral & Bone Disorder in Chronic Kidney Disease | NIDDK"، National Institute of Diabetes and Digestive and Kidney Diseases (باللغة الإنجليزية)، مؤرشف من الأصل في 24 ديسمبر 2021، اطلع عليه بتاريخ 19 يناير 2022.
- "Kidney Failure | NIDDK"، National Institute of Diabetes and Digestive and Kidney Diseases (باللغة الإنجليزية)، مؤرشف من الأصل في 17 ديسمبر 2021، اطلع عليه بتاريخ 19 يناير 2022.
- Bikbov, Boris؛ Perico؛ Remuzzi (23 مايو 2018)، "Disparities in Chronic Kidney Disease Prevalence among Males and Females in 195 Countries: Analysis of the Global Burden of Disease 2016 Study"، doi:10.1159/000489897، مؤرشف من الأصل في 28 أغسطس 2021.
{{استشهاد بدورية محكمة}}: Cite journal requires|journal=(مساعدة) - "Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013"، Lancet، 385 (9963): 117–171، 10 يناير 2015، doi:10.1016/S0140-6736(14)61682-2، ISSN 0140-6736، PMID 25530442، مؤرشف من الأصل في 3 يوليو 2021.
- "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015"، Lancet (London, England)، 388 (10053): 1545–1602، 08 أكتوبر 2016، doi:10.1016/S0140-6736(16)31678-6، ISSN 0140-6736، PMID 27733282، مؤرشف من الأصل في 22 ديسمبر 2021.
- "USRDS Home"، web.archive.org، 08 فبراير 2007، مؤرشف من الأصل في 8 فبراير 2007، اطلع عليه بتاريخ 19 يناير 2022.
{{استشهاد ويب}}: صيانة CS1: BOT: original-url status unknown (link) - Kalantar-Zadeh K, Lockwood MB, Rhee CM, Tantisattamo E, Andreoli S, Balducci A, Laffin P, Harris T, Knight R, Kumaraswami L, Liakopoulos V, Lui SF, Kumar S, Ng M, Saadi G, Ulasi I, Tong A, Li PK (Jan 3, 2022). "Patient-centred approaches for the management of unpleasant symptoms in kidney disease". Nat Rev Nephrol. 18 (2): 001–017. doi:10.1038/s41581-021-00518-z. PMID 34980890. S2CID 245636182.
- Arora P, Aronoff GR, Mulloy LL, Talavera F, Verrelli M (2018-09-16). Batuman V (ed.). "Chronic Kidney Disease". Medscape.
- Faul, Christian؛ Amaral؛ Oskouei؛ Hu؛ Sloan؛ Isakova؛ Gutiérrez؛ Aguillon-Prada؛ Lincoln (01 نوفمبر 2011)، "FGF23 induces left ventricular hypertrophy"، The Journal of Clinical Investigation، 121 (11): 4393–4408، doi:10.1172/JCI46122، ISSN 0021-9738، PMID 21985788، مؤرشف من الأصل في 18 نوفمبر 2021.
- Brandenburg VM, Cozzolino M, Ketteler M (2011). "Calciphylaxis: a still unmet challenge". Journal of Nephrology. 24 (2): 142–8. doi:10.5301/jn.2011.6366. PMID 21337312.
- Adrogué HJ, Madias NE (September 1981). "Changes in plasma potassium concentration during acute acid-base disturbances". The American Journal of Medicine. 71 (3): 456–67. doi:10.1016/0002-9343(81)90182-0. PMID 7025622.
- Vecchio M, Navaneethan SD, Johnson DW, Lucisano G, Graziano G, Saglimbene V, et al. (Cochrane Kidney and Transplant Group) (December 2010). "Interventions for treating sexual dysfunction in patients with chronic kidney disease". The Cochrane Database of Systematic Reviews (12): CD007747. doi:10.1002/14651858.CD007747.pub2. PMID 21154382.
- Qaseem, Amir؛ Hopkins؛ Sweet؛ Starkey؛ Shekelle (17 ديسمبر 2013)، "Screening, Monitoring, and Treatment of Stage 1 to 3 Chronic Kidney Disease: A Clinical Practice Guideline From the American College of Physicians"، Annals of Internal Medicine، 159 (12): 835–847، doi:10.7326/0003-4819-159-12-201312170-00726، ISSN 0003-4819، مؤرشف من الأصل في 20 يناير 2022.
- Weckmann, Gesine F C؛ Stracke؛ Haase؛ Spallek؛ Ludwig؛ Angelow؛ Emmelkamp؛ Mahner؛ Chenot (11 أكتوبر 2018)، "Diagnosis and management of non-dialysis chronic kidney disease in ambulatory care: a systematic review of clinical practice guidelines"، BMC Nephrology، 19: 258، doi:10.1186/s12882-018-1048-5، ISSN 1471-2369، PMID 30305035، مؤرشف من الأصل في 7 يوليو 2021.
- Chauhan V, Vaid M (November 2009). "Dyslipidemia in chronic kidney disease: managing a high-risk combination". Postgraduate Medicine. 121 (6): 54–61. doi:10.3810/pgm.2009.11.2077. PMID 19940417. S2CID 22730176.
- Locatelli F, Aljama P, Canaud B, Covic A, De Francisco A, Macdougall IC, et al. (September 2010). "Target haemoglobin to aim for with erythropoiesis-stimulating agents: a position statement by ERBP following publication of the Trial to reduce cardiovascular events with Aranesp therapy (TREAT) study". Nephrology, Dialysis, Transplantation. 25 (9): 2846–50. doi:10.1093/ndt/gfq336. PMID 20591813.
- "Validate User"، jamanetwork.com، doi:10.1001/archinternmed.2009.112، مؤرشف من الأصل في 19 يناير 2022، اطلع عليه بتاريخ 19 يناير 2022.
- "Anaemia management in people with chronic kidney disease | Guidance | NICE"، www.nice.org.uk، مؤرشف من الأصل في 11 يونيو 2021، اطلع عليه بتاريخ 19 يناير 2022.
- Yang Q, Abudou M, Xie XS, Wu T (October 2014). "Androgens for the anaemia of chronic kidney disease in adults". The Cochrane Database of Systematic Reviews. 10 (10): CD006881. doi:10.1002/14651858.CD006881.pub2. PMID 25300168.
- "The Dose-Response Relationship Between Body Mass Index and the Risk of Incident Stage ≥3 Chronic Kidney Disease in a General Japanese Population: The Ibaraki Prefectural Health Study (IPHS)"، Journal of Epidemiology، 24 (6): 444–451، 05 نوفمبر 2014، doi:10.2188/jea.JE20140028، ISSN 0917-5040، PMID 24998954، مؤرشف من الأصل في 20 نوفمبر 2021.
- Ladhani M, Craig JC, Irving M, Clayton PA, Wong G (March 2017). "Obesity and the risk of cardiovascular and all-cause mortality in chronic kidney disease: a systematic review and meta-analysis". Nephrology, Dialysis, Transplantation. 32 (3): 439–449. doi:10.1093/ndt/gfw075. PMID 27190330.
- Conley MM, McFarlane CM, Johnson DW, Kelly JT, Campbell KL, MacLaughlin HL, et al. (Cochrane Kidney and Transplant Group) (March 2021). "Interventions for weight loss in people with chronic kidney disease who are overweight or obese". The Cochrane Database of Systematic Reviews. 3 (3): CD013119. doi:10.1002/14651858.CD013119.pub2. PMC 8094234. PMID 33782940.
- Natale, Patrizia؛ Ruospo؛ Saglimbene؛ Palmer؛ Strippoli (26 مايو 2019)، "Interventions for improving sleep quality in people with chronic kidney disease"، The Cochrane Database of Systematic Reviews، 2019 (5): CD012625، doi:10.1002/14651858.CD012625.pub2، ISSN 1469-493X، PMID 31129916، مؤرشف من الأصل في 19 يناير 2022.
- "Stage 4 of chronic kidney disease CKD"، www.davita.com (باللغة الإنجليزية)، مؤرشف من الأصل في 19 نوفمبر 2021، اطلع عليه بتاريخ 19 يناير 2022.
- Yamamoto, Suguru؛ Kazama؛ Wakamatsu؛ Takahashi؛ Kaneko؛ Goto؛ Narita (14 سبتمبر 2016)، "Removal of uremic toxins by renal replacement therapies: a review of current progress and future perspectives"، Renal Replacement Therapy، 2 (1): 43، doi:10.1186/s41100-016-0056-9، ISSN 2059-1381، مؤرشف من الأصل في 14 مايو 2021.
- Perazella MA, Khan S (March 2006). "Increased mortality in chronic kidney disease: a call to action". The American Journal of the Medical Sciences. 331 (3): 150–3. doi:10.1097/00000441-200603000-00007. PMID 16538076. S2CID 22569162.
- Heidenheim AP, Kooistra MP, Lindsay RM (2004). "Quality of life". Daily and Nocturnal Hemodialysis. Contrib Nephrol. Contributions to Nephrology. 145. pp. 99–105. doi:10.1159/000081673. ISBN 978-3-8055-7808-0. PMID 15496796.
- de Francisco AL, Piñera C (January 2006). "Challenges and future of renal replacement therapy". Hemodialysis International. 10 (Suppl 1): S19-23. doi:10.1111/j.1542-4758.2006.01185.x. PMID 16441862. S2CID 6826119.
- Groothoff JW (July 2005). "Long-term outcomes of children with end-stage renal disease". Pediatric Nephrology. 20 (7): 849–53. doi:10.1007/s00467-005-1878-9. PMID 15834618. S2CID 11725547.
- Giri M (2004). "Choice of renal replacement therapy in patients with diabetic end stage renal disease". EDTNA/ERCA Journal. 30 (3): 138–42. doi:10.1111/j.1755-6686.2004.tb00353.x. PMID 15715116.
- Pierratos A, McFarlane P, Chan CT (March 2005). "Quotidian dialysis--update 2005". Current Opinion in Nephrology and Hypertension. 14 (2): 119–24. doi:10.1097/00041552-200503000-00006. PMID 15687837. S2CID 9807935.
- "American Society of Nephrology | Choosing Wisely"، www.choosingwisely.org (باللغة الإنجليزية)، 24 فبراير 2015، مؤرشف من الأصل في 27 ديسمبر 2021، اطلع عليه بتاريخ 19 يناير 2022.
- Chertow GM, Paltiel AD, Owen WF, Lazarus JM (June 1996). "Cost-effectiveness of cancer screening in end-stage renal disease". Archives of Internal Medicine. 156 (12): 1345–50. doi:10.1001/archinte.1996.00440110117016. PMID 8651845.
وصلات خارجية
- بوابة طب