معادلة كلاوزيوس-كلابيرون
معادلة كلاوزيوس-كلابيرون في الكيمياء المعادلة تحمل اسم معرفينها كلاوزيوس وكلابيرون من عام 1834م - وهي صيغة لوصف تحول طوري غير مستمر (بالإنجليزية: Discontinuous) من طور لآخر (مثل تحول الثلج (طور صلب) إلى ماء (طور سائل)).
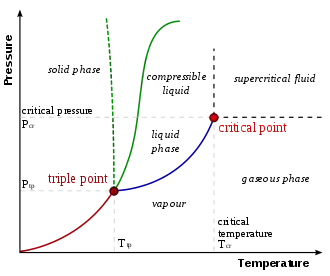
في مخطط الضغط ودرجة الحرارة P–T diagram تعرف الخط الذي بفصل بين الطورين بمنحنى الطورين. وتعطينا معادلة كلاوزيوس-كلابيرون انحدار مماس منحنى الطورين. والمعادلة هي :
حيث:
- هو انحدار خط التماس الملامس لمنحنى مخطط الضغط درجة الحرارة عند أي نقطة ,
- الحرارة الكامنة النوعية،
- تغير الحجم النوعي للمادة عند انتقال المادة من طور إلى طور.
مثال
تجيب المعادلة أيضا على السؤال : ما هو الضغط اللازم لانصهار الثلج غند درجة حرارة أقل بمقدار من الصفر المئوي؟
(مع ملاحظة أن حجم الثلج يكون أكبر من حجم الماء، وهذه خاصية خاصة بالماء فقط ! فيكون فرق الحجم بعد الانصهار ذو إشارة سالبة.)
تقول المعادلة :
ونقوم بالتعويض فيها بالمقادير :
- = 3.34×105 J/kg حرارة الانصهار للماء وهي بالجول/كيلوجرام,
- = 273 كلفن (درجة الحرارة),
- = −9.05×10−5 m³/kg (تغير حجم الثلج بتحوله إلى سائل، وهو هنا بالمتر المكعب/كيلوجرام),
فنحصل على:
- =− 13.5 MPa/K
، أي التغير في الضغط لكل درجة حرارة واحدة مقداره -5 و13 ميجا باسكال/ كلفن.
فإذا أردنا معرفة الضغط اللازم لانصهار الثلج عند درجة حرارة −7 تحت الصفر المئوي سيعادل وزن 1000 كيلوجرام على 1 سنتيمتر مربع [يعادل نحو 100 ضغط جوي].[1])
اشتقاقها
(انظر معادلة كلابيرون)
اقرأ أيضا
مراجع
- Zorina, Yana (2000)، "Mass of a Car"، The Physics Factbook، مؤرشف من الأصل في 25 مايو 2018.
- بوابة الفيزياء
- بوابة طقس