هيبارين
الهيبارين، مشتقة من الكلمة يونانية القديمة (Hepar) و تعني الكبد، هو عبارة عن جلوكوزأمينوجلايكان المكبرَت بصورة عالية، وعادةً ما يستخدم بشكل واسع كمضاد لتخثر الدم على شكل حُقن. و يمتلك جزيء الهيبارين أعلى كثافة سالبة، بين كل الجزيئات الحيوية المعروفة .[4]كما يمكن أن يستخدم لتكوين سطح داخلي مضاد للتخثر في العديد من الأدوات المخبرية والطبية مثل أنابيب الاختبار وآلات غسيل الكلى.
| هيبارين | |
|---|---|
 | |
 هيبارين | |
| الاسم النظامي | |
| طالع تركيب الهيبارين | |
| يعالج | |
| اعتبارات علاجية | |
| ASHPDrugs.com | أفرودة |
| فئة السلامة أثناء الحمل | C[2] |
| طرق إعطاء الدواء | i.v., s.c. |
| بيانات دوائية | |
| توافر حيوي | غير منتظم |
| استقلاب (أيض) الدواء | كبدي |
| عمر النصف الحيوي | ساعة ونصف |
| إخراج (فسلجة) | البول[3] |
| معرّفات | |
| CAS | 9005-49-6 |
| ك ع ت | B01B01AB01 AB01 C05BA03 (WHO) S01XA14 (WHO) |
| بوب كيم | CID 22833565 |
| IUPHAR | 4214 |
| ECHA InfoCard ID | 100.029.698 |
| درغ بنك | DB01109 |
| كيم سبايدر | 17216115 |
| المكون الفريد | T2410KM04A |
| كيوتو | C00374 |
| ChEMBL | CHEMBL526514 |
| بيانات كيميائية | |
| الصيغة الكيميائية | C12H19NO20S3 |
| الكتلة الجزيئية | 12000–15000 غم/مول |
على الرغم من استخدامه بشكل أساسي في الطب كمضاد لتخثر الدم، إلا أن وظيفته الحيوية في جسم الإنسان لم تزل غير واضحة، وذلك لأن تخثر الدم في جسم الإنسان يتحقق بواسطة ( كبريتات الهيباران ) المستمدة من الخلايا البطانية ( بطانة غشائية ) .[5] عادة ما يتم تخزين الهيبارين في الحويصلات الافرازية للخلايا الصارية الدفاعية ( خلية صارية ) - و هي إحدى أنواع خلايا الدم البيضاء - ، و يتم إطلاقه من داخل هذه الخلايا داخل الأوعية الدموية في موقع النسيج المتضرر فقط . و قد اقتُرح أن الوظيفة الأساسية للهيبارين هي الدفاع ضد البكتيريا والأجسام الغريبة في المنطقة المتضررة من النسيج الذي يتم إفرازه فيها، بدلا من اعتبار وظيفته الاساسية مضادا للتخثر .[6] بالإضافة إلى ملاحظة وجود الهيبارين في عدد واسع من مختلف أنواع الكائنات الحية - و من ضمنها اللافقاريات - ، التي لا تمتلك نظام تخثر دم مشابه للإنسان.
في الطبيعة، الهيبارين مبلمر يختلف في طول سلاسل الكربون . صيدلانيا «الهيبارين غير المجزأ» هو الذي لم يتم تكسيره إلى أجزاء حفاظا على الأجزاء ذات الكتلة المولية المنخفضة، في المقابل الهيبارين ذو الكتلة المولية المرتفعة يتم تجزئته وذلك لتصبح خصائص الديناميكية الدوائية أكثر قابلية للتنبؤ.
كما يصنف الهيبارين في منظمة الصحة العالمية من قائمة الأدوية الاساسية، تعتبر هذه القائمة من الأدوية الأكثر أهمية التي نحتاجها في النظام الصحي الاساسي.[7]
الاستخدام الطبي
الهيبارين هو مضاد للتخثر يتكون طبيعيا، ويتم إنتاجه عن طريق القَعِدات (basophils) و الخلاية البَدينة (mast cells) [8] .و يعمل الهيبارين كمضاد للتخثر فيمنع تكوّن أو امتداد الجُلطة الدموية .و لكنه لا يحلل خثرة أو جُلطة دموية تم تكوينها بخلاف منشط البلازمينوجين ( tissue plasminogen activator ) . من ناحية أخرى يسمح الهيبارين لآليات تحليل الخثرة الدموية الذاتي للعمل طبيعيا وذلك ليتم التخلص من الخثرات الدموية التي تم تكوينها .
يستخدم الهيبارين بشكل عام مضادا للتخثر بالحالات التالية :
- متلازمة الشريان التاجيّ الحادّة
- الرَجَفان الأذينيّ
- خُثار الأوردة العميقة و الانصِمام الرِئوي
- مجازة قَلبيّة رئويّة لجراحة القلب
- الانعاش الحيويّ المتقدِم خارِج الجسم (ECMO circuit )
- ترشيح الدم
- القثاطير خيطيّة الرؤوس في الاوردة المحيطية
- حفظ بالبرودة (cryonics) [9][10]
الآثار الجانبية
من الآثار الجانبية الخطيرة للهيبارين، قلّة الصفيحات -المحفّز بالهيبارين- ، الذي يسببه تفاعل مناعي يجعل الصفيحات الدموية هدف للاستجابة المناعيّة، وذلك يؤدي إلى تحلل الصفيحات الذي يسبب قلة الصفيحات . من الممكن إرجاع الصفيحات إلى وضعها الطبيعي عن طريق إيقاف أخذ الهيبارين أو استخدام الهيبارين المصنّع للعلاج. و هنالك نوع حميد من قلة الصفيحات مرتبط ببداية استخدام الهيبارين، والذي يمكن أن يختفي دون التوقف عن أخذ الهيبارين . يوجد اثنين من الآثار الجانبية للعلاج بالهيبارين غير مرتبطة بالنزف، الأولى: ارتفاع ناقلات الامين ( aminotransferase ) في الدم، والذي تم الإبلاغ عنها في حوالي 80% من المرضى الذين يعالجون بالهيبارين، هذه الحالة غير الطبيعية غير مرتبطة بفشل الكبد، وتختفي في حالم تم وقف الهيبارين . الثانية: ارتفاع البوتاسيوم في الدم والتي تحدث 5%-10% من المرضى، وتنتج عن تثبيط هرمون الدوستيرون –المحفّز بالهبارين - (heparin-induced aldosterone suppression) ، ارتفاع نسبة البوتاسيوم في الدم ممكن أن تظهر خلال أيام قليلة بعد البدء في العلاج بالهيبارين . بشكل نادر من الممكن أن يصيب الجلد مرض الثعلبة بالإضافة إلى احتمال الإصابة بتخلخل العظام كآثار جانبية للاستخدام المزمن للهيبارين . و الهيبارين كالعديد من الادوية الأخرى، جرعة مفرطة منه قد تكون مميتة . في أيلول 2006 تلقى الهيبارين دعاية في جميع أنحاء العالم بعدما توفى ثلاثة أطفال رُضّع بسبب جرعة زائدة من الهيبارين في مستشفى انديانابوليس.[11]
التِرياق لجرعة الهيبارين الزائدة
سلفات البروتامين (Protamine Sulphate) – 1 مغ /100 وحدة هيبارين، تعطى خلال 4 ساعات من جرعة الهيبراين الزائدة – لتعاكس تأثير الهيبارين المضاد للتخثر) .[12]
آلية العمل
الهيبارين ومشتقاته ذات الكتلة المولية الصغيرة (انوكسابرين، دالتيبارين، تينزابرين) فعّالين في منع خُثار الأوردة العميقة والانصمام الرئوي، في المرضى المتوقع اصابتهم,[13][14] ، لكن ليس هناك أي دليل على أن هناك أفضلية فيما بينهم في منع الوفيات.[15] يرتبط الهيبارين بمضاد الثرومبين 3 ( antithrombin 3 ) ، مما يسبب تغيير في بناءه يؤدي إلى تنشيطه، عن طريق زيادة المرونة في الموقع الفعَال فيه .[16] يعمل مضاد الثرومبين المفعَل بواسطة الهيبارين إلى وقف نشاط الثرومبين بالإضافة إلى ببتيداز آخرين (proteases) المشاركة في عملية تخثر الدم، والأكثر ملاحظة منها هو العامل الخامس النشط (factor Xa) .مثبط انزيم البروتياز (proteases) بواسطة مضاد الثرومبين يزيد بمقدار الف مرة بسبب ارتباطه بالهيبارين .[17]
يرتبط مضاد الثرومبين بتسلسل محدد من السكر الخماسي المكبرت الموجود في مبلمر الهيبارين :
GlcNAc/NS(6S)-GlcA-GlcNS(3S,6S)-IdoA(2S)-GlcNS(6S)
التغيّر الناتج في بناء مضاد الثرومبين بسبب ارتباطه بالهيبارين يحفّز تثبيطه للعامل( Xa ) . لكي يتم تثبيط عمل الثرومبين، لا بدّ وأن يرتبط ايضاً بمبلمر الهيبارين في موقع قريب من السكر الخماسي. تساهم الكثافة الشحنيّة السالبة العالية للهيبارين في الرابطة الكهربيّة القوية مع الثرومبين[7] .كما يؤدي تكوين المعقّد الثلاثي بين مضاد الثرومبين ، و الثرومبين ، و الهيبارين، إلى تنشيط الثرومبين، لهذا السبب نشاط الهيبارين يعتمد على الحجم . و لتكوين فعّال للمعقد الثلاثي نحتاج إلى 18 وحدة سكريّة .[18] في المقابل مضاد العامل (Xa) يحتاج فقط إلى موقع الارتباط من السكر الخماسي.
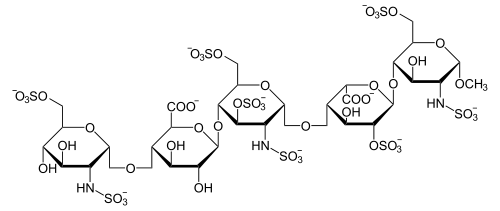
هذا الاختلاف في الحجم أدّى إلى ظهور الانواع المختلفة من الهيبارين ذو الكتلة المولية المنخفضة ومؤخرا ظهور (fondaparinux) ، كمضادات تخثّر صيدلانية . و تعمل مضادات التخثر هذه (أنواع الهيبارين ذو الكتل المولية المنخفضة بالإضافة إلى (fondaparinux) ) باستهداف نشاط مضاد العامل (Xa) بدلاً من مضاد الثرومبين ، بهدف تيسير تنظيم للتخثر أكثر اتقانا وتحسين المنسب العلاجي . كما تم ملاحظة انخفاض خطر الإصابة بتخلخل العظام وقلة الصفيحات–المحفّز بالهيبارين- باستخدامها . بالإضافة إلى أن مراقبة زمن الثرومبوبلاستين الجزئي المفعّل غير ضروري ولا يعكس التأثير المضاد للتخثر لأنه لا يتأثر بالتغيرات في العامل (Xa) . Fondaparinux هو سكر خماسي مصنّع، يمتلك بناء كيميائي مشابه لتسلسل السكر الخماسي الذي يرتبط به مضاد الثرومبين ، و الذي يوجد في مبلمر الهيبارين وكبريت الهيباران. الصورة في الاسفل توضح التركيب الكيميائي ل fondaparinux:
1-التركيب البنائي للفوندابارينوكس
دانابارويد (danaparoid) و هو خليط من سلفات الهيباران، سلفات الديرماتان، وسلفات الكوندروتين، يمكن استخدامه كمضاد للتخثر في المرضى الذين يصابون بقلة الصفيحات –المحفّز بالهيبارين- . لأنه لا يحتوي على الهيبارين أو أجزاء الهيبارين، ولوحظ أن التفاعلية المتصالبة للدانابرويد مع الأجسام المضادة المحفزة بالهيبارين اقل من 10% .[19] تأثير الهيبارين غالبا ما يُقاس في المختبر عن طريق قياس زمن الثرومبوبلاستين الجزئي وهو إحدى طرق قياس الزمن اللازم لتحول الدم إلى خثرة . لا يجدر بنا الخلط بين زمن الثرومبوبلاستين الجزئي، وزمن البروثرومبين الذي يقيس زمن تخثر الدم بطرق أخرى مختلفة لتجلط الدم . الهيبارين يحفّز مضاد الثرومبين 3 (antithrompin 3 ) ، و يعادل سيرين بروتياز النشط (activated serien protease coagulation factors ) . ["[20]
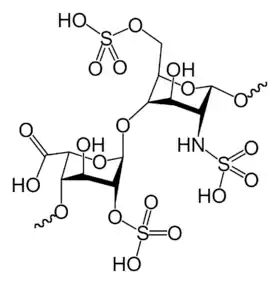
تركيب الهيبارين
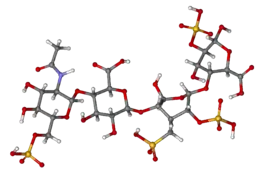
الهيبارين الأصلي، هو مبلمر كتلته المولية تتراوح بين 3-30 كيلودالتون، بالرغم أن معظم الهيبارين التجاري ذو كتلة مولية تتراوح بين 12-15 كيلودالتون .[21] و ينتمي إلى إحدى عائلات الكاربوهايدرات وهي جلوكوزامينوجايكان (glucosaminoglycan) (و الذي تحتوي جزيء مرتبط بالهيبارين وهو هيباران سلفات (( heparin sulphate ) ، و يحتوي على وحدات مختلفة مكررة من السكريات الثنائية المكبرتة .[22] وحدات الهيبارين الأساسية الموضحة في الأسفل و من أهم وحدات السكر الثنائي المكونة للهيبارين تتكون من ( 2-O-sulfated iduronic|Iduronic acid|iduronic acid)( 6-O-sulfated, N-sulfated glucosamine). على سبيل المثال، هذا يكوّن 85% من الهيبارين من رئة البقر و 75% من اغشية أمعاء الخنازير .[23] السكريات الثنائية النادرة غير موضّحة في الأسفل التي تتكون من (3-O-sulfated glucoseamine (GLcNS(3S,6S)) أو مجموعة الأمين الحرّة (GLcNH+) . تحت الظروف الفسيولوجية يزال بروتون من كل من المجموعات الكيميائية :الاستر وكبريتات الاميد، فتجذب الايونات الموجبة الأيونات التي تخالفها بالشحنة، مما يؤدي إلى تكوين أملاح الهيبارين .و عادةً ما يتم إعطاء الهيبارين على شكل أملاح . وحدة واحدة من الهيبارين (the Howell unit ) هي كمية تقريبا تكافيء .002مغ من الهيبارين النقي، وهذه هي الكمية اللازمة لابقاء 1 مل من دم قطة سائل (غير متخثر ) لمدة 24 ساعة على درجة حرارة صفر سيليسيوس .[24]
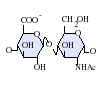 GlcA-GlcNAc
GlcA-GlcNAc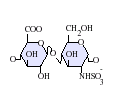 GlcA-GlcNS
GlcA-GlcNS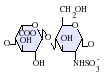 IdoA-GlcNS
IdoA-GlcNS-GlcNS.png.webp) IdoA(2S)-GlcNS
IdoA(2S)-GlcNS.png.webp) IdoA-GlcNS(6S)
IdoA-GlcNS(6S)-GlcNS(6S).png.webp) IdoA(2S)-GlcNS(6S)
IdoA(2S)-GlcNS(6S)
اختصارات
- GlcA = β-D-glucuronic acid
- IdoA = α-L-[[[:en:Iduronic acid|iduronic|Iduronic acid|iduronic]]|iduronic|Iduronic acid|iduronic acid]]
- IdoA(2S) = 2-O-sulfo-α-L-iduronic|Iduronic acid|iduronic acid
- GlcNAc = 2-deoxy-2-acetamido-α-D-glucopyranosyl
- GlcNS = 2-deoxy-2-sulfamido-α-D-glucopyranosyl
- GlcNS(6S) = 2-deoxy-2-sulfamido-α-D-glucopyranosyl-6-O-sulfate
التركيب البنائي ثلاثي الابعاد
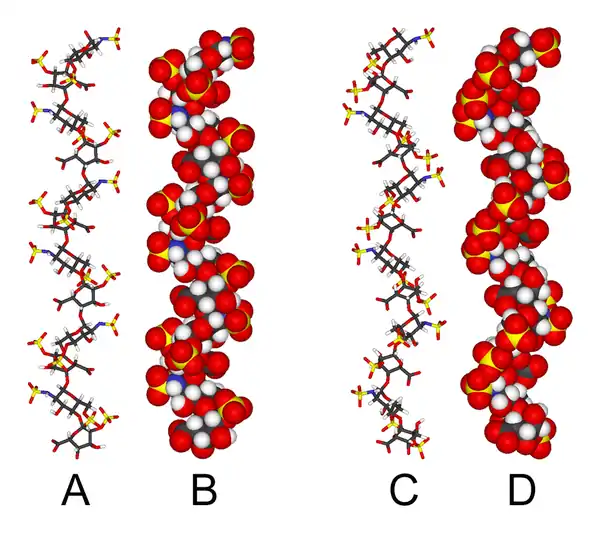
يعتبر البناء ثلاثي الابعاد للهيبارين بناءا معقدا، لان حمض الايدورونك عندما يكون موضوعا داخل جزيء قليل السكريات، يمكن أن يوجد بأحد الشكلين منخفضيّ الطاقة. و انتقاله بين الشكلين (في عملية الاتزان) تتأثر بحالة الكبرتة في سكريات الجلوكوزأمين المجاورة .[25] و مع ذلك، محلول الهيبارين ذو سكريات الإثني عشر (dodecasaccharide) ، تتألف فقط من ستة GlcNS(6S)-IdoA(2S)-idoA(2S) وحدات متكررة، تم تحديدها باستخدام كل من طيف الرنين المغناطيسي النووي (NMR) و تقنيات النمذجة الجزيئية .[26] تم وضع نموذجين، احدهما فيه كل IdoA(2S) على شكل2S0(كما في a و b في الأسفل)، و الآخر بحيث يكونوا بشكل 1C4(كما في c و d في الأسفل)، على الرغم من ذلك لا يوجد دليل يرجح أن التغيرات بين هذه الاشكال تحدث بطريقة متضافرة . هذه النماذج تطابق بنك معلومات البروتين 1HPN
A= كل IdoA(2S) بشكل 2S0
B= نفس أ لكن يملؤ فراغاته قوى لندن نصف قطر فان دير فالس
C= كل IdoA بشكل 1C4
D= نفس ج ويملؤ الفراغات فيه قوى لندن نصف قطر فان دير فالس
في هذه النماذج، يتبنى الهيبارين الشكل الحلزوني، دورانه يجعل أماكن تجمع مجموعات الكبريت على مسافات منتظمة تبعد 17 انغستروم عن بعضها على كل طرف من المحاور الحلزونية
طريقة الإعطاء
يعطى الهيبارين على شكل حُقَن، لأنه لا يتم امتصاصه من الجهاز الهضمي، بسبب شحنته السالبة العالية وحجمه الكبير. و يمكن أن يُعطى على شكل حُقن وريدية أو تحت الجلد، لكن لا يتم اعطاْءه كحُقَن عضليّة لما يمكن أن يُسببه من ورم دمويّ (hematoma ) . كما يجب أن يُعطى الهيبارين بشكل متكرر أو بحُقَن ذات تسريب مستمر بسبب عمر النصف الحيوي القصير وهو عبارة عن ساعة واحدة، بينما يمتلك الهيبارين غير المجّزأ عمر نصف يتراوح من ساعة إلى ساعتين [27]، و الهيبارين ذو الكتلة المولية المنخفضة يمتلك عمر نصف يتراوح بين أربع إلى خمس ساعات .[28] و هذا النوع من الهيبارين ( ذو الكتلة المولية المنخفضة ) يُعطى مرة واحدة في اليوم دون الحاجة إلى إعطائه عن طريقه حُقن التسريب المستمر . إذا كنا بحاجة لمفعول مضاد للتخثر طويل الأمد، يستخدم الهيبارين فقط في بداية العلاج كمضاد تخثر إلى أن تعطي مضادات التخثر التي تؤخذ عن طريق الفم مفعولها، -مثل الوارفارين- . تفاصيل طريقة الإعطاء متاحة في قواعد الممارسة السريرية التي وضعتها الكلية الأمريكية لاطباء الصدر:[29]
تحديد جرعات الهيبارين الغير مرتبطة بالوزن
تحديد جرعات الهيبارين المرتبطة بالوزن
التصنيع
يُستمد الهيبارين ذو الدرجة الصيدلانية من الأنسجة المخاطية من لحوم الحيوانات المذبوحة مثل : أمعاء الخنزير أو رئة البقر (المواشي) .[30] و لقد تم في عام 2003 و 2008 تقدم لإنتاج الهيبارين المصنّع .[31] وفي عام 2011 ذُكرت عملية كيميائية-إنزيمية لتصنيع الهيبارين ذي الكتلة المولية المنخفضة، من ثنائيات السكريات البسيطة.[32]
التاريخ
يُعتبر الهيبارين من اقدم الأدوية المستخدمة سريريا على نطاق واسع حاليا . سبق اكتشاف الهيبارين إنشاء منظمة الغذاء والدواء للولايات المتحدة، فقد تم اكتشافه عام 1916 ، و على الرغم من ذلك لم يتم ادخاله التجارب السريرية حتى العام 1935 .[33] و قد تم من الأصل عزله من خلايا كبد نابيّة، لذلك سمي هيبارين اقتباسا من الكلمة اليونانية (hepar) بمعنى الكبد. و يُنسب اكتشاف الهيبارين إلى النشاط البحثي لكلَ من جي مكلين وويليام هينري هويل (Jay McLean and William Henry Howell) في عام 1916.[34]
في عام 1916 كان هناك طالب في السنة الثانية من الطب في جامعة جون هوبكينس، كان يعمل تحت توجيهات تحضيرات التَحقق من طليعة التخثر الخاصة ب Howell ، عندما توصل إلى عزل فوسفاتيد مضاد لتتخثّر ذائب بالدهن، من خلايا الكبد النابيّة .[35] و في عام 1918 سمى Howell هذا النوع من مضادات التخثر الذائبة في الدهن (هيبارين ) ، ثم في بداية العشرينات من القرن العشرين توصل Howell إلى عزل مضاد للتخثّر متعدد السكريات ذائب في الماء والذي سميّ أيضا (هيبارين ) ، على الرغم من تمييزه عن تحضيرات الفوسفاتيد المعزولة مسبقا . لربما كان لعَمَل McLean كجراح الأثر في تغيير وجهة تركيز مجموعة HoWell للبحث عن مضادات التخثر ، و ذلك أدى إلى اكتشاف عديد السكريات . في بداية الثلاثينيات من القرن العشرين، العديد من الباحثين اللذين عملوا على الهيبارين . في عام 1935 نشر اريك جوربس (ْErik Jorpes ) فيkarolinskaInstitutet، بحثه حول تركيب الهيبارين،[36] مما مكّن الشركة السويدية vitrum ABمن اطلاق المُنتَج الأول من الهيبارين للحَقن الوريدي في عام 1936 . بين العامين 1933و 1936 إحدى مختبرات البحث الطبية في جامعة تورنوتو يدعى (Connaught) طوّر طريقة لإنتاج هيبارين آمن وغير سام ليتم اعطاءه للمريض في محلول ملحيّ . أول تجربة لهذا الهيبارين على الإنسان ابتدأت في ايار من العام 1935 ، وبحلول عام 1937 ، كان واضحا أن الهيبارين الذي ابتكره Connaught كان آمنا، متاحا ويمكن توفيره بسهولة، بالإضافة الا أنه كان فعّالا كمضاد للتخثر . و الجدير بالذكر أن الهيبارين قبيل العام 1933 كان متواجد بكميات قليلة، وكان سامّاً وغالي الثمن، نتيجة لذلك كان بلا قيمة طبيّة آنذاك .[37] و قد فشلت محاولة ترشيح McLean إلى جائزة نوبل بعد وفاته .
فرص تطور ادوية Novel
كما هو موضح في الجدول أدناه، الإمكانية الكبيرة للمركبات الشبيهة ببنية الهيبارين الكيميائية لاستخدامها في علاج الكثير من الامراض، بالإضافة إلى استخدامهم الحالي كمضادات تخثر .[38][39]
| المرض المستجيب للهيبارين | تأثير الهيبارين على نماذج التجارب | الحالة السريرية |
|---|---|---|
| متلازمة نقص المناعة المكتسبة | يقلل قابيلة الفايروسات النوع 1 و 2 التي - تسبب نقص المناعة عند الانسان- من الامتزاز إلى خلايا الT4 المزروعة .[40] | - |
| متلازمة الضائقة التنفسية في البالغين | يقلل تنشيط وتجمع الخلايا في مجاري الهواء، يعادل مخرجات الخلايا السامة ويحسن عمل الرئة في نماذج الحيوانات | تجارب سريرية مسيطر عليها |
| التهاب الدماغ التحسسي | فعال في نماذج الحيوانات | - |
| التهاب الانف التحسسي | المفعول كما في متلازمة الضائقة التنفسية في البالغين | تجارب سريرية مسيطر عليها |
| التهاب المفاصل | يمنع تجمع الخلايا، وتحطم الكولاجين وتولد الاوعية . | تقارير سردية |
| الربو | كما في متلازمة الضائقة التنفسية في البالغين، ويعمل على تحسين عمل الرئة في نماذج التجربة | تجارب سريرية مسيطر عليها |
| السرطان | يمنع نمو الورم، ويمنع انتقاله وتولد الاوعية، مما يزيد وقت بقاء نماذج الحيوانات حية | العديد من التقارير السردية للحالات الفردية |
| فرط التحسس الآجل | فعال في نماذج الحيوانات | - |
| داء الامعاء الالتهابي | يمنع انتقال الخلايا الالتهابية. لا يوجد نماذج محددة | تجارب سريرية مسيطر عليها |
| التهاب عنق المثانة | فعال في النماذج البشرية المصابة بالتهاب عنق المثانة | تستخدم سريريا، حاليا. |
| رفض الجسم لزراعة عضو | بقاء العضو المزروع مدة طويلة في نماذج الحيوانات | - |
(-) تعني لا يوجد معلومة متاحة
كنتيجة لفاعلية الهيبارين في امراض متعددة، عدد من الادوية قيد التطور تمتلك بناء جزيئي مشابه أو مطابق للبناء الموجود في مبلمر الهيبارين .[38]
| جزيء الدواء | مفعول الدواء الجديد مقارنة بالهيبارين | النشاط البيولوجي |
|---|---|---|
| هيبارين رباعي السكريات (heparin tetrasaccharide) | غير مضاد للتخثر، غيرمستمنع، فعال عن طريق الفم | مضاد للتحسس |
| بينتوز بولي سلفات (pentose polysulphate ) | مستمد من النبات، نشاطه كمضاد تخثر ضعيف، مضاد التهاب، فعال عن طريق الفم . | مضاد للالتهاب، مضاد تلاصق، مضاد نقيلي، |
| فوسفومانوبينتوز سلفات (phosphomannopentosesulphate) | مثبط فعال للهيبارانيز (heparanase) | مضاد نقيلي، مانع للتولد الاوعية، مضاد التهاب |
| ديسالفيتيد هيبارين مختار كيميائيا( selectievely chemically O-desulphated heparin) | لا يمتلك نشاط مضاد للتخثر | مضاد التهاب، مضاد حساسية، مضاد التصاق |
التحلل والتخلص الطبيعي
يمتلك الهيبارين غير المجزء عمر نصف حوالي ساعة لساعتين من اعطاءه بحقنة تسريب ,[27]، بينما يمتلك الهيبارين ذو الكتلة المولية المنخفضة عمر نصف أطول بأربع مرات . و الجدير بالذكر أن جرعات الهيبارين المنخفضة تمتلك عمر نصف أقصر بكثير من الجرعات المرتفعة .
تُزيل الخلايا البلعمية بلمرة الهيبارين الهيبارين المرتبط بها، بالإضافة إلى أن الهيبارين سريع الارتباط بالخلايا البطانية، التي تمنع الارتباط بمضاد الثرومبين الذي يؤدي إلى عملية منع التخثر . و عندما تزيد جرعة الهيبارين تصل الخلايا البطانية إلى حد الإشباع، مما يؤدي إلى ابطاء عملية التخلص من الهيبارين بواسطة الكلية عن طريق الدم . .[41]
تقنيات ازالة البلمرة
تنقسم طرق إزالة البلمرة إلى قسمين، إما انزيمية أو كيميائية أو خليط منهما، تكمن وراءها الغالبية العظمى من التحليلات التي تم تنفيذها على بُنية ووظيفة كل من الهيبارين والهيباران سلفات (heparansulphate) . HS
الانزيمية
تكون الانزيمات التي تستخدم عادةً لهضم الهيبارين أو الهيباران سلفات، تنتج بشكل طبيعي من بكتيريا التربة Pedopacterheparinusو سميت سابقا (flavobacteriumheparinum) .[42] تمتلك هذه البكتيريا قابلية استخدام هيبارين أو هيباران سلفات كمصدر وحيد للكربون والنيتروجين. و حتى تتمكن من ذلك تعمل على إنتاج عدد من الانزيمات مثل انزيمات التحليل(layese) ، جلوكورونيداز (glucuronidase) ، و سالفواستيريز (sulfoesterase) و سالفاميديز (sulphamidase). .[43] تستخدم انزيمات التحليل (layeses) ، لدراسة الهيبارين والهيباران سلفات . و تنتج هذه البكتيريا ثلاثة أنواع منها، الهيبارينيز 1 و 2 و 3 (heparinases 1,2,3) ، لكلّ منهم ركيزة (( substrateمعينة كما هو موضح [44][45]
| انزيمات الهيبارينيز (heparinase) | الركيزة المخصصة |
|---|---|
| هيبارينيز 1 | GLcNS(±6S)-IdoA(2S) |
| هيبارينيز 2 | GLcNS/Ac(±6S)-IdoA(±2S)
GLcNS/Ac(±6S)-GlcA |
| هيبارينيز 3 | GlcNS/Ac(±6S)-GlcA/IdoA (مع تفضيل GlcA) |
-GlcNS(6S).svg.png.webp)
هذه الانزيمات layses تقسم الهيبارين والهيباران سلفات بطريقة ازالة البيتا (beta elimination mechanism). هذه الطريقة تؤدي إلى تكوين روابط ثنائية بين الكربونة رقم 4 و الكربونة رقم 5 من متبقي اليورونات (urinate residue).[46][47] هذه الرابطة الثنائية في اليورونات تسمى UAΔ أو UA ، و هي رابطة-حاملة للون- حساسة للاشعة الفوق بنفسجية ( قيمة الامتصاص العظمى على 232 نانوميتر ) ، و تسمح لانزيمات الهضم كي تتبع بعملها، كما انها توفر طريقة مناسبة للتحري عن الأجزاء الناتجة عن عملية الهضم التي تقوم بها الانزيمات .
الكيميائة
يمكن استخدام حمض النيتروز (nitrous acid) كمزيل كيميائي لبلمرة كل من الهيبارين والهيباران سلفات . و يمكن استخدامه على (درجة حموضة) PH= 1.5 أو على PH(درجة حوضة) = 4 ، تحت كلا الظرفين الكيميائيين، يؤثر حمض النيتروز على نزع الأمين من السلسلة .[48] على الPH (4) 'العالي' و ال PH (1.5) 'المنخفض' يمكن لإزالة الامين أن تحدث بين GlcNS-GlcA و GLcNS-IdoA ،وإنْ يكن بمعدل أبطأ على الPH العالي . التفاعل المزيل للأمين وانشقاق السلسلة تحدث بغض النظر عن الكبرتة المؤكسدة (O-sulfation) التي تُنقل بواسطة السكريات الوحيدة .على الPH المنخفض، تؤدي ازالة الامين إلى اطلاق ال SO4 غير العضوي، وتحويل ال GlcNNs إلى المانوز منزوع الماء ((aMan . علاج حمض النيتروز ذو PH المنخفض يُعد طريقة ممتازة لتفريق متعدد السكريات المكبرتة (N-sulfated) مثل الهيبارين والهيباران سلفات، عن متعدد السكريات الغير مكبرت (non N-sulfated) مثل الكوندرويتن المكبرت (chondroitin sulfate) و الديرماتان المكبرت (dermatan sulfate ) ، و الديرماتان المكبرت والكونرتوين المكبرت لا يتأثران بالانشقاق الذي يفعله حمض النيتروز .
الحفظ التطوري
بالإضافة إلى الابقار والخنازير التي يتم استخلاص الهيبارين ذو الدرجة الصيدلانية منها عادةً، هنالك مصادر اضافية من الممكن استخلاصه منها :
- الديك الرومي [49]
- الحوت [50]
- الجمل العربي [51]
- الفئران[52]
- الإنسان [53]
- سرطان البحر [54]
- بلح البحر [55]
- البطلينوس سمك صدفي[56]
- جمبري [57]
- السلطعون (mangrove crab) [58]
- (sand dollar) [58]
الوظيفة الحيوية للهيبارين في الكائنات من 6-11 غير واضحة، وأيضا تدعم النظرية التي تقول أن الوظيفة الأساسية للهيبارين ليست منع للتخثر .هذه الانواع من الكائنات لا تمتلك نظام تخثر مشابه لأي من الانواع من 1-5 . كما أن القائمة في الأعلى تشرح كيف أن الهيبارين محفوظ عبر تطور الكائنات الحية بجزيئات متشابهة البنية تم إنتاجها من قبل مجموعة واسعة من الكائنات الحية، التي تنتمي إلى شُعب مختلفة .
معلومات واستخدامات أخرى
يمكن استخدام الهيبارين كهلام لعلاج الاصابات الرياضية . اذ يتربط الهيستامين ثنائي البروتونات على وجه التحديد بالهيبارين .[59] فاطلاق الهيستامين من الخلايا البدينة (mast cell) في موقع النسيج المتضرر يساهم في الاستجابة الالتهابية. المنطق الذي يكمن خلف استخدام الهلام على الجلد يمكن ان يكون لتثبيط نشاط الهيستامين المُطلق، مما يساعد في تقليل الالتهاب .
يمتلك الهيبارين الإمكانية للبدء بعملية تولد الاوعية (angiogenesis)عندما يتكون ملح النحاس الخاص به .[60][61] بينما الجزيئات الخالية من النحاس لا يمكنها البدء بعملية توليد الاوعية ، بالمقابل يمكن للهيبارين ان يمنع هذه العملية إذا تم اعطاؤه مع وجود الستيرويد[62] ،و هذا التأثير للهيبارين المانع لتولد الاوعية غير مقترن بنشاطه كمضاد للتخثر .[63]
انابيب الاختبار ، و الانابيب الشعرية ،التي تستخدم املاح الليثيوم للهيبارين كمضاد للتخثر ، يتم وضع ملصقات خضراء وقمم خضراء للتمييزها . يمتلك الهيبارين صفة مفضلة على ثنائي أمين الايثيلين رباعي حمض الخل (EDTA) بعدم تأثيره على مستوى معظم الأيونات . و مع ذلك يمكن لمستوى الكالسيوم ان يقل في الدم إذا كان مستوى الهيبارين في العينة الدموية عالي جدا .[64] كما يمكن للهيبارين أن يتعارض مع بعض المقاييس المناعية. و مع ان ليثيوم الهيبارين عادة ما يستخدم ، لكن لا يمكن تحديد مستوى الليثيوم في دم المريض من انبوبات الاختبار هذه ، لهذا الغرض تستخدم الانبوبات ذات القمم الزرقاء التي تحتوي صوديوم الهيبارين .
مكساج الدم المغلف بالهيبارين متوفر للاستخدام في آلات القلب- الرئة . نسبة إلى الاشياء الأخرى يعتقد ان هذا المكساج المتخصص يحسن التوافق الحيوي واستتباب المضيف ، عن طريق توفير خصائص مشابهة للبطانة الاصلية .
يمكن للهيبارين أن يحتل مواقع ارتباط الDNA على انزيم البلمرة الخاص بالRNA ، فيمنع انزيم البلمرة من الارتباط بمعزاز الDNA (DNApromoter). هذه الخاصية مستثمرة في عدد واسع من الفحوصات الجزيئية الحيوية .
العلمليات التشخيصية المعروفة تحتاج تفاعل البوليماريز المتسلسل(PCR) لDNA المريض، والذي يمكن استخراجه بسهولة من خلايا الدم البيضاء المعالجة بالهيبارين . و هذا يشكل مشكلة محتملة ، لان الهيبارين يمكن ان يستخرج جنبا إلى جنب مع ال DNA ، كما وجد انه يتعارض مع تفاعل الوليماريز المتسلسل (PCR) على تراكيز منخفضة 0002. وحدة في 50 مايكرولتر من مزيج التفاعل.[65]
يمكن ان يستخدم الهيبارين المثبت كلَجين أُلفة (affinity ligand ) في تنقية البروتين . و قد تختلف كثيرا بنية الهيبارين المثَبت ، من تغطية الاسطح البلاستيكية لأغراض تشخيصية إلى راتينات لونية (chromatography resin) معظم الانواع من الهيبارين المثبت يمكن استخدامها بثلاثة طرق ، الطريقة الأولى هي باستخدام الهيبارين لاختيار عوامل تخثر محددة ، أو أنواع أخرى من البروتينات المرتبطة بالهيبارين ، من مزيج معقد من البروتينات غير المرتبطة بالهيبارين . و بعد ذلك يتم نزع بروتينات محددة انتقائياً من الهيبارين ، عن طريق استخدام املاح بتراكيز مختلفة أو استخدام الميل الملحي. الاستخدام الثاني وهو استخدام الهيبارين ككتايونات مبادلة ذات سعة عالية، وهذا الاستخدام يستعمل ميزة الهيبارين بامتلاكه عدد كبير من مجموعات السلفات الانيونية (anionic sulphate) ، كما ان هذه المجموعات ستلتقط الجزيئات والبروتينات موجبة الشحنة الكُليّة ، بمعنى ، انها لا تلعب أي دور في التخثر ولا ترتبط بالنيوكليوتيدات . اما الاستخدام الثالث للهيبارين المثَبّت فهو ،تنقية مجموعة محددة من البروتينات المرتبطة بال RNA و DNA مثل عوامل النسخ أو /و البروتينات المغلفة بالفيروسات . هذه الطريقة استفادت من ميزة التطابق الهيبارين البنائي لكل من DNA و RNA ، بما انه سالب الشحنة وعبارة عن جزيء ضخم محتوي على السكريات .
لا يعمل الهيبارين على فصل الفبرين (fibrin) ، انما يمنع فقط مكوّن الفبرين (fibrinogen) إلى التحول إلى فبرين((fibrin .
استدعاءات شوائب وملوثات الهيبارين
آخذين بعين الاعتبار المصدر الحيواني للهيبارين ، عدد الشوائب المحتملة كبير مقارنةً بالادوية العلاجية المصنعة كليا . فالنطاق المحتمل للشوائب البيولوجية متضمنة الفيروسات ، و الذيفان الداخلي للبكتيريا (bacterial endotoxin) ، و مسببات الاعتلال الدماغي الاسفنجي (TSE) ، دهن ، بروتينات ، DNA . خلال تحضير الهيبارين ذو الدرجة الصيدلانية من انسجة الحيوانات ، يمكن للمذيبات، والعناصر الثقيلة ،و الكتيونات الغريبة ،ان تدخل . على الرغم من ان الطرق المستخدمة لتقليل حدوث هذه الشوائب وتحديدها و/أو التخلص منها ، هي طرق راسخة ومدرجة في الارشادات ودستور الادوية . يكمن التحدي الرئيسي في تحليل شوائب الهيبارين في تحديد والتعرف على البناء المشابه . من أكثر الشوائب السائدة للهيبارين هو ديتيرمان سلفات (daterman sulfate DS) و يعرف أيضا بالكوندرويتين سلفات B) Bchondritoin sulfate) . الوحدة البنائية للديتيرمان سلفات هي ثنائي السكريات محتوي على رابطة 1,3 تربط استيل جلاكتوزأمين (N-Acytelgalactoseamine) و متبقي حمض اليورنك (uronic acid risdue) ، مربوطين برابطة 1,4 لتكوين المبلمر . يحتمل تكون ديتيرمان السلفات من ثلاثة أنواع من حمض اليورنك (GLcA, IdoA (IdoA2 ، و اربع أنواع محتملة من الهيكسوزأمين ( GaLNAc,GaL-NAc6S, GalNAc4S6S) كوحدات بنائية . حمض الايدورونيك يميز ديتيرمان سلفات عن الكوندروتين سلفات من النوع Aو b و يجعله اشبه بالهيباران سلفات والهيبارين . يمتلك الديتيرمان سلفات كتلة شحنية سالبة اقل من الهيبارين . الشائبة الطبيعية الديتيرمان سلفات تتواجد بنسبة 1-7% في الهيبارين . لكنه لايملك نشاط بيولوجي مُثبَت الذي يؤثر على نشاط الهيبارين المانع للتخثر .[66] في شهر كانون الأول من العام 2007، قامت منظمة الغذاء والدواء في الولايات المتحدة من سحب شحنة هيبارين بسبب نمو بكتيري (serratiamarcescens)في العديد من الحقن الغير مفتوحة من الهيبارين S.marcescens يمكن ان تؤدي إلى اصابات مهددة للحياة أو الموت. في آذار 2008 ، تم سحب الهيبارين من قبل منظمة الغذاء والدواء بسبب شوائب في الهيبارين الخام المستورد من الصين .[67][68] بحسب ما اوردت منظمة الغذاء والدواء ، قتل الهيبارين المغشوش 81 شخص في الولايات المتحدة ، هذا الهيبارين المغشوش كان عبارة عن كوندرويتن سلفات يحتوي كبريت بصورة مفرطة "over-sulfated" ، و هو شائع ومستمد من حيوانات البحرية ويستخدم للاتهاب المفاصل ، و قد كان معدا لاستخدامه بدل الهيبارين الحقيقي باختبارات الفاعلية [69]
الوفيات
استدعاءات 2008 بسبب التلوث
في اذار 2008 ، تم سحب الهيبارين باعلان من شركات صيدلانية بسبب شوائب في الهيبارين الخام المستورد من الصين .[70][71] و بعد ذلك المادة الملوثة عُرفت بأنها كبريت مفرط في الكوندرويتن سلفات .[72] و قد نقلت منظمة الغذاء والدواء الخبر بقول أن هناك 19 شخص على الاقل قد توفوا بسبب المادة الخام الملوثة المستوردة من الصين ، و أيضا تم استقبال 785 تقرير لاصابات خطيرة مرتبطة باستخدام الدواء . و حسب ما ورد عن نيويورك تايمز : 'مشاكل في الهيبارين تم ذكرها إلى الوكالة تتضمن مشاكل في التنفس ، اعياء ، استفراغ ، تعرق زائد ، و هبوط سريع في ضغط الدم ، ادى في بعض الحالات إلى صدمات مهددة للحياة '.
استخدام في القتل
في عام 2006 ، بيتر زيلينكا (petrzelenka)، و هو ممرض في الجمهورية التشيكية ، اعطى متعمدا جرعات كبيرة للمرضى مما اودى بحياة 7 ، و حاول ان يقتل 10 آخرين .[73]
قضايا الجرعات المفرطة
في عام 2007، ممرضة في cedars-sinai medical center ،قامت باعطاء توأمين للممثل دينيس كويد (dennisquaid) ، البالغين من العمر 12يوم جرعة هيبارين الف مرة أكبر من الجرعة المحددة للرُضع ،[74] عن طريق الخطأ ، و زُعم أن السبب في هذه الجرعة المفرطة التي أودت بحياة التوأم إلى ان تصميم المنتجَين والملصقات على المنتج للكبار وللرضع متطابقة . مما جعل العائلة ترفع قضية على المُصَنّع (baxter healthcare crop) .[75][76] و تمت التسوية مع المستشفى مقابل تعويض بملبغ 750 الف دولار .[77] قبل حادثة عائلة كويد ،تم اعطاء ستة أطفال حديثي الولادة في انديانا (Indianapolis) جرعة مفرطة ثلاثة منهم توفوا بعد هذا الخطأ . و في شهر تموز من العام 2008 توأمين اخرين ولدوا في christusspohn hospital في تيكساس ، توفوا جراء جرعة زائدة من الدواء ، و قد تسبب خطأ في المزج داخل صيدلية المستشفى إلى هذه الجرعة المفرطة ولم يكن لها أي علاقة في التعبئة والملصقات. .[78] و قد كان السبب الحقيقي لموت التوأمين ما زال قيد التحيق في ذلك الشهر من ذاك العام.[79][80] في اذار من العام 2010 ، مريض بعمر السنتين من تكساس كان قد خضع للزراعة وتم اعطاؤه جرعة مميتة من الهيبارين في جامعة neraska medical center . لكن الظروف الحقيقية خلف وفاته لا زالت قيد التحقيق .[81]
علم السموم
مانع الاستعمال : خطر التعرض للنزيف ،«خاصة في المرضى ذوي ضغط الدم غير المسيطر عليه ، أو أمراض في الكبد ، أو سكتة دماغية .»، أمراض الكبد الحادة، وارتفاع ضغط الدم الحاد الآثار الجانبية : نزف، وقلة الصفيحات ، وزيادة مستوى البوتاسيوم بالإضافة إلى هشاشة العظام .
الكشف في سوائل الجسم
تعتمد تحاليل المختبرات الطبية حاليا، على القياس غير المباشر لتأثيرات الهيبارين ، عوضا عن القياس المباشر لوجوده الكيميائي، وهذا يتضمن زمن الثرومبوبلاستين الجزئي المفعل، ونشاط مضاد العامل Xa . والعينة المختارة غالبا ما تكون جديدة، بلازما غير متحلة من الدم الذي مُنع من التخثر عن طريق السايتريت ((citrateو فلورايد(fluride) و اوكزاليت (oxalate).[82][83]
العمر التخزيني
يقدر العمر التخزيني بين 18 شهر و 3 سنوات ، اعتمادا على المصنّع
اقرأ أيضًا
مراجع
- المخترع: معاهد الصحة الوطنية الأمريكية — https://drugs.ncats.io/drug/T2410KM04A — تاريخ الاطلاع: 2 نوفمبر 2018
- Heparin Sodium injection نسخة محفوظة 25 يناير 2017 على موقع واي باك مشين.
- heparin. In: Lexi-Drugs Online [database on the Internet]. Hudson (OH): Lexi-Comp, Inc.; 2007 [cited 2/10/12]. Available from: http://online.lexi.com. subscription required to view. نسخة محفوظة 2016-01-06 على موقع واي باك مشين.
- "Heparin Sodium"، The American Society of Health-System Pharmacists، مؤرشف من الأصل في 27 مارس 2019، اطلع عليه بتاريخ Jan 2016.
{{استشهاد ويب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - "Heparin Pregnancy and Breastfeeding Warnings"، drugs.com، مؤرشف من الأصل في 12 أكتوبر 2018، اطلع عليه بتاريخ 15 يناير 2016.
- Nader, H.B.؛ Chavante, S.F.؛ Dos-Santos, E.A.؛ Oliveira, F.W.؛ De-Paiva, J.F.؛ Jerônimo, S.M.B.؛ Medeiros, G.F.؛ De-Abreu, L.R.D.؛ وآخرون (1999)، "Heparan sulfates and heparins: similar compounds performing the same functions in vertebrates and invertebrates?"، Braz. J. Med. Biol. Res.، 32 (5): 529–538، doi:10.1590/S0100-879X1999000500005، PMID 10412563.
- Cox, M.؛ Nelson D. (2004)، Lehninger, Principles of Biochemistry، Freeman، ص. 254، ISBN 0-7167-4339-6، مؤرشف من الأصل في 17 ديسمبر 2019.
- Guyton, A. C.؛ Hall, J. E. (2006)، Textbook of Medical Physiology، Elsevier Saunders، ص. 464، ISBN 0-7216-0240-1، مؤرشف من الأصل في 31 يوليو 2020.
- Alcor Life Extension Foundation، Alcor Procedures، مؤرشف من الأصل في 21 نوفمبر 2019، اطلع عليه بتاريخ 11 يونيو 2015
- Cryonics Institute، Hospital Instructions For Cryonics Patients، مؤرشف من الأصل في 15 نوفمبر 2018، اطلع عليه بتاريخ 11 يونيو 2015
- Kusmer, Ken (20 سبتمبر 2006)، "3rd Ind. preemie infant dies of overdose"، Fox News (Associated Press)، مؤرشف من الأصل في 03 نوفمبر 2012، اطلع عليه بتاريخ 08 يناير 2007.
- Internal medicine, Jay H. Stein, page 635
- Agnelli G؛ Piovella F؛ Buoncristiani P؛ وآخرون (1998)، "Enoxaparin plus compression stockings compared with compression stockings alone in the prevention of venous thromboembolism after elective neurosurgery"، N Engl J Med، 339 (2): 80–5، doi:10.1056/NEJM199807093390204، PMID 9654538.
- Bergqvist D؛ Agnelli G؛ Cohen AT؛ وآخرون (2002)، "Duration of prophylaxis against venous thromboembolism with enoxaparin after surgery for cancer"، N Engl J Med، 346 (13): 975–980، doi:10.1056/NEJMoa012385، PMID 11919306، مؤرشف من الأصل في 5 يناير 2010.
- Handoll HHG, Farrar MJ, McBirnie J, Tytherleigh-Strong G, Milne AA, Gillespie WJ؛ Farrar؛ McBirnie؛ Tytherleigh-Strong؛ Milne؛ Gillespie (2002)، Handoll, Helen HG (المحرر)، "Heparin, low molecular weight heparin and physical methods for preventing deep vein thrombosis and pulmonary embolism following surgery for hip fractures"، Cochrane Database Syst Rev، 4 (4): CD000305، doi:10.1002/14651858.CD000305، PMID 12519540.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Chuang YJ؛ Swanson R.؛ وآخرون (2001)، "Heparin enhances the specificity of antithrombin for thrombin and factor Xa independent of the reactive center loop sequence. Evidence for an exosite determinant of factor Xa specificity in heparin-activated antithrombin"، J. Biol. Chem.، 276 (18): 14961–14971، doi:10.1074/jbc.M011550200، PMID 11278930.
- Bjork I, Lindahl U.؛ Lindahl (1982)، "Mechanism of the anticoagulant action of heparin"، Mol. Cell. Biochem.، 48 (3): 161–182، doi:10.1007/BF00421226، PMID 6757715، مؤرشف من الأصل في 11 أبريل 2020، اطلع عليه بتاريخ أغسطس 2020.
{{استشهاد بدورية محكمة}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة) - Herbert, Jean-Marc؛ Petitou, Maurice؛ Hérault, Jean-Pascal؛ Bernat, André؛ وآخرون (1999)، "Synthesis of Thrombin inhibiting Heparin mimetics without side effects"، Nature، 398 (6726): 417–422، doi:10.1038/18877، ISSN 0028-0836، PMID 10201371.
- Shalansky, Karen. DANAPAROID (Orgaran) for Heparin-Induced Thrombocytopenia. Vancouver Hospital & Health Sciences Centre, February 1998 Drug & Therapeutics Newsletter. Retrieved on 8 January 2007. نسخة محفوظة 22 يونيو 2017 على موقع واي باك مشين.
- Edward F. Goljan (2011)، Pathology، Mosby/Elsevier، ص. 251، ISBN 9780323084383، مؤرشف من الأصل في 20 مايو 2016، اطلع عليه بتاريخ 24 أغسطس 2014.
- Francis CW, Kaplan KL (2006)، "Chapter 21. Principles of Antithrombotic Therapy"، في Lichtman MA, Beutler E, Kipps TJ؛ وآخرون (المحررون)، Williams Hematology (ط. 7th)، ISBN 978-0-07-143591-8، مؤرشف من الأصل في 7 يوليو 2011، اطلع عليه بتاريخ أكتوبر 2020.
{{استشهاد بكتاب}}: تحقق من التاريخ في:|تاريخ الوصول=(مساعدة)صيانة CS1: أسماء متعددة: قائمة المحررون (link) - Bentolila, A.؛ وآخرون، "Synthesis and heparin-like biological activity of amino acid-based polymers"، Wiley InterScience، مؤرشف من الأصل في 11 أبريل 2020، اطلع عليه بتاريخ 10 مارس 2008.
- Gatti, G.؛ Casu, B.؛ Hamer, G. K.؛ Perlin, A. S. (1979)، "Studies on the Conformation of Heparin by1H and13C NMR Spectroscopy"، Macromolecules، 12 (5): 1001–1007، doi:10.1021/ma60071a044، ISSN 0024-9297.
- "Online Medical Dictionary"، Centre for Cancer Education، 2000، مؤرشف من الأصل في 13 أغسطس 2007، اطلع عليه بتاريخ 11 يوليو 2008.
- Ferro D, Provasoli A؛ وآخرون (1990)، "Conformer populations of L-iduronic acid residues in glycosaminoglycan sequences"، Carbohydr. Res.، 195 (2): 157–167، doi:10.1016/0008-6215(90)84164-P، PMID 2331699.
- Mulloy B, Forster MJ, Jones C, Davies DB.؛ Forster؛ Jones؛ Davies (01 يناير 1993)، "N.m.r. and molecular-modelling studies of the solution conformation of heparin"، Biochem. J.، 293 (Pt 3): 849–858، PMC 1134446، PMID 8352752.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Eikelboom JW, Hankey GJ؛ Hankey (2002)، "Low molecular weight heparins and heparinoids"، The Medical Journal of Australia، 177 (7): 379–383، PMID 12358583، مؤرشف من الأصل في 9 سبتمبر 2011.
- Weitz JI (2004)، "New anticoagulants for treatment of venous thromboembolism"، Circulation، 110 (9 Suppl 1): I19–26، doi:10.1161/01.CIR.0000140901.04538.ae، PMID 15339877، مؤرشف من الأصل في 29 يونيو 2018.
- Hirsh J, Raschke R؛ Raschke (2004)، "Heparin and low-molecular-weight heparin: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy"، Chest، 126 (3 Suppl): 188S–203S، doi:10.1378/chest.126.3_suppl.188S، PMID 15383472.
- Linhardt RJ, Gunay NS.؛ Gunay (1999)، "Production and Chemical Processing of Low Molecular Weight Heparins"، Sem. Thromb. Hem.، 3: 5–16، PMID 10549711.
- Bhattacharya, Ananyo (أغسطس 2008)، "Flask synthesis promises untainted heparin"، Chemistry World، Royal Society of Chemistry، مؤرشف من الأصل في 3 مارس 2016، اطلع عليه بتاريخ 06 فبراير 2011.
- Xu, Y.؛ Masuko, S.؛ Takieddin, M.؛ Xu, H.؛ Liu, R.؛ Jing, J.؛ Mousa, S. A.؛ Linhardt, R. J.؛ Liu, J. (2011)، "Chemoenzymatic Synthesis of Homogeneous Ultralow Molecular Weight Heparins"، Science، 334 (6055): 498–501، doi:10.1126/science.1207478، PMC 3425363، PMID 22034431.
- Linhardt RJ. (1991)، "Heparin: An important drug enters its seventh decade"، Chem. Indust.، 2: 45–50.
- "Heparin used as an anticoagulant"، AnimalResearch.info، مؤرشف من الأصل في 23 أكتوبر 2013.
- MCLEAN, J. (01 يناير 1959)، "The Discovery of Heparin"، Circulation، 19 (1): 75–78، doi:10.1161/01.CIR.19.1.75، PMID 13619023.
- Jorpes E (أغسطس 1935)، "The chemistry of heparin"، The Biochemical Journal، 29 (8): 1817–30، PMC 1266692، PMID 16745848.
- Rutty, CJ، "Miracle Blood Lubricant: Connaught and the Story of Heparin, 1928–1937"، Health Heritage Research Services، مؤرشف من الأصل في 23 أغسطس 2007، اطلع عليه بتاريخ 21 مايو 2007.
- Lever R. and Page C.P. (2002)، "Novel drug opportunities for heparin"، Nature Reviews Drug Discovery، 1 (2): 140–148، doi:10.1038/nrd724، PMID 12120095.
- Coombe D.R. and Kett W.C. (2005)، "Heparan sulfate-protein interactions: therapeutic potential through structure-function insights"، Cell. Mol. Life Sci.، 62 (4): 410–424، doi:10.1007/s00018-004-4293-7، PMID 15719168.
- Baba M, Pauwels R, Balzarini J, Arnout J, Desmyter J, De Clercq E؛ Pauwels؛ Balzarini؛ Arnout؛ Desmyter؛ De Clercq (1988)، "Mechanism of inhibitory effect of dextran sulfate and heparin on replication of human immunodeficiency virus in vitro"، PNAS، 85 (16): 6132–6، Bibcode:1988PNAS...85.6132B، doi:10.1073/pnas.85.16.6132، PMC 281919، PMID 2457906.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Weitz DS, Weitz JI؛ Weitz (2010)، "Update on heparin: what do we need to know?"، Journal of Thrombosis and Thrombolysis، 29 (2): 199–207، doi:10.1007/s11239-009-0411-6، PMID 19882363.
- Shaya D؛ Tocilj A.؛ وآخرون (2006)، "Crystal structure of heparinase II from Pedobacter heparinus and its complex with a disaccharide product"، J. Biol. Chem.، 281 (22): 15525–15535، doi:10.1074/jbc.M512055200، PMID 16565082.
- Galliher PM؛ Cooney CL.؛ وآخرون (1981)، "Heparinase production by Flavobacterium heparinum"، Appl. Environ. Microbiol.، 41 (2): 360–365، PMC 243699، PMID 7235692.
- Linhardt RJ؛ Turnbull JE.؛ وآخرون (1990)، "Examination of the substrate specificity of heparin and heparan sulfate lyases"، Biochemistry، 29 (10): 2611–2617، doi:10.1021/bi00462a026، PMID 2334685.
- Desai UR, Wang HM. and Linhardt RJ. (1993)، "Specificity studies on the heparin lyases from Flavobacterium heparinum"، Biochemistry، 32 (32): 8140–8145، doi:10.1021/bi00083a012، PMID 8347612.
- Linker A, Hovingh P.؛ Hovingh (1972)، "Isolation and characterization of oligosaccharides obtained from heparin by the action of heparinase"، Biochemistry، 11 (4): 563–568، doi:10.1021/bi00754a013، PMID 5062409.
- Linhardt RJ؛ Rice KG.؛ وآخرون (1988)، "Mapping and quantification of the major oligosaccharide components of heparin"، Biochem. J.، 254 (3): 781–787، PMC 1135151، PMID 3196292.
- Shively JE, Conrad HE.؛ Conrad (1976)، "Formation of anhydrosugars in the chemical depolymerization of heparin"، Biochemistry، 15 (18): 3932–3942، doi:10.1021/bi00663a005، PMID 9127.
- Warda M؛ Mao W.؛ وآخرون (2003)، "Turkey intestine as a commercial source of heparin? Comparative structural studies of intestinal avian and mammalian glycosaminoglycans"، Comp. Biochem. Physiol. B Biochem. Mol. Biol.، 134 (1): 189–197، doi:10.1016/S1096-4959(02)00250-6، PMID 12524047.
- Ototani N, Kikuchi M, Yosizawa Z.؛ Kikuchi؛ Yosizawa (1981)، "Comparative studies on the structures of highly active and relatively inactive forms of whale heparin"، J Biochem (Tokyo)، 90 (1): 241–246، PMID 7287679.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Warda M؛ Gouda EM.؛ وآخرون (2003)، "Isolation and characterization of raw heparin from dromedary intestine: evaluation of a new source of pharmaceutical heparin"، Comp. Biochem. Physiol. C Toxicol. Pharmacol.، 136 (4): 357–365، doi:10.1016/j.cca.2003.10.009، PMID 15012907.
- Bland CE؛ Ginsburg H.؛ وآخرون (1982)، "Mouse heparin proteoglycan. Synthesis by mast cell-fibroblast monolayers during lymphocyte-dependent mast cell proliferation"، J. Biol. Chem.، 257 (15): 8661–8666، PMID 6807978.
- Linhardt RJ؛ Ampofo SA.؛ وآخرون (1992)، "Isolation and characterization of human heparin"، Biochemistry، 31 (49): 12441–12445، doi:10.1021/bi00164a020، PMID 1463730.
- Hovingh P, Linker A.؛ Linker (1982)، "An unusual heparan sulfate isolated from lobsters (Homarus americanus)"، J. Biol. Chem.، 257 (16): 9840–9844، PMID 6213614.
- Hovingh P, Linker A.؛ Linker (1993)، "Glycosaminoglycans in Anodonta californiensis, a freshwater mussel"، Biol. Bull، 185 (2): 263–276، doi:10.2307/1542006، JSTOR 1542006، مؤرشف من الأصل في 16 يونيو 2011.
- Pejler G؛ Danielsson A.؛ وآخرون (1987)، "Structure and antithrombin-binding properties of heparin isolated from the clams Anomalocardia brasiliana and Tivela mactroides"، J. Biol. Chem.، 262 (24): 11413–11421، PMID 3624220.
- Dietrich CP؛ Paiva JF.؛ وآخرون (1999)، "Structural features and anticoagulant activities of a novel natural low-molecular-weight heparin from the shrimp Penaeus brasiliensis"، Biochim. Biophys. Acta.، 1428 (2–3): 273–283، doi:10.1016/S0304-4165(99)00087-2، PMID 10434045.
- Medeiros GF؛ Mendes؛ A.؛ وآخرون (2000)، "Distribution of sulfated glycosaminoglycans in the animal kingdom: widespread occurrence of heparin-like compounds in invertebrates"، Biochim. Biophys. Acta.، 1475 (3): 287–294، doi:10.1016/S0304-4165(00)00079-9، PMID 10913828.
- Chuang W, Christ MD, Peng J, Rabenstein DL.؛ Christ؛ Peng؛ Rabenstein (2000)، "An NMR and molecular modeling study of the site-specific binding of histamine by heparin, chemically modified heparin, and heparin-derived oligosacchrides"، Biochemistry.، 39 (13): 3542–3555، doi:10.1021/bi9926025، PMID 10736153.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Alessandri, G. Raju, K. and Gullino, PM. (1983)، "Mobilization of capillary endothelium in-vitro induced by effectors of angiogenesis in-vivo"، Cancer. Res.، 43 (4): 1790–1797، PMID 6187439.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Raju, K. Alessandri, G. Ziche, M. and Gullino, PM. (1982)، "Ceruloplasmin, copper ions, and angiogenesis"، J. Natl. Cancer. Inst.، 69 (5): 1183–1188، PMID 6182332.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Folkman J. (1985)، "Regulation of angiogenesis: a new function of heparin"، Biochem. Pharmacol.، 34 (7): 905–909، doi:10.1016/0006-2952(85)90588-X، PMID 2580535.
- Folkman J. and Ingber DE. (1987)، "Angiostatic steroids. Method of discovery and mechanism of action"، Ann. Surg.، 206 (3): 374–383، doi:10.1097/00000658-198709000-00016، PMC 1493178، PMID 2443088.
- Higgins, C. (أكتوبر 2007)، "The use of heparin in preparing samples for blood-gas analysis" (PDF)، Medical Laboratory Observer، مؤرشف من الأصل (PDF) في 24 مارس 2012.
- Yokota M, Tatsumi N, Nathalang O, Yamada T, Tsuda I.؛ Tatsumi؛ Nathalang؛ Yamada؛ Tsuda (1999)، "Effects of Heparin on Polymerase Chain Reaction for Blood White Cells"، J. Clin. Lab. Anal.، 13 (3): 133–140، doi:10.1002/(SICI)1098-2825(1999)13:3<133::AID-JCLA8>3.0.CO;2-0، PMID 10323479.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - Szabolcs Beni, John F. K. Limtiaco, Cynthia K. Larive؛ Limtiaco؛ Larive (سبتمبر 2011)، "Analysis and characterization of heparin impurities"، Analytical and Bioanalytical Chemistry، 399 (2): 527–539، doi:10.1007/s00216-010-4121-x، PMC 3015169، PMID 20814668.
{{استشهاد بدورية محكمة}}: صيانة CS1: أسماء متعددة: قائمة المؤلفون (link) - CBS News, Blood-thinning drug under suspicion نسخة محفوظة 17 مايو 2013 على موقع واي باك مشين. [وصلة مكسورة]
- FDA informational page with information and links about FDA investigation. نسخة محفوظة 25 أبريل 2018 على موقع واي باك مشين. [وصلة مكسورة]
- Zawisza, Julie (29 مارس 2008)، "FDA Media Briefing on Heparin" (PDF)، إدارة الغذاء والدواء (الولايات المتحدة)، مؤرشف من الأصل (PDF) في 8 مايو 2017، اطلع عليه بتاريخ 23 أبريل 2008.
- New York Times, March 6, 2008 Drug Tied to China Had Contaminant, F.D.A. Says, retrieved 2008-03-07
- New York Times, March 7, 2008 German Authorities Report Problems With Blood Thinner, retrieved 2008-03-07
- Blossom, DB؛ Kallen, AJ؛ Patel, PR؛ Elward, A؛ Robinson, L؛ Gao, G؛ Langer, R؛ Perkins, KM؛ وآخرون (2008)، "Outbreak of adverse reactions associated with contaminated heparin"، N Engl J Med.، 359 (25): 2674–84، doi:10.1056/NEJMoa0806450، PMID 19052120.
- Nurse committed murders to "test" doctors, Radio Praha, May 12, 2006 نسخة محفوظة 10 أبريل 2010 على موقع واي باك مشين.
- Ornstein, Charles; Gorman, Anna. (November 21, 2007) لوس أنجلوس تايمز Report: Dennis Quaid's twins get accidental overdose. تم أرشفته مارس 7, 2008 بواسطة آلة واي باك نسخة محفوظة 28 أغسطس 2008 على موقع واي باك مشين. [وصلة مكسورة]
- Dennis Quaid and wife sue drug maker, USA Today, December 4, 2007 نسخة محفوظة 28 يونيو 2010 على موقع واي باك مشين.
- Dennis Quaid files suit over drug mishap, Los Angeles Times, December 5, 2007 نسخة محفوظة 19 فبراير 2012 على موقع واي باك مشين.
- Quaid Awarded $750,000 Over Hospital Negligence, SFGate.com, December 16, 2008 نسخة محفوظة 15 أبريل 2009 على موقع واي باك مشين.
- WTHR story about Methodist Hospital overdose نسخة محفوظة 03 مارس 2016 على موقع واي باك مشين. [وصلة مكسورة]
- At a Glance Heparin Overdose at Hospital, Dallas Morning News, July 11. 2008 نسخة محفوظة 25 أكتوبر 2008 على موقع واي باك مشين. [وصلة مكسورة]
- "Officials Investigate Infants' Heparin OD at Texas Hospital." إيه بي سي نيوز. July 11, 2008. Retrieved on July 24, 2008. نسخة محفوظة 11 سبتمبر 2017 على موقع واي باك مشين.
- "Heparin Overdose Kills Toddler At Hospital, Staff Investigated." "KETV Omaha." March 31, 2010. نسخة محفوظة 20 سبتمبر 2018 على موقع واي باك مشين. [وصلة مكسورة]
- "A quick anti-Xa-activity-based whole blood coagulation assay for monitoring unfractionated heparin during cardiopulmonary bypass: a pilot investigation"، Anesth. Analg.، 91 (3): 533–8، 2000، doi:10.1213/00000539-200009000-00006، PMID 10960371، مؤرشف من الأصل في 26 يوليو 2022.
- R. Baselt, Disposition of Toxic Drugs and Chemicals in Man, 8th edition, Biomedical Publications, Foster City, CA, 2008, pp. 728-729.
ملاحظات