هيدريد البيريليوم
هيدريد البيريليوم مركب كيميائي له الصيغة BeH2، ويكون على شكل مسحوق أبيض اللون.
| هيدريد البيريليوم | |
|---|---|
 هيدريد البيريليوم | |
| الاسم النظامي (IUPAC) | |
Beryllium hydride | |
| أسماء أخرى | |
ثنائي هيدريد البيريليوم | |
| المعرفات | |
| رقم CAS | 7787-52-2 |
| بوب كيم (PubChem) | 139073 |
مواصفات الإدخال النصي المبسط للجزيئات
| |
| الخواص | |
| الصيغة الجزيئية | BeH2 |
| الكتلة المولية | 11.03 غ/مول |
| المظهر | مسحوق أبيض اللون |
| الكثافة | 0.65 غ/سم3 |
| نقطة الانصهار | 250 °س (يتفكك) |
| الذوبانية في الماء | يتفكك |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
التحضير
إن تحضير هيدريد البيريليوم من التفاعل المباشر للعناصر المكوّنة له، أي الهيدروجين والبيريليوم، عملية غير ممكنة. يحصل على المركب من تفاعل مركبات البيريليوم العضوية مع هيدريدات مثل هيدريد ألومنيوم الليثيوم،[3] أو ثنائي البوران. تجرى تفاعلات التحضير هذه في وسط من ثنائي إيثيل الإيثر.
كما يمكن تحضير هيدريد البيريليوم من التفكك الحراري لمركب مضاعف (ثالثي بوتيل) البيريليوم عند 210 °س.[3]
الخواص
إن هيدريد البيريليوم عبارة عن مادة صلبة بوليمرية بيضاء اللون غير متطايرة، تتفكك عند درجات حرارة أعلى من 250 °س إلى العناصر الأولية من الهيدروجين والبيريليوم.[4] يعد المركب حساساً تجاه الرطوبة والهواء الجوي، إذ يخضع لتفاعلات تفكك عندما يتعرض لتلك الشروط، كما أنه غير منحل في المذيبات العضوية. يتفكك في الماء ويعطي هيدروكسيد البيريليوم حسب التفاعل:
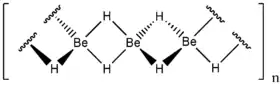
إن بنية هيدريد البيريليوم هي بنية بوليمرية، تتكون من وحدة بنائية رباعية السطوح، تكون فيها ذرة البيريليوم في المركز وتحاط بأربع ذرات من الهيدروجين. تكون الرابطة في هذا المركب تساهمية، وهي رابطة ثلاثية المركز ثنائية الإلكترون كما في هيدريد الألومنيوم.

الاستخدامات
يستخدم هيدريد البيريليوم في تركيب وقود الصواريخ وكمادة مهدئة للنيوترونات في المفاعلات النووية.[5] [6]
احتياطات الأمان
إن البيريليوم ومركباته الكيميائية هي مواد سامّة ومسرطنة، حيث يمكن أن تسبب مرض التسمم بالبيريليوم. لذا ينبغي أخذ الحيطة والحذر عند التعامل مع هذه المركبات.
المراجع
- وصلة : مُعرِّف "بَب كِيم" (PubChem CID) — الرخصة: محتوى حر
- وصلة : مُعرِّف "بَب كِيم" (PubChem CID)
- Brauer, Georg (1975)، Handbuch der Präparativen Anorganischen Chemie (ط. 3rd)، Stuttgart: Band I, Enke، ص. 890، ISBN 3-432-02328-6(بالألمانية)
- Bamford, C؛ Tipper, C (1980)، Reactions in the Solid State، Elsevier، ص. 155، ISBN 0444418075
- Walsh, Kenneth (2009)، Beryllium chemistry and Processing، ASM International، ص. 121
- Perry, Dale L.؛ Phillips, Sidney L. (1995)، Handbook of Inorganic Compounds، CRC Press، ص. 62، ISBN 978-0-8493-8671-8، مؤرشف من الأصل في 14 مارس 2020، اطلع عليه بتاريخ 10 ديسمبر 2007
- بوابة الكيمياء