1,2-heptanodiol
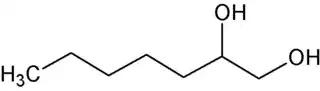
El 1,2-heptanodiol es un diol de fórmula molecular C7H16O2. Es isómero de posición del 1,7-heptanodiol pero, a diferencia de este, es un diol vecinal con dos grupos funcionales hidroxilo en las posiciones 1 y 2 de la cadena lineal de siete átomos de carbono. Es una molécula quiral dado que el átomo de carbono de la posición 2 es asimétrico.
| 1,2-heptanodiol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Heptano-1,2-diol | ||
| General | ||
| Otros nombres | 1,2-dihidroxiheptano | |
| Fórmula semidesarrollada | CH3-(CH2)4-CHOH-CH2OH | |
| Fórmula molecular | C7H16O2 | |
| Identificadores | ||
| Número CAS | 3710-31-4[1] | |
| ChemSpider | 69721 | |
| PubChem | 77302 | |
|
CCCCCC(CO)O
| ||
| Propiedades físicas | ||
| Apariencia | Sólido | |
| Densidad | 947 kg/m³; 0,947 g/cm³ | |
| Masa molar | 13 220 g/mol | |
| Punto de fusión | 42 °C (315 K) | |
| Punto de ebullición | 226 °C (499 K) | |
| Presión de vapor | 0,005 mmHg | |
| Índice de refracción (nD) | 1,445 | |
| Propiedades químicas | ||
| Solubilidad en agua | 9 g/L | |
| log P | 1,0 | |
| Familia | Alcohol | |
| Peligrosidad | ||
| Punto de inflamabilidad | 375 K (102 °C) | |
| Compuestos relacionados | ||
| alcoholes |
1-heptanol 2-heptanol | |
| dioles |
1,2-pentanodiol 1,2-hexanodiol 1,2-octanodiol | |
| polioles | 1,2,3-heptanotriol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
El 1,2-heptanodiol es un sólido que tiene su punto de fusión a 44 °C y su punto de ebullición a 226 °C (a una presión inferior de 11 mmHg es 130 °C). Posee una densidad ligeramente inferior a la del agua, 0,947 g/cm³. El valor estimado del logaritmo de su coeficiente de reparto, logP, está en el rango 0,8 - 1,3, lo cual indica una solubilidad considerablemente mayor en disolventes apolares que en agua. Es combustible, siendo su punto de inflamabilidad 101,7 °C.[2][3][4][5]
Síntesis y usos
El 1,2-heptanodiol se puede sintetizar a partir del 1-hepteno con un rendimiento próximo al 99%;[6] la hidroxilación se lleva a cabo mediante un catalizador de Os/Cu-Al tipo hidrotalcita, acompañado de óxido de N-metilmorfolina que actúa como co-oxidante.[7] Otra ruta de síntesis conlleva la hidroboración con diisopinocampheylborano de 2-benciloxi-heptan-1-ol,[8] siendo en este caso el rendimiento del 97%.[6] También la hidrólisis no catalizada del óxido de 1,2-heptileno a altas presiones (en torno a 10 kbar) permite obtener este diol.[9] Otra vía de síntesis alternativa parte del 2-hidroxiheptanotioato de S-metilo, el cual, al ser tratado con LiAlH4 en éter a reflujo durante 3 horas, permite conseguir 1,2-heptanodiol.[10]
Los 1,2-dioles tienen actividad antimicrobiana, habiéndose estudiado el 1,2-heptanodiol, combinado con el 1,4-ciclohexanodiol, en la adsorción percutánea del fármaco metronidazol, antibiótico y antiparasitario;[11] este diol retarda la adsorción de este fármaco, minimizando la toxicidad sistemática potencial mientras se mantiene la eficacia terapéutica.[12] Por otra parte, estudios sobre la enzima glicerol deshidrogenasa han constatado que dicha enzima cataliza la oxidación NAD+-dependiente de dioles de larga cadena, pero solo cuando los grupos hidroxilo están en carbonos adyacentes, como en el caso del 1,2-heptanodiol. [13]
Otros posibles usos del 1,2-heptanodiol es en composiciones de cosméticos, como humectante[14] o también como agente antibacteriano.[15]
Véase también
Los siguientes compuestos son isómeros del 1,2-heptanodiol:
Referencias
- Número CAS
- 1,2-Heptanediol (Chemical Book)
- 1,2-Heptanediol (ChemSpider)
- Heptane-1,2-diol (PubChem)
- 1,2-Heptanediol (Molbase)
- Synthesis Route for 3710-31-4 (Molbase)
- Friedrich, H.B.; Govender, M.; Makhoba, X.; Ngcobo, T.D.; Onani, M.O. (2003). «The Os/Cu–Al-hydrotalcite catalysed hydroxylation of alkenes». Chemical Communications 23: 2922-2923. Consultado el 29 de septiembre de 2018.
- Peterson, P.E.; Stepanian, M. (1988). «Hydroboration of vinyl ethers with diisopinocampheylborane». Journal of Organic Chemistry 53 (9): 1903-1907. Consultado el 29 de septiembre de 2018.
- Kotsuki, H.; Kataoka, M.; Nishizawa, H. (1993). «High pressure-promoted uncatalyzed hydrolysis of epoxides». Tetrahedron Letters 34 (25): 4031-4034. Consultado el 29 de septiembre de 2018.
- Orito, K.; Seki, Y.; Suginome, H.; Iwadare, T. (1989). «Synthesis of S-Methyl 2-Hydroxyalkanethioates, 2-Hydroxyalkanoic Acids and Related Compounds via the Addition Reaction of Tris(methylthio)methanide Ion to Alkanals». Bulletin of the Chemical Society of Japan 62 (6): 2013-2017. Consultado el 29 de septiembre de 2018.
- Li, N.; Jia, W.; Zhang, Y.; Tan, F.; Zhang, J. (2011). «Synergistic effect of 1,4-cyclohexanediol and 1,2-hexanediol on percutaneous absorption and penetration of metronidazole». Int J Pharm. 415 (1-2): 169-174. Consultado el 24 de septiembre de 2018.
- Li, N.; Jia, W.; Zhang, Y.;, Zhang, M.C.; Tan, F.; Zhang, J. (2014). «Effect of Hydrocarbon Chain Length in 1,2-Alkanediols on Percutaneous Absorption of Metronidazole: Toward Development of a General Vehicle for Controlled Release». AAPS PharmSciTech 15 (2): 354-363. Consultado el 29 de septiembre de 2018.
- Yamada-Onodera, K.; Nakajima, A.; Tani Y. (2006). «Purification, characterization, and gene cloning of glycerol dehydrogenase from Hansenula ofunaensis, and its expression for production of optically active diol». Journal of Bioscience and Bioengineering 102: 545-551. Consultado el 29 de septiembre de 2018.
- Method for skin-whitening using composition containing resveratryl triglycolate. Boo, Yong Chool; et al. (2017) Patente US2017210694
- External preparation for skin. Tada, et al. (2010) Patente US7795300