2-butil-1,3-propanodiol
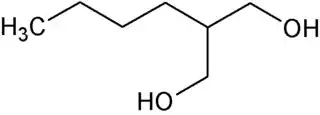
El 2-butil-1,3-propanodiol, 2-butilpropano-1,3-diol o 2-n-butilpropano-1,3-diol es un diol de fórmula molecular C7H16O2. Es isómero de posición del 1,7-heptanodiol y del prenderol, y, al igual que en este último, su cadena carbonada no es lineal.
| 2-butil-1,3-propanodiol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 2-butilpropano-1,3-diol | ||
| General | ||
| Otros nombres | 2-n-butilpropano-1,3-diol | |
| Fórmula semidesarrollada | CH3-(CH2)3-CH(CH2-OH)-CH2-OH | |
| Fórmula molecular | C7H16O2 | |
| Identificadores | ||
| Número CAS | 2612-26-2[1] | |
| ChemSpider | 2074138 | |
| PubChem | 2795259 | |
|
CCCCC(CO)CO
| ||
| Propiedades físicas | ||
| Apariencia | Líquido | |
| Densidad | 947 kg/m³; 0,947 g/cm³ | |
| Masa molar | 13 220 g/mol | |
| Punto de fusión | 15 °C (288 K) | |
| Punto de ebullición | 243 °C (516 K) | |
| Presión de vapor | 0,00564 mmHg | |
| Índice de refracción (nD) | 1,45 | |
| Propiedades químicas | ||
| Solubilidad en agua | 9 g/L | |
| log P | 0,90 | |
| Familia | Alcohol | |
| Peligrosidad | ||
| Punto de inflamabilidad | 385,55 K (112 °C) | |
| Compuestos relacionados | ||
| alcoholes | 2-metil-1-hexanol | |
| dioles |
2-butil-2-etil-1,3-propanodiol Neopentilglicol | |
| polioles | 1,2,3-heptanotriol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
El 2-butil-1,3-propanodiol es un líquido que tiene su punto de fusión a 15 °C y su punto de ebullición a 243 °C (89 °C a una presión de solo 13 mmHg). Posee una densidad ligeramente inferior a la del agua, 0,947 g/cm³. El logaritmo de su coeficiente de reparto, logP ≃ 0,90, conlleva una solubilidad bastante mayor en disolventes apolares que en agua.[2][3][4]
Síntesis y usos
El 2-butil-1,3-propanodiol puede prepararse por reducción de dietilmalonato de 2-butilo con LiAlH4.[5]
Este diol se ha utilizado como intermediario en la fabricación de cristales líquidos con átomos de azufre. Así, se sustituyen uno o los dos grupos -OH por -SH mediante reacción con bromuro de hidrógeno y ácido sulfúrico concentrado, y posterior tratamiento con tiourea en trietilenglicol.[6] Puede usarse también en la producción de cristales líquidos aquirales que contengan flúor.[7]
Asimismo, es producto intermedio en la síntesis de 3-alquil-tietanos: el ácido dioico se reduce al diol para luego ser clorado.[8] Otro empleo del 2-butil-1,3-propanodiol es en la síntesis de aminas lipófilas como la 2-butilpropano-1,3-diamina, a la que se llega a través de su conversión a éster de sulfonato y su sustitución con eilendiamina o azida de sodio.[9]
Otros posibles usos del 2-butil-1,3-propanodiol es en la elaboración de polioles de ácido sulfónico —que pueden usarse como monómeros en la manufactura de diversas resinas—[10] y como disolvente polihidroxílico inodoro para detergentes líquidos.[11]
En otro orden de cosas, se ha investigado la oxidación asimétrica microbiana del 2-butil-1,3-propanodiol para conseguir una síntesis eficiente de los enantiómeros S- y R- del ácido 2-hidroximetilhexanoico (2-HMHA), compuesto útil como constituyente de un agente antibacteriano contra Staphylococcus aureus. Se ha encontrado que Acetobacter pasteurianus y Pseudomonas putida son los microorganismos que muestran una mayor actividad productora de S- y R-2-HMHA, respectivamente.[12]
Véase también
Los siguientes compuestos son isómeros del 2-butil-1,3-propanodiol:
Referencias
- Número CAS
- 2-Butyl-1,3-propanediol (ChemSpider)
- 2-Butylpropane-1,3-diol (PubChem)
- 2-butylpropane-1,3-diol (Molbase)
- Demus et al. (1981) J. fur Prakt. Chem. 323, pp. 902-913
- Yuichiro, H.; Atushi, N.;, Hiroyoshi, K. (1984). «Liquid Crystal Materials with Sulfur Atoms Incorporated in the Principal Structure 1. New Liquid Crystal Compounds with 1,3-Dithiane Ring». Bulletin of the Chemical Society of Japan 57 (7): 1966-1969. Consultado el 28 de septiembre de 2018.
- Achiral fluorine-containing liquid crystals. Janulis, E.P. (1993) Patente EP0360521
- Shevchenko, S.E.; Volynskii, N.P. (2008). «Synthesis of 3-alkyl(aryl)thietanes». Petroleum Chemistry 48 (2): 123-128. Consultado el 28 de septiembre de 2018.
- Skarżewski, J.; Daniluk, E. (1983). «Lipophilic complexones, part 3. Synthesis of polyamines derived from 2-alkyl-1,3-propanediols and 2,2-bis(hydroxymethyl)alkanols». Monatshefte für Chemie / Chemical Monthly 114 (10): 1071-1077. Consultado el 28 de septiembre de 2018.
- Sulfonic acid polyol compound, polyurethane resin, polyurethane resin for magnetic recording medium, and magnetic recording medium. Omura, et al. (2010) Patente 7,737,305
- Substantially odor-free polyhydroxyl solvents. Duval, D.L. et al. (1998) Patente WO9802513
- Mitsukura, K.; Uno, T.; Yoshida, T.; Nagasawa, T. (2007). «Microbial asymmetric oxidation of 2-butyl-1,3-propanediol». Applied Microbiology and Biotechnology 76 (1): 61-65. Consultado el 28 de septiembre de 2018.