1,4-ciclohexanodiol
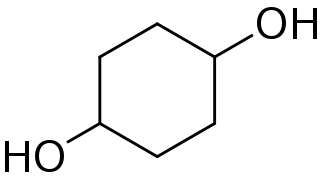
El 1,4-ciclohexanodiol, llamado también quinitol, es un diol alifático de fórmula molecular C6H12O2. Su estructura se corresponde a un anillo de ciclohexano con dos grupos hidroxilo (-OH) en las posiciones 1 y 4 del mismo. Dependiendo de la posición espacial de los dos hidroxilos respecto al anillo, se distinguen dos esteroisómeros de este compuesto, cis y trans.
| 1,4-ciclohexanodiol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Ciclohexano-1,4-diol | ||
| General | ||
| Otros nombres |
Quinitol 1,4-dihidroxiciclohexano Hexahidroquinona | |
| Fórmula molecular | C6H12O2 | |
| Identificadores | ||
| Número CAS | 6995-79-5[1] | |
| ChemSpider | 10689 | |
| PubChem | 11162 | |
|
C1CC(CCC1O)O
| ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco | |
| Densidad | 1156 kg/m³; 1,156 g/cm³ | |
| Masa molar | 11 616 g/mol | |
| Punto de fusión | 100 °C (373 K) | |
| Punto de ebullición | 252 °C (525 K) | |
| Presión de vapor | 0,00062 mmHg | |
| Índice de refracción (nD) | 1,526 | |
| Propiedades químicas | ||
| Solubilidad en agua | 38 g/L | |
| log P | 0,2 | |
| Familia | Alcohol | |
| Peligrosidad | ||
| Punto de inflamabilidad | 338 K (65 °C) | |
| NFPA 704 |
1
1
0
| |
| Compuestos relacionados | ||
| alcoholes | Ciclohexanol | |
| dioles |
1,3-ciclopentanodiol 1,4-ciclohexanodimetanol 1,3-adamantanodiol | |
| polioles |
1,3,5-ciclohexanotriol 1,2,3-ciclohexanotriol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
El 1,4-ciclohexanodiol es un sólido blanco que tiene su punto de fusión a 100 °C y su punto de ebullición a 251 °C; a una presión de solo 20 mmHg hierve a 150 °C. Posee una densidad superior a la del agua, 1,156 g/cm³. El valor estimado del logaritmo de su coeficiente de reparto, logP ≃ 0,2, implica una solubilidad mayor en disolventes apolares que en agua.[2][3][4]
En cuanto a su reactividad, este compuesto es incompatible con agentes oxidantes fuertes, ácidos fuertes, cloruros de acilo y anhídridos de ácido.[5]
Síntesis y usos
Se puede sintetizar 1,4-ciclohexanodiol a partir de la ciclohexano-1,4-diona por hidrogenación catalítica en fase líquida. En dicha reacción se utiliza rutenio sobre SiO2 y como disolvente se emplea 2-propanol bajo una presión moderada de hidrógeno (6,2 bar).[6] Empleando diioduro de samario como catalizador se alcanza un rendimiento superior al 99%.[7] Este mismo catalizador —asociado con una base— propicia la hidrogenación de hidroquinona para también conseguir 1,4-ciclohexanodiol.[8]
Es posible preparar 1,4-ciclohexanodiol a partir de un éster de este diol. Así, el 4-metilbenzoato de 4-hidroxiciclohexilo, si se trata con diioduro de samario-hexametilfosforamida-metanol durante un breve período de tiempo, produce 1,4-ciclohexanodiol con un rendimiento en torno al 95%.[9][10] De manera análoga, la desprotección del trimetil-(4-trimetilsililoxiciclohexil)oxisilano —el éter de trimetilsililo de este diol— con ácido sulfámico en agua constituye otra forma de preparar el 1,4-ciclohexanodiol.[11]
A su vez, la aminación de este diol sirve para elaborar 1,4-ciclohexanodiamina. Se ha estudiado la utilización de amoníaco supercrítico a 125 bar de presión, empleando como catalizador cobalto estabilizado con un 5% de hierro.[12]
Se ha estudiado el efecto del 1,4-ciclohexanodiol, combinado con el 1,2-heptanodiol, en la adsorción percutánea del fármaco metronidazol, antibiótico y antiparasitario;[13] este diol retarda la adsorción de este fármaco, minimizando la toxicidad sistemática potencial mientras se mantiene la eficacia terapéutica.[14]
El 1,4-ciclohexanodiol se emplea en la producción de diferentes polímeros, como por ejemplo poliuretanos termoplásticos[15] o polímeros que son conductores térmicos.[16] Otro uso de este diol es en la crioconservación de células, formando parte de una composición que, en contacto con las mismas, permite su conservación a temperaturas muy bajas. Dicha composición debe contener preferiblemente mezclas racémicas de 1,4-ciclohexanodiol o 1,3-ciclohexanodiol.[17]
Precauciones
El 1,4-ciclohexanodiol es un compuesto combustible cuyo punto de inflamabilidad es 65 °C. Su polvo puede formar una mezcla explosiva con el aire. Se debe mantener el producto (y el recipiente vacío) alejado del calor y de fuentes de ignición.[5]
Véase también
Los siguientes dioles son isómeros del 1,4-ciclohexanodiol:
- 1,2-ciclohexanodiol
- 1,3-ciclohexanodiol
- 1,1-ciclobutanodiildimetanol
Referencias
- Número CAS
- 1,4-Cyclohexanediol (ChemSpider)
- 1,4-Cyclohexanediol (PubChem)
- 1,4-Cyclohexanediol (Molbase)
- 1,4-Cyclohexanediol, mixture of cis and trans. Safety Data Sheet (ThermoFisher)
- Bonnet, M.; Geneste, P.; Rodriguez, M. (1980). «Liquid-phase catalytic hydrogenation of 1,4-cyclohexanedione: activity and selectivity». Journal of Organic Chemistry 45 (1): 40-43. Consultado el 24 de octubre de 2018.
- Kamochi, Y.; Kudo, T.; Masuda, T.; Takadate, A. (2005). «Facile Deoxygenation of Dicarbonyl Compounds Using a Samarium Diiodide–Additive System». Chemical and Pharmaceutical Bulletin 53 (8): 1017-1020. Consultado el 24 de octubre de 2018.
- Kamochi, Y.; Kudo, T. (1994). «Novel and facile reduction of phenol derivatives with samarium diiodide-base system». Tetrahedron Letters 35 (24): 4169-4172. Consultado el 24 de octubre de 2018.
- Lam, K.; Markó, I.E. (2009). «Chemoselective Chemical and Electrochemical Deprotections of Aromatic Esters». Organic Letters 11 (13): 2752-2755. Consultado el 24 de octubre de 2018.
- Synthesis Route for 556-48-9 (Molbase)
- Rostami, A.; Ahmad-Jangi, F.; Zarebin, M.R.; Akradi, J. (2010). «Green and Efficient Procedure for the Trimethylsilylation of Hydroxy Groups and Their Regeneration Using Sulfamic Acid as Recyclable Catalyst». Synthetic Communications 40 (10): 1500-1507. Consultado el 24 de octubre de 2018.
- Fischer, A; Mallat, T; Baiker, A. (1999). «Synthesis of 1,4-Diaminocyclohexane in Supercritical Ammonia». Journal of Catalysis 182 (2): 289-291. Consultado el 7 de junio de 2016.
- Li, N.; Jia, W.; Zhang, Y.; Tan, F.; Zhang, J. (2011). «Synergistic effect of 1,4-cyclohexanediol and 1,2-hexanediol on percutaneous absorption and penetration of metronidazole». Int. J .Pharm. 415 (1-2): 169-174. Consultado el 24 de septiembre de 2018.
- Li, N.; Jia, W.; Zhang, Y.;, Zhang, M.C.; Tan, F.; Zhang, J. (2014). «Effect of Hydrocarbon Chain Length in 1,2-Alkanediols on Percutaneous Absorption of Metronidazole: Toward Development of a General Vehicle for Controlled Release». AAPS PharmSciTech 15 (2): 354-363. Consultado el 29 de septiembre de 2018.
- Thermoplastic polyurethane additives for improved polymer matrix composites and methods of making and using therefor. Brink, A.E.; Owens, J.T. (1997) Patente US6395823B1
- Thermally conductive polymer molded article and method for producing the same. Tobita, M.; Shimoyama, N.; Ishigaki, T.; Kimura, T. (2002) Patente US7189778B2
- Cyclohexanediol cryoprotectant compounds. Brockbank, K.; Taylor, M.; Campbell, L. (2000) Patente US20020068360A1
