2,5-dimetil-3-hexino-2,5-diol
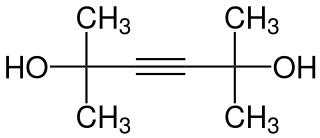
El 2,5-dimetil-3-hexino-2,5-diol, llamado también dimetilhexinodiol o tetrametilbutinodiol, es un diol de fórmula molecular C8H14O2.[2] La cadena carbonada de este diol es ramificada y contiene un triple enlace entre los carbonos 3 y 4 de la misma.
| 2,5-dimetil-3-hexino-2,5-diol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 2,5-dimetilhex-3-ino-2,5-diol | ||
| General | ||
| Otros nombres |
Dimetilhexinodiol Tetrametilbutinodiol Acetilenpinacol Kemitracin 50 | |
| Fórmula semidesarrollada | CH3--C(OH)(CH3)-C≡C-C(OH)(CH3)-CH3 | |
| Fórmula molecular | C8H14O2 | |
| Identificadores | ||
| Número CAS | 142-30-3[1] | |
| Número RTECS | MR0176000 | |
| ChEMBL | CHEMBL3188902 | |
| ChemSpider | 8545 | |
| PubChem | 8883 | |
| UNII | 22RR53U71W | |
|
CC(C)(C#CC(C)(C)O)O
| ||
| Propiedades físicas | ||
| Apariencia | Sólido blanco o amarillento | |
| Densidad | 989 kg/m³; 0,989 g/cm³ | |
| Masa molar | 14 220 g/mol | |
| Punto de fusión | 94 °C (367 K) | |
| Punto de ebullición | 205 °C (478 K) | |
| Presión de vapor | 0,061 mmHg | |
| Índice de refracción (nD) | 1,455 | |
| Propiedades químicas | ||
| Solubilidad en agua | 17 g/L | |
| log P | 0,29 | |
| Familia | Alcohol | |
| Peligrosidad | ||
| Punto de inflamabilidad | 375 K (102 °C) | |
| NFPA 704 |
1
0
0
| |
| Compuestos relacionados | ||
| dioles |
1,4-butinodiol 3-hexino-2,5-diol 2,5-dimetil-2,5-hexanodiol 3,4-dimetil-4-octino-3,6-diol 4-octino-3,6-diol 2,4-hexadiino-1,6-diol | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
El 2,5-dimetil-3-hexino-2,5-diol es un sólido de color blanco o amarillento. Tiene su punto de fusión a 94 °C aproximadamente y su punto de ebullición a 205 °C (122 °C a una presión de solo 7 mmHg). Posee una densidad inferior a la del agua, 0,949 g/cm³. El valor del logaritmo de su coeficiente de reparto, logP = 0,29, denota una solubilidad algo mayor en disolventes apolares —como el 1-octanol— que en agua.[3][2][4]
En cuanto a su reactividad, es incompatible con agentes oxidantes fuertes, ácidos fuertes, bases fuertes, agentes reductores fuertes, anhídridos de ácido y cloruros de acilo.[5]
Síntesis y usos
El 2,5-dimetil-3-hexino-2,5-diol puede sintetizarse haciendo reaccionar acetileno y acetona a 30-35 °C en una suspensión de isobutóxido de potasio y xileno. El rendimiento del proceso es del 94% y como subproducto se genera metilbutinol.[6][7] En vez de isobutóxido se puede emplear hidróxido de potasio en benceno, seguido de una neutralización con ácido clorhídrico. Esta segunda metodología implica una temperatura algo mayor (50 °C aproximadamente).[8]
Se ha estudiado la adición de bromo al 2,5-dimetil-3-hexino-2,5-diol, observándose que la proporción de los dibromuros cis o trans resultantes depende del disolvente empleado y de la presencia/ausencia de luz. Así, mientras que con N,N-dimetilformamida en oscuridad se forma mayoritariamente el isómero trans, la utilización de tetracloruro de carbono e irradiación favorece la formación del isómero cis.[9]
El 2,5-dimetil-3-hexino-2,5-diol sirve para producir 2,5-dimetil-2,5-hexanodiol: esta hidrogenación se lleva a cabo con paladio sobre Al2O3.[6] También se ha empleado para sintetizar heterociclos complejos como 3,6-dimetiltieno[3,2-b]tiofeno —por reacción con azufre en benceno a 190-200 °C—, así como su análogo de selenio cuando se le hace reaccionar con este elemento.[10] Por otra parte, la alquilación de benceno con 2,5-dimetil-3-hexino-2,5-diol, en presencia de cloruro de aluminio anhidro, forma el compuesto 5,5,10,10-tetrametil-4b,5,9b,10-tetra-hidroindeno[2,1-a]indeno.[11]
El 2,5-dimetil-3-hexino-2,5-diol, combinado con el diisocianato de 1,6-hexametileno, puede formar parte del segmento blando de poliuretanos. Los poliuretanos basados en este diol tienen una temperatura de transición vítrea relativamente baja (-57 °C), una resistencia a la tracción de 11-14 MPa y una elongación de rotura de 600-700%, características que hacen que sean materiales con un gran número de aplicaciones potenciales.[12]
Véase también
Los siguientes compuestos son isómeros del 2,5-dimetil-3-hexino-2,5-diol:
- 3-ciclohexeno-1,1-diildimetanol
- 4-ciclohexeno-1,2-diildimetanol
Referencias
- Número CAS
- 2,5-Dimethyl-3-hexyne-2,5-diol (PubChem)
- 2,5-Dimethyl-3-hexyne-2,5-diol (ChemSpider)
- 2,5-Dimethyl-3-hexyne-2,5-diol (Chemical Book)
- 2,5-Dimethyl-3-hexyne-2,5-diol. Safety Data Sheet (ThermoFisher)
- Method for preparing acetylene alcohols and their secondary products. Brunner, M. et al. (1999) Patente EP1161407B1
- Synthesis Route for 142-30-3 (Molbase)
- Technique for producing 2,5-dimethyl-2,5-hexandiol by extraction and decompression distillation method. (2008) Patente CN101234950B
- Bergel'son, L.D. (1960). «Stereochemistry of additions to a triple bond». Bulletin of the Academy of Sciences of the USSR, Division of chemical science 9 (6): 995-1000. Consultado el 30 de octubre de 2018.
- Choi, K.S.; Sawada, K.; Dong, H.; Hoshino, M.; Nakayama, J. (1994). «A One-Pot synthesis of Substituted Thieno[3,2-b]thiophenens and Selenolo[3,2-b]selenophenes». Heterocycles 38 (1): 143-149. Consultado el 30 de octubre de 2018.
- Lagidze, R.M.; Iremadze, N.K.; Samsoniya, G.G.; Lopatin, B.V. (1966). «The structure of the oxidation products of 5,5,10,10-tetramethyl-4b,5,9b,10-tetra-hydroindeno[2,1-a]indene». Bulletin of the Academy of Sciences of the USSR, Division of chemical science 15 (8): 1399-1401. Consultado el 30 de octubre de 2018.
- Oprea, S. (2010). «The effect of chain extenders structure on properties of new polyurethane elastomers». Polymer Bulletin 65 (8): 753-766. Consultado el 30 de octubre de 2018.
