3,4-dicloro-1-buteno
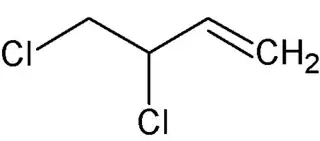
El 3,4-dicloro-1-buteno, 3,4-diclorobut-1-eno de acuerdo a la nomenclatura IUPAC, es un compuesto orgánico de fórmula molecular C4H6Cl2. Es un haloalqueno lineal de cuatro carbonos con un doble enlace en uno de los extremos (carbonos 1 y 2) y dos átomos de cloro unidos a los carbonos 3 y 4 respectivamente. Al ser el carbono 3 asimétrico, este compuesto posee dos enantiómeros.[2][3][4]
| 3,4-dicloro-1-buteno | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 3,4-diclorobut-1-eno | ||
| General | ||
| Otros nombres | 1,2-dicloro-3-buteno | |
| Fórmula semidesarrollada | ClCH2-ClCH-CH=CH2 | |
| Fórmula molecular | C4H6Cl2 | |
| Identificadores | ||
| Número CAS | 760-23-6[1] | |
| Número RTECS | EM4740000 | |
| ChEMBL | CHEMBL3182884 | |
| ChemSpider | 12431 | |
| PubChem | 12971 | |
| UNII | IA19EYW12D | |
|
C=C(CCl)CCl
| ||
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Densidad | 1153 kg/m³; 1,153 g/cm³ | |
| Masa molar | 12 499 g/mol | |
| Punto de fusión | −61 °C (212 K) | |
| Punto de ebullición | 123 °C (396 K) | |
| Presión de vapor | 21,9 mmHg | |
| Índice de refracción (nD) | 1,4658 | |
| Propiedades químicas | ||
| Solubilidad en agua | 420 mg/L | |
| Solubilidad | Benceno, cloroformo | |
| log P | 2,1 | |
| Familia | Haloalqueno | |
| Peligrosidad | ||
| Punto de inflamabilidad | 301 K (28 °C) | |
| Compuestos relacionados | ||
| cloroalquenos |
1-cloro-2-buteno 3-cloro-1-buteno 4-cloro-1-buteno | |
| dicloroalquenos | 1,1-dicloro-3,3-dimetil-1-buteno | |
| dicloroalcanos |
1,2-diclorobutano 1,3-diclorobutano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
A temperatura ambiente, el 3,4-dicloro-1-buteno es un líquido incoloro o de color amarillo pálido. Tiene su punto de ebullición a 123 °C y su punto de fusión -61 °C. Posee una densidad superior a la del agua, ρ = 1,153 g/cm³, y en estado gaseoso es 4,31 veces más denso que el aire.[3][2]
El valor del logaritmo de su coeficiente de reparto, logP ≃ 2,1, indica que es más soluble en disolventes apolares que en disolventes polares. En agua su solubilidad es de 420 mg/L, es soluble en etanol y éter dietílico, y muy soluble en benceno y cloroformo.[2]
Síntesis
El 3,4-dicloro-1-buteno puede prepararse por isomerización de 1,4-dicloro-2-buteno por medio de naftenato de cobre, dinitrilo y amida a 80 - 160 °C. Para esta isomerización cabe también utilizar trifenilfosfina o diversos sulfuros de dialquilo en presencia de haluros de cobre.[5] En este sentido, el equilibrio 3,4-dicloro-2-buteno ⇆ 1,4-dicloro-1-buteno está fuertemente catalizado por complejos de hierro solubles[6] o por compuestos de fórmula CpFe(CO)2X, en donde Cp denota un derivado de ciclopentadienilo y X un halógeno.[5]
Usos
Se puede preparar cloropreno haciendo reaccionar 3,4-dicloro-1-buteno con un hidróxido de metal alcalino o alcalinotérreo usando como catalizador un compuesto de amonio cuaternario en el que el nitrógeno esté unido a cuatro radicales por enlaces covalentes.[7] Análogamente, si se somete al 3,4-dicloro-1-buteno a una reacción de deshidrocloración en fase gaseosa en presencia de fosfato de lantano como catalizador, se obtiene 1-cloro-1,3-butadieno. La temperatura óptima de esta reacción está comprendida entre 200 y 250 °C.[8] Asimismo, el 1,2,3,4-tetraclorobutano puede sintetizarse por cloración de 3,4-dicloro-1-buteno utilizando cloruro férrico como catalizador.[9]
La hidroboración de 3,4-dicloro-1-buteno con 9-borabiciclo[3.3.1]nonano bajo atmósfera de nitrógeno y posterior tratamiento con hidróxido de sodio proporciona (clorometil)ciclopropano. El rendimiento es del 70%[10] y se piensa que la reacción transcurre con la formación de un derivado γ,γ-dicloroalquilborano como intermediario.[11]
Este cloroalqueno también se ha empleado para sintetizar 3-alil-1H-indoles 2-sustituidos mediante ciclación-alilación, catalizada por paladio, de o-alquinilanilinas.[12]
Precauciones
El 3,4-dicloro-1-buteno es un compuesto combustible que tiene su punto de inflamabilidad a 28 °C. El contacto con esta sustancia provoca irritación severa en piel y ojos.[13]
Véase también
Los siguientes compuestos son isómeros del 3,4-dicloro-1-buteno:
Referencias
- Número CAS
- 3,4-Dichloro-1-butene (PubChem)
- 3,4-Dichloro-1-butene (ChemSpider)
- 3,4-Dichloro-1-butene (Chemical Book)
- Process for isomerizing dichlorobutenes (2000) Schertl, P. Patente US6392107B2
- Henrici-Olivé, G.; Olivé, S. (1971). «Kinetics and mechanism of the iron catalyzed positional isomerization of dichlorobutenes». Journal of Organometallic Chemistry 29 (2): 307-311. Consultado el 9 de febrero de 2020.
- Dehydrohalogenation of 3,4-dichloro-1-butene (1970) Campbell, J.B.; Tarney, R.E. Patente US3981937A
- Preparation of 1-chloro-1,3-butadiene (1993) Soret, I. et al. Patente JPH07233105A
- Method and apparatus for producing 1,2,3,4-tetrachlorobutane (2019). 克己三神 陽介福地 慎也小黒 小林浩 Patente WO2019181439A1
- Zaidlewicz, M.; Krzeminski, M. (2005). «6.1.38.23 Method 23: Small Ring Formation». Science of Syntehsis 6: 1182. Consultado el 9 de febrero de 2020.
- Abu Ali, H.; Dembitsky, V. M. (2005). «6.1.37.10 Method 10: Cyclopropane Ring Formation via Hydroboration of Allylic Halides». Science of Synthesis 6: 1093. Consultado el 9 de febrero de 2020.
- Takacs, J. M.; Vayalakkada, S.; Jiang, X. (2001). «1.2.3.4.2 Intramolecular Addition of Nitrogen Nucleophiles Followed by Allylation». Science of Synthesis 1: 291. Consultado el 9 de febrero de 2020.
- 3,4-Dichloro-1-butene. Safety data sheet (GuideChem)