Constantes de estabilidad de complejos
Una constante de estabilidad ( constante de formación, constante de unión) es una constante de equilibrio para la formación de un complejo en solución. Es una medida de la fuerza de la interacción entre los reactivos que se unen para formar el complejo. Hay dos tipos principales de complejos: compuestos formados por la interacción de un ion metálico con un ligando y complejos supramoleculares, como complejos huésped-huésped y complejos de aniones. La(s) constante(s) de estabilidad proporciona la información requerida para calcular la(s) concentración(es) de los complejos en solución. Existen muchas áreas de aplicación en química, biología y medicina.
Historia
Jannik Bjerrum desarrolló el primer método general para la determinación de constantes de estabilidad de complejos de metal-amina en 1941.[1] Las razones por las que esto ocurrió en una fecha tan tardía, casi 50 años después de que Alfred Werner propusiera las estructuras correctas para los complejos de coordinación , han sido resumidas por Beck y Nagypál.[2] La clave del método de Bjerrum fue el uso del electrodo de vidrio y el medidor de pH recientemente desarrollados para determinar la concentración de iones de hidrógeno en la solución. Bjerrum reconoció que la formación de un complejo metálico con un ligando era una especie de equilibrio ácido-base: existe una competencia por el ligando, L, entre el ion metálico, Mn+, y el ion hidrógeno, H+. Esto significa que hay que considerar dos equilibrios simultáneos. En lo que sigue se omiten las cargas eléctricas en aras de la generalidad. Los dos equilibrios son
- H + L
 HL
HL - M + L
 ML
ML
Por lo tanto, siguiendo la concentración de iones de hidrógeno durante una titulación de una mezcla de M y HL con una base, y conociendo la constante de disociación ácida de HL, se podría determinar la constante de estabilidad para la formación de ML. Bjerrum pasó a determinar las constantes de estabilidad para sistemas en los que se pueden formar muchos complejos.
- M + q L
 MLq
MLq
Los siguientes veinte años vieron una verdadera explosión en el número de constantes de estabilidad que se determinaron. Se descubrieron relaciones, como la serie de Irving-Williams. Los cálculos se realizaron a mano utilizando los llamados métodos gráficos. Rossotti y Rossotti resumen las matemáticas subyacentes a los métodos utilizados en este período.[3] El siguiente desarrollo clave fue el uso de un programa de computadora, LETAGROP[4][5] para hacer los cálculos. Esto permitió el examen de sistemas demasiado complicados para ser evaluados mediante cálculos manuales. Posteriormente, se desarrollaron programas informáticos capaces de manejar equilibrios complejos en general, como SCOGS[6] y MINIQUAD,[7] de modo que hoy en día la determinación de las constantes de estabilidad se ha convertido casi en una operación "rutinaria". Los valores de miles de constantes de estabilidad se pueden encontrar en dos bases de datos comerciales.[8][9]
Teoría
La formación de un complejo entre un ion metálico, M, y un ligando, L, de hecho, suele ser una reacción de sustitución. Por ejemplo, en soluciones acuosas, los iones metálicos estarán presentes como aquiones, por lo que la reacción para la formación del primer complejo podría escribirse como
- [M(H2O)n] + L
 [M(H2O)n−1L] + H2O
[M(H2O)n−1L] + H2O
La constante de equilibrio para esta reacción está dada por
- Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle \beta^'=\frac{[\mathrm{M(H_2O)}_{n-1}\mathrm{L}] [\mathrm{H_2O}]} {[\mathrm{M(H_2O)}_n] [\mathrm{L}] }}
[L] debe leerse como "la concentración de L" y de la misma manera para los otros términos entre corchetes. La expresión se puede simplificar enormemente eliminando aquellos términos que son constantes. El número de moléculas de agua unidas a cada ion metálico es constante. En soluciones diluidas la concentración de agua es efectivamente constante. La expresión se convierte en.
- Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle \beta =\mathrm{\frac{[ML] } {[M] [L] }}.}
Siguiendo esta simplificación se puede dar una definición general, para el equilibrio general
- p M + q L …
 MpLq…
MpLq… - Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle \beta_{pq...}=\frac{[\mathrm{M}_p\mathrm{L}_q...] } {[\mathrm{M}]^p [\mathrm{L}]^q ... }}
La definición se puede ampliar fácilmente para incluir cualquier número de reactivos. Los reactivos no siempre tienen que ser un metal y un ligando, sino que pueden ser cualquier especie que forme un complejo. Las constantes de estabilidad definidas de esta manera, son constantes de asociación. Esto puede llevar a cierta confusión, ya que los valores de pKa son constantes de disociación. En los programas de computadora de propósito general, es costumbre definir todas las constantes como constantes de asociación. La relación entre los dos tipos de constante se da en las constantes de asociación y disociación .
Constantes escalonadas y acumulativas
Una constante acumulativa o general, dado el símbolo β, es la constante para la formación de un complejo a partir de reactivos. Por ejemplo, la constante acumulativa para la formación de ML2 está dada por
- ;
Las constantes por pasos, K1 y K2 se refieren a la formación de los complejos paso a paso.
- Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle \begin{array}{rl} \ce{{M} + L <=> ML};&K_1=\mathrm{\frac{[ML]}{[M][L]}}\\ \ce{{ML} + L <=> ML2};&K_2=\mathrm{\frac{[ML_2]}{[ML][L]}} \end{array}}
Resulta que
Una constante acumulativa siempre se puede expresar como el producto de constantes por pasos. A la inversa, cualquier constante escalonada puede expresarse como un cociente de dos o más constantes generales. No hay una notación acordada para las constantes por pasos, aunque un símbolo como Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle K_{ML}^L} se encuentra a veces en la literatura. Siempre es mejor definir cada constante de estabilidad por referencia a una expresión de equilibrio.
Productos de hidrólisis
La formación de un complejo hidroxo es un ejemplo típico de una reacción de hidrólisis. Una reacción de hidrólisis es aquella en la que un sustrato reacciona con el agua, dividiendo una molécula de agua en hidróxido e iones de hidrógeno. En este caso, el ion hidróxido forma un complejo con el sustrato.
- M + OH
 M(OH); Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle K =\mathrm{\frac{[M(OH)] } {[M] [OH] }}}
M(OH); Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle K =\mathrm{\frac{[M(OH)] } {[M] [OH] }}}
En el agua de la concentración de hidróxido se relaciona con la concentración de iones de hidrógeno por la constante auto-ionización, Kw.
- Kw=[H+][OH−]; [OH−] = Kw[H+]−1
La expresión para la concentración de hidróxido se sustituye en la expresión constante de formación.
- Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle \beta^*_{1-1}= K K_\mathrm{w} =\frac{[\mathrm{M}(\mathrm{OH})] } {[\mathrm{M}] [\mathrm{H}]^{-1} }}
La literatura suele dar valor de β*.
Complejos ácido-base
Puede considerarse que un ácido de Lewis, A, y una base de Lewis, B, forman un complejo AB
- A + B
 AB
AB
Hay tres teorías principales relacionadas con la fuerza de los ácidos y bases de Lewis y las interacciones entre ellos.
- La teoría del ácido-base fuerte y débil (HSAB).[10] Esto se utiliza principalmente para fines cualitativos.
- Drago y Wayland propuso una ecuación de dos parámetros que predice la entalpía estándar de formación de un gran número de aductos con bastante precisión.
−ΔH⊖ (A − B) = EAEB + CACB.Los valores de los parámetros E y C están disponibles[11]
- Números de donante de Guttmann: para las bases, el número se deriva de la entalpía de reacción de la base con pentacloruro de antimonio en 1,2-dicloroetano como disolvente. Para los ácidos, un número aceptor se deriva de la entalpía de reacción del ácido con óxido de trifenilfosfina.[12]
Termodinámica
La termodinámica de la formación de complejos de iones metálicos proporciona mucha información significativa.[13] En particular, es útil para distinguir entre los efectos entálpicos y entrópicos. Los efectos entalpicos dependen de la fuerza de los enlaces y los efectos entrópicos tienen que ver con cambios en el orden / desorden de la solución en su conjunto. El efecto del quelato, a continuación, se explica mejor en términos de termodinámica.
Una constante de equilibrio está relacionada con el cambio de energía libre estándar de Gibbs para la reacción
- ΔG⊖ = −2.303 RT log10 β.
R es la constante de gas y T es la temperatura absoluta. A los 25 °C, ΔG⊖ = (−5.708 kJ mol−1) ⋅ log β . La energía libre se compone de un término de entalpía y un término de entropía.
- ΔG⊖ = ΔH⊖ − TΔS⊖
El cambio de entalpía estándar se puede determinar por calorimetría o mediante el uso de la ecuación de Van t Hoff, aunque es preferible el método de calorimetría. Cuando se han determinado tanto el cambio de entalpía estándar como la constante de estabilidad, el cambio de entropía estándar se calcula fácilmente a partir de la ecuación anterior.
El hecho de que las constantes de formación escalonada de complejos del tipo MLn disminuyen en magnitud a medida que n aumenta puede explicarse en parte en términos del factor de entropía. Tomemos el caso de la formación de complejos octaédricos .
- [M(H2O)mLn−1] + L
 [M(H2O)m−1Ln]
[M(H2O)m−1Ln]
Para el primer paso m = 6, n = 1 y el ligando puede ir en uno de los 6 sitios. Para el segundo paso m = 5 y el segundo ligando puede ir en uno de solo 5 sitios. Esto significa que hay más aleatoriedad en el primer paso que en el segundo; ΔS⊖ es más positivo, entonces G⊖ es más negativo y se registra K1 > log K2. La relación de las constantes de estabilidad por pasos se puede calcular sobre esta base, pero las relaciones experimentales no son exactamente iguales porque Δ H ⊖ no es necesariamente la misma para cada paso.[14] El factor de entropía también es importante en el efecto quelato, a continuación.
Dependencia de la fuerza iónica
La constante de equilibrio termodinámica, K⊖, para el equilibrio.
- M + L
 ML
ML
se puede definir[15] como
- Error al representar (SVG (MathML puede ser habilitado mediante un plugin de navegador): respuesta no válida («Math extension cannot connect to Restbase.») del servidor «http://localhost:6011/es.wikipedia.org/v1/»:): {\displaystyle K^{\ominus} =\mathrm{\frac{\{ML\}} {\{M\}\{L\}} }}
donde {ML} es la actividad de la especie química ML etc. K⊖ es adimensional ya que la actividad es adimensional. Las actividades de los productos se colocan en el numerador, las actividades de los reactivos se colocan en el denominador. Ver coeficiente de actividad para una derivación de esta expresión.
Dado que la actividad es el producto de la concentración y el coeficiente de actividad (γ), la definición también podría escribirse como
donde [ML] representa la concentración de ML y Γ es un cociente de coeficientes de actividad. Esta expresión puede generalizarse como
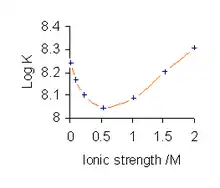
Para evitar las complicaciones implicadas en el uso de las actividades, las constantes de estabilidad se determinaron , cuando sea posible, en un medio que consiste en una solución de un fondo de electrolito a alta fuerza iónica , es decir, en condiciones en las que Γ se puede suponer que ser siempre constante.[15] Por ejemplo, el medio podría ser una solución de 0.1mol dm−3 nitrato de sodio o 3 mol Dm-3 perclorato de sodio Cuando Γ es constante, se puede ignorar y se obtiene la expresión general en la teoría anterior.
Todos los valores constantes de estabilidad publicados se refieren al medio iónico específico utilizado en su determinación y se obtienen diferentes valores con diferentes condiciones, como se ilustra para el complejo CuL (L = glicinato). Además, los valores constantes de estabilidad dependen del electrolito específico utilizado, ya que el valor de Γ es diferente para diferentes electrolitos, incluso a la misma fuerza iónica . No es necesario que haya una interacción química entre las especies en equilibrio y el electrolito de fondo, pero estas interacciones pueden ocurrir en casos particulares. Por ejemplo, los fosfatos forman complejos débiles con metales alcalinos , por lo que, al determinar las constantes de estabilidad que involucran fosfatos, como el ATP, el electrolito de fondo utilizado será, por ejemplo, una sal de tetralquilamonio . Otro ejemplo es el hierro (III) que forma complejos débiles con haluros y otros aniones, pero no con iones perclorato .
Cuando las constantes publicadas se refieren a una fuerza iónica diferente a la requerida para una aplicación particular, pueden ajustarse por medio de la teoría de los iones específicos (SIT) y otras teorías.[17]
Dependencia de la temperatura
Todas las constantes de equilibrio varían con la temperatura de acuerdo con la ecuación de Van 't Hoff[18]
Alternativamente
R es la constante de gas y T es la temperatura termodinámica. Así, por exotérmicas reacciones, donde la norma cambio de entalpía, ΔH⊖, es negativo, K disminuye con la temperatura, pero para endotérmicos reacciones, donde ΔH⊖ es positivo, K aumenta con la temperatura.
Factores que afectan a las constantes de estabilidad de los complejos
El efecto quelato
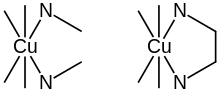
Considere los dos equilibrios, en solución acuosa, entre el ion cobre (II), Cu 2+ y la etilendiamina (en), por un lado, y la metilamina , MeNH 2, por el otro.
Cu2+ + en |
|
(1) |
Cu2+ + 2 MeNH2 |
|
(2) |
En (1) el ligando bidentado, la etilendiamina forma un complejo quelato con el ion cobre. La quelación resulta en la formación de un anillo de cinco miembros. En (2) el ligando bidentado se reemplaza por dos ligandos de metilamina monodentados de aproximadamente la misma potencia del donante, lo que significa que la entalpía de formación de enlaces Cu-N es aproximadamente la misma en las dos reacciones. En condiciones de concentraciones de cobre iguales y cuando la concentración de metilamina sea el doble de la concentración de etilendiamina, la concentración del complejo (1) será mayor que la concentración del complejo (2). El efecto aumenta con el número de anillos de quelatos, por lo que la concentración del complejo de EDTA, que tiene seis anillos de quelatos, es mucho mayor que un complejo correspondiente con dos ligandos donadores de nitrógeno monodentados y cuatro ligandos de carboxilato monodentados. Por lo tanto, el fenómeno del efecto quelato es un hecho empírico firmemente establecido: en condiciones comparables, la concentración de un complejo de quelato será más alta que la concentración de un complejo análogo con ligandos monodentados.
El enfoque termodinámico para explicar el efecto del quelato considera la constante de equilibrio para la reacción: cuanto mayor sea la constante de equilibrio, mayor será la concentración del complejo.
[Cu(en)] = β11[Cu][en] |
|
(3) |
[Cu(MeNH2)2] = β12[Cu][MeNH2]2 |
|
(4) |
Cuando la concentración analítica de metilamina es el doble que la de etilendiamina y la concentración de cobre es la misma en ambas reacciones, la concentración [Cu (en)] 2+ es mucho más alta que la concentración [Cu (MeNH2)2] 2+ porque β11 ≫ β12.
La diferencia entre las dos constantes de estabilidad se debe principalmente a la diferencia en el cambio de entropía estándar, ΔS⊖. En la ecuación (1) hay dos partículas a la izquierda y una a la derecha, mientras que en la ecuación (2) hay tres partículas a la izquierda y una a la derecha. Esto significa que se pierde menos entropía de desorden cuando se forma el complejo de quelato que cuando se forma el complejo con ligandos monodentados. Este es uno de los factores que contribuyen a la diferencia de entropía. Otros factores incluyen cambios de solvatación y formación de anillos. Algunos datos experimentales para ilustrar el efecto se muestran en la siguiente tabla.[19]

Estos datos muestran que los cambios de entalpía estándar son aproximadamente iguales para las dos reacciones y que la razón principal por la que el complejo de quelato es mucho más estable es que el término de entropía estándar es mucho menos desfavorable, de hecho, es favorable en este caso. En general, es difícil tener en cuenta precisamente los valores termodinámicos en términos de cambios en la solución a nivel molecular, pero está claro que el efecto del quelato es predominantemente un efecto de la entropía. Otras explicaciones, incluida la de Schwarzenbach,[20] se discuten en Greenwood y Earnshaw.[19]
El efecto de quelato aumenta a medida que aumenta el número de anillos de quelato. Por ejemplo, el complejo [Ni (dien)2)]2+ es más estable que el complejo [Ni(en)3)]2+; ambos complejos son octaédricos con seis átomos de nitrógeno alrededor del ion níquel, pero el dien (dietilentriamina, 1,4,7-triazaheptano) es un ligando tridentado y en es bidentado. El número de anillos de quelatos es uno menos que el número de átomos donantes en el ligando. El EDTA (ácido etilendiaminotetracético) tiene seis átomos donantes, por lo que forma complejos muy fuertes con cinco anillos de quelatos. Los ligandos como DTPA, que tienen ocho átomos donadores, se usan para formar complejos con grandes iones metálicos, como los iones lantánidos o actínidos , que generalmente forman complejos de 8 o 9 coordenadas.
bis(ethane-1%252C2-diamine)_200.svg.png.webp)
Los anillos de quelatos de 5 miembros y 6 miembros dan los complejos más estables. Los anillos de 4 miembros están sujetos a tensión interna debido a que el pequeño ángulo entre enlaces es el anillo. El efecto de quelato también se reduce con anillos de 7 y 8 miembros, porque los anillos más grandes son menos rígidos, por lo que se pierde menos entropía en su formación.
Desprotonación de grupos alifáticos-OH
La eliminación de un protón de un grupo alifático- OH es difícil de lograr en una solución acuosa porque la energía requerida para este proceso es bastante grande. Por lo tanto, la ionización de grupos alifáticos-OH ocurre en solución acuosa solo en circunstancias especiales. Una circunstancia de este tipo se encuentra con compuestos que contienen la subestructura H 2 N – C – C – OH. Por ejemplo, los compuestos que contienen la subestructura 2-aminoetanol pueden formar complejos de quelatos metálicos con la forma desprotonada, H 2 N – C – C – O - . El efecto de quelato suministra la energía extra necesaria para romper el enlace –OH.
Un ejemplo importante ocurre con la molécula tris . Esta molécula se debe utilizar con precaución como agente de tamponamiento, ya que formará complejos de quelatos con iones como Fe 3+ y Cu 2+ .
El efecto macrocíclico
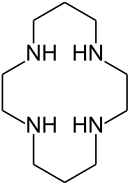
Se encontró que la estabilidad del complejo de cobre (II) con el ligando macrocíclico ciclam (1,4,8,11-tetraazaciclotetradecano) era mucho mayor de lo esperado en comparación con la estabilidad del complejo con la correspondiente amina de cadena abierta.[21] Este fenómeno fue denominado "el efecto macrocíclico " y también se interpretó como un efecto de entropía. Sin embargo, estudios posteriores sugirieron que tanto la entalpía como los factores de entropía estaban involucrados.[22]
Una diferencia importante entre los ligandos macrocíclicos y los ligandos de cadena abierta (quelantes) es que tienen selectividad para los iones metálicos, según el tamaño de la cavidad en la que se inserta el ion metálico cuando se forma un complejo. Por ejemplo, el éter corona 18-corona-6 forma complejos mucho más fuertes con el ion potasio, K+ que con el ion sodio más pequeño, Na+.[23]
En la hemoglobina, un ion de hierro (II) está complejado por un anillo de porfirina macrocíclica. El artículo hemoglobina afirma incorrectamente que la oxihemoglogina contiene hierro (III). Ahora se sabe que el hierro (II) en la hemoglobina es un complejo de baja rotación, mientras que en la oxihemoglobina es un complejo de alta rotación. El ion Fe 2+ de bajo espín encaja perfectamente en la cavidad del anillo de porhirina, pero el hierro de alto espín (II) es significativamente más grande y el átomo de hierro sale del plano del ligando macrocíclico.[24] Este efecto contribuye a la capacidad de la hemoglobina para unirse al oxígeno de manera reversible en condiciones biológicas. En la vitamina B12, un ion cobalto (II) se mantiene en un anillo corrino . La clorofila es un complejo macrocíclico de magnesio (II).
 |
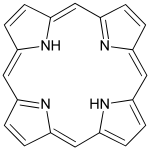 |
| Ciclam | Porfina , la porfirina más simple. |
.png.webp) |
| Estructuras de los éteres de corona comunes: 12-crown-4 , 15-crown-5 , 18-crown-6 , dibenzo-18-crown-6 y diaza-18-crown-6. |
Las constantes sucesivas de formación por pasos Kn en una serie como MLn (n = 1, 2, ...) generalmente disminuyen a medida que n aumenta. Las excepciones a esta regla ocurren cuando la geometría de los complejos de MLn no es la misma para todos los miembros de la serie. El ejemplo clásico es la formación del complejo diamminesilver (I) [Ag(NH3)2]+ en solución acuosa.
En este caso, K2. > K1. La razón de esto es que, en solución acuosa, el ion escrito como Ag + en realidad existe como la especie tetraédrica de aqua de cuatro coordenadas [Ag (OH 2 ) 4 ] + . El primer paso es una reacción de sustitución que implica el desplazamiento de una molécula de agua unida por el amoníaco que forma el complejo tetraédrico [Ag (NH 3 ) (OH 2 ) 3 ] + (comúnmente abreviado como [Ag (NH 3 )] + ). En el segundo paso, los ligandos aqua se pierden para formar un producto lineal de dos coordenadas [H 3 N – Ag – NH 3 ] + . El examen de los datos termodinámicos muestra que tanto la entalpia como los efectos de entropía determinan el resultado.[25]
| equilibrio | ΔH⊖ /kJ mol−1 | ΔS⊖ /J K−1 mol−1 |
|---|---|---|
| Ag + + NH 3 |
−21.4 | 8.66 |
| [Ag (NH 3 )] + + NH 3 |
−35.2 | −61.26 |
Existen otros ejemplos donde el cambio es de octaédrico a tetraédrico, como en la formación de [CoCl 4 ] 2− a partir de [Co (H 2 O) 6 ] 2+ .
Clasificación de iones metálicos
Ahrland, Chatt y Davies propusieron que los iones metálicos podrían describirse como de clase A si formaran complejos más fuertes con ligandos cuyos átomos donadores son nitrógeno , oxígeno o flúor que con los ligandos cuyos átomos donadores son fósforo , azufre o cloro y clase B si ocurre lo contrario. cierto.[26] Por ejemplo, Ni 2+ forma complejos más fuertes con aminas que con fosfinas, pero Pd 2+ forma complejos más fuertes con fosfinas que con aminas. Más tarde, Pearson propuso la teoría de ácidos y bases duros y blandos (teoría HSAB).[27] En esta clasificación, los metales de clase A son ácidos duros y los metales de clase B son ácidos blandos. Algunos iones, como el cobre (I), se clasifican como límite. Los ácidos duros forman complejos más fuertes con bases duras que con bases blandas. En términos generales, las interacciones duro-duro son predominantemente de naturaleza electrostática, mientras que las interacciones suave-suave son predominantemente de naturaleza covalente. La teoría de HSAB, aunque útil, es solo semi-cuantitativa.[28]
La dureza de un ion metálico aumenta con el estado de oxidación. Un ejemplo de este efecto está dado por el hecho de que el Fe 2+ tiende a formar complejos más fuertes con los ligandos N- donantes que con los ligandos O- donantes, pero lo contrario es cierto para el Fe 3+ .
Efecto del radio iónico
La serie Irving-Williams se refiere al ion metálico divalente de giro alto, octaédrico de la primera serie de transición. Coloca las estabilidades de los complejos en el orden.
- Mn <Fe <Co <Ni <Cu> Zn
Se encontró que este orden se mantiene para una amplia variedad de ligandos.[29] Hay tres líneas de la explicación de la serie.
- Se espera que el radio iónico disminuya regularmente para Mn2+ a Zn2+. Esta sería la tendencia periódica normal y explicaría el aumento general de la estabilidad.
- La energía de estabilización del campo cristalino (CFSE) aumenta de cero para el manganeso (II) a un máximo en níquel (II). Esto hace que los complejos sean cada vez más estables. CFSE vuelve a cero para el zinc (II).
- Aunque el CFSE para el cobre (II) es menor que para el níquel (II), los complejos de cobre octaédrico (II) están sujetos al efecto Jahn-Teller, lo que da como resultado un complejo con una estabilidad adicional.
Otro ejemplo del efecto del radio iónico es el aumento constante en la estabilidad de los complejos con un ligando dado a lo largo de la serie de iones lantánidos trivalentes, un efecto de la bien conocida contracción de los lantánidos.
Aplicaciones
Los valores constantes de estabilidad se explotan en una amplia variedad de aplicaciones. La terapia de quelación se utiliza en el tratamiento de diversas enfermedades relacionadas con el metal, como la sobrecarga de hierro en pacientes con β- talasemia que han recibido transfusiones de sangre. El ligando ideal se une al ion metálico objetivo y no a otros, pero este grado de selectividad es muy difícil de lograr. La droga deferiprona sintética logra selectividad al tener dos átomos donantes de oxígeno, de modo que se une al Fe3+ con preferencia a cualquiera de los otros iones divalentes que están presentes en el cuerpo humano, como Mg2+, Ca 2+ y Zn 2+. El tratamiento del envenenamiento por iones como Pb 2+ y Cd 2+ es mucho más difícil ya que estos son iones divalentes y la selectividad es más difícil de lograr.[30] El exceso de cobre en la enfermedad de Wilson puede eliminarse con penicilamina o trietilen tetramina (TETA). DTPA ha sido aprobado por la Administración de Drogas y Alimentos de EE. UU. para el tratamiento del envenenamiento por plutonio .
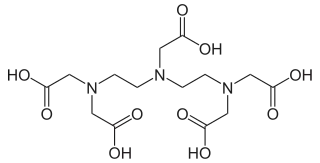
El DTPA también se usa como agente complejante para el gadolinio en la mejora del contraste de MRI. El requisito en este caso es que el complejo sea muy fuerte, ya que Gd 3+ es muy tóxico. La gran constante de estabilidad del ligando octadentado asegura que la concentración de Gd 3+ libre es casi insignificante, ciertamente muy por debajo del umbral de toxicidad.[31] Además, el ligando ocupa solo 8 de los 9 sitios de coordinación en el ion gadolinio. El noveno sitio está ocupado por una molécula de agua que se intercambia rápidamente con el fluido que lo rodea y es este mecanismo el que convierte el complejo paramagnético en un reactivo de contraste.
El EDTA forma complejos tan fuertes con la mayoría de los cationes divalentes que encuentra muchos usos. Por ejemplo, a menudo está presente en el detergente en polvo para actuar como ablandador de agua mediante el secuestro de iones de calcio y magnesio.
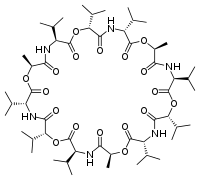
La selectividad de los ligandos macrocíclicos se puede utilizar como base para la construcción de un electrodo selectivo de iones . Por ejemplo, existen electrodos selectivos de potasio que utilizan el antibiótico macrocíclico natural valinomicina .
 |
 |
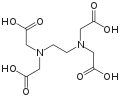 | |
| Deferiprona | Penicilamina | trietilentetramina, TETA | Ácido etilendiaminotetraacético, EDTA |
 |
 |
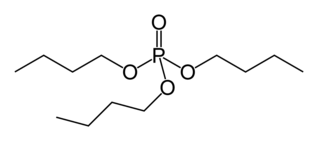 | |
| Ácido dietilentriaminopentaacético, DTPA | Valinomicina | Tri-n-butil fosfato |
Una resina de intercambio iónico , como el chelex 100 , que contiene ligandos quelantes unidos a un polímero, se puede usar en suavizadores de agua y en técnicas de separación cromatográfica. En la extracción con solventes, la formación de complejos eléctricamente neutros permite que los cationes sean extraídos en solventes orgánicos. Por ejemplo , en nuclear de reprocesamiento de combustible de uranio (VI) y el plutonio (VI) se extraen en queroseno como los complejos [MO 2 (TBP) 2 (NO3) 2] (TBP = tri- n -butil fosfato). En la catálisis de transferencia de fase , una sustancia que es insoluble en un disolvente orgánico puede hacerse soluble mediante la adición de un ligando adecuado. Por ejemplo, las oxidaciones de permanganato de potasio se pueden lograr agregando una cantidad catalítica de un éter corona y una pequeña cantidad de disolvente orgánico a la mezcla de reacción acuosa, de modo que la reacción de oxidación ocurra en la fase orgánica.
En todos estos ejemplos, el ligando se elige basándose en las constantes de estabilidad de los complejos formados. Por ejemplo, el TBP se usa en el reprocesamiento de combustible nuclear porque (entre otras razones) forma un complejo lo suficientemente fuerte como para que tenga lugar la extracción con solvente, pero lo suficientemente débil como para que el ácido nítrico destruya el complejo para recuperar el catión uranilo como complejos nitrato . como [UO 2 (NO 3 ) 4 ] 2− de nuevo en la fase acuosa.
Los complejos supramoleculares se mantienen unidos por enlaces de hidrógeno, fuerzas hidrófobas, fuerzas de van der Waals, interacciones π-π y efectos electrostáticos, todos los cuales pueden describirse como enlaces no covalentes . Las aplicaciones incluyen reconocimiento molecular , química huésped-huésped y sensores de aniones.
Una aplicación típica en reconocimiento molecular implicaba la determinación de constantes de formación para complejos formados entre una molécula de urea tripodal sustituida y varios sacáridos .[32] El estudio se llevó a cabo utilizando un disolvente no acuoso y mediciones de desplazamiento químico por RMN . El objetivo era examinar la selectividad con respecto a los sacáridos.
Un ejemplo del uso de complejos supramoleculares en el desarrollo de quimiosensores es el uso de conjuntos de metales de transición para detectar la ATP .[33]
La complejación del anión se puede lograr encapsulando el anión en una jaula adecuada. La selectividad se puede diseñar diseñando la forma de la jaula. Por ejemplo, los aniones de dicarboxilato podrían encapsularse en la cavidad elipsoidal en una gran estructura macrocíclica que contiene dos iones metálicos.[34]
Métodos experimentales
El método desarrollado por Bjerrum sigue siendo el principal método en uso hoy en día, aunque la precisión de las mediciones ha aumentado considerablemente. Más comúnmente, una solución que contiene el ion metálico y el ligando en un medio de alta fuerza iónica se acidifica primero hasta el punto donde el ligando está completamente protonado. Esta solución luego se titula, a menudo por medio de un auto-titulador controlado por computadora, con una solución de base libre de CO2. La concentración o actividad del ion de hidrógeno se controla mediante un electrodo de vidrio. El conjunto de datos utilizado para el cálculo tiene tres componentes: una declaración que define la naturaleza de las especies químicas que estarán presentes, llamado modelo del sistema, detalles sobre las concentraciones de los reactivos utilizados en la titulación y, finalmente, las mediciones experimentales en La forma de titulación y los pares de pH (o emf).
No siempre es posible utilizar un electrodo de vidrio. Si ese es el caso, la titulación puede ser monitoreada por otros tipos de medición. Los espectros de absorbancia , espectros de fluorescencia y espectros de RMN son las alternativas más utilizadas. La práctica actual es tomar mediciones de absorbancia o fluorescencia en un rango de longitudes de onda y ajustar estos datos simultáneamente. También se pueden acoplar varios cambios químicos de RMN.
El modelo químico incluirá valores de las constantes de protonación del ligando, que se habrán determinado en experimentos separados, un valor para log Kw y las estimaciones de las constantes de estabilidad desconocidos de los complejos formados. Estas estimaciones son necesarias porque el cálculo utiliza un algoritmo de mínimos cuadrados no lineal. Las estimaciones se obtienen generalmente por referencia a un sistema químicamente similar. Las bases de datos de constantes de estabilidad[8][9] pueden ser muy útiles para encontrar valores de constantes de estabilidad publicados para complejos relacionados.
En algunos casos simples, los cálculos se pueden hacer en una hoja de cálculo.[35] De lo contrario, los cálculos se realizan con la ayuda de programas informáticos de propósito general. Los programas más utilizados son:
- Datos potenciométricos y/o espectrofotométricos: PSEQUAD[36]
- Datos potenciométricos: HYPERQUAD,[37] BEST[38]
- Datos espectrofotométricos: HypSpec, SQUAD,[39] SPECFIT,[40] [41] ReactLab EQUILIBRIA (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).[42]
- Datos de RMN HypNMR ,[43] WINEQNMR2 Archivado el 14 de julio de 2019 en Wayback Machine. [44]
En bioquímica, las constantes de formación de aductos se pueden obtener a partir de mediciones de calorimetría de titulación isotérmica (ITC). Esta técnica produce tanto la constante de estabilidad como el cambio de entalpia estándar para el equilibrio.[45] Está mayormente limitado, por disponibilidad de software, a complejos de estequiometría 1: 1.
Datos evaluados críticamente
Las siguientes referencias son para revisiones críticas de constantes de estabilidad publicadas para varias clases de ligandos. Todas estas revisiones son publicadas por IUPAC y el texto completo está disponible, sin cargo, en formato pdf.
- etilendiamina (en) [46]
- ácido nitrilotriacético (NTA) [47]
- ácidos aminopolicarboxílicos (complexonas) [48]
- alfa hidroxiácidos y otros ácidos hidroxicarboxílicos [49] [50]
- aminoácidos con cadenas laterales polares [55]
- general[58]
- Especiación química de metales pesados ambientalmente significativos con ligandos inorgánicos. Parte 1: Los sistemas Hg 2+ –Cl - , OH - , CO2−
3, SO2−
4, y PO3−
4.[59] - Especiación química de metales ambientalmente significativas con ligandos inorgánicos Parte 2: Los sistemas acuosos Cu2+ -OH-, Cl-,CO2−
3, SO2−
4, y PO3−
4.PO3−
4 [60] - Especiación química de metales ambientalmente significativas con ligandos inorgánicos Parte 3: Los sistemas Pb 2+ -OH -, Cl -, CO2−
3 <br> CO2−
3 , SO2−
4 , y PO3−
4 [61] - Especiación química de metales ambientalmente significativos con ligandos inorgánicos. Parte 4: Los sistemas Cd 2+ –OH - , Cl - , CO2−
3 <br> CO2−
3 , SO2−
4 , y PO3−
4 [62]
Bases de datos
- La base de datos Ki es una base de datos de dominio público de afinidades de unión (Ki) publicadas de fármacos y compuestos químicos para receptores, transportadores de neurotransmisores, canales iónicos y enzimas.
- BindingDB es una base de datos de dominio público de afinidades de unión medidas, que se centra principalmente en las interacciones de proteínas consideradas dianas de fármacos con moléculas pequeñas similares a fármacos.
Referencias
- Bjerrum, J. (1941). Metal-ammine formation in aqueous solution. Copenhagen: Haase.
- Beck, M. T.; Nagypál, I. (1990). «Chapter 1». Chemistry of Complex Equilibria. Horwood. ISBN 0-85312-143-5.
- Rossotti, F. J. C.; Rossotti, H. (1961). The Determination of Stability Constants. McGraw–Hill.
- Dyrssen, D.; Ingri, N.; Sillen, L. G. (1961). «Pit-mapping - A general approach to Computer refinement of stability constants.». Acta Chem. Scand. 15: 694-696. doi:10.3891/acta.chem.scand.15-0694.
- Ingri, N.; Sillen, L. G. (1964). «High-speed computers as a supplement to graphical methods, IV. An ALGOL version of LETAGROP-VRID». Arkiv för Kemi 23: 97-121.
- Sayce, I. G. (1968). «Computer calculations of equilibrium constantsof species present in mixtures of metal ions and complexing reagents». Talanta 15 (12): 1397-1421. PMID 18960446. doi:10.1016/0039-9140(68)80200-0.
- Sabatini, A.; Vacca, A.; Gans, P. (1974). «MINIQUAD - A general computer program for the computation of Stability constants». Talanta 21 (1): 53-77. PMID 18961420. doi:10.1016/0039-9140(74)80063-9.
- IUPAC SC-Database Archivado el 19 de junio de 2017 en Wayback Machine. Una base de datos completa de datos publicados sobre constantes de equilibrio de complejos metálicos y ligandos
- NIST Standard Reference Database 46 Archivado el 17 de enero de 2009 en Wayback Machine. Constantes de estabilidad de complejos metálicos seleccionadas críticamente
- Pearson, R. G. (1997). Chemical Hardness: Applications from Molecules to Solids. Springer-VCH. ISBN 3-527-29482-1.
- Drago, R. S.; Wong, N.; Bilgrien, C.; Vogel, C. (1987). «E and C parameters from Hammett substituent constants and use of E and C to understand cobalt–carbon bond energies». Inorg. Chem. 26 (1): 9-14. doi:10.1021/ic00248a003.
- Gutmann, V. (1978). The Donor–Acceptor Approach to Molecular Interactions. Springer. ISBN 0-306-31064-3.
- Rossotti, F. J. C. (1960). «The thermodynamics of metal ion complex formation in solution». En Lewis, J., ed. Modern coordination chemistry. New York: Interscience.
- Beck, M. T.; Nagypál, I. (1990). Chemistry of Complex Equilibria. Horwood. ISBN 0-85312-143-5. sections 3.5.1.2, 6.6.1 and 6.6.2
- Rossotti, F. J. C.; Rossotti, H. (1961). «Chapter 2: Activity and Concentration Quotients». The Determination of Stability Constants. McGraw–Hill.
- Gergely, A.; Nagypál, I.; E., Farkas (1974). «A réz(II)-aminosav törzskomplexek vizes oldatában lejátszodó protoncsere-reakciók kinetikájának NMR-vizsgálata» [NMR study of the proton exchange process in aqueous solutions of copper(II)-aminoacid parent complexes]. Magyar Kémiai Folyóirat 80: 545-549.
- «Project: Ionic Strength Corrections for Stability Constants». IUPAC. Archivado desde el original el 29 de octubre de 2008. Consultado el 23 de noviembre de 2008.
- Atkins, P. W.; De Paula, J. (2006). «Section 7.4: The Response of Equilibria to Temperature». Physical Chemistry. Oxford University Press. ISBN 0-19-870072-5.
- Plantilla:Greenwood&Earnshaw p. 910
- Schwarzenbach, G. (1952). «Der Chelateffekt» [The Chelate Effect]. Helv. Chim. Acta 35 (7): 2344-2359. doi:10.1002/hlca.19520350721.
- Cabinness, D. K.; Margerum, D. W. (1969). «Macrocyclic effect on the stability of copper(II) tetramine complexes». J. Am. Chem. Soc. 91 (23): 6540-6541. doi:10.1021/ja01051a091.
- Lindoy, L. F. (1990). «Chapter 6: Thermodynamic considerations». The Chemistry of Macrocyclic Ligand Complexes. Cambridge University Press. ISBN 0-521-40985-3.
- Pedersen, C. J. (1967). «Cyclic polyethers and their complexes with metal salts». J. Am. Chem. Soc. 89 (26): 7017-7036. doi:10.1021/ja01002a035.
- Plantilla:Greenwood&Earnshaw p. 1100, Figure 25.7
- Lundeen, M.; Hugus, Z. Z. (1992). «A calorimetric study of some metal ion complexing equilibria». Thermochim. Acta 196 (1): 93-103. doi:10.1016/0040-6031(92)85009-K.
- Ahrland, S.; Chatt, J.; Davies, N. R. (1958). «The relative affinities of ligand atoms for acceptor molecules and ions». Quart. Rev. 12 (3): 265-276. doi:10.1039/QR9581200265.
- Pearson, R. G. (1963). «Hard and Soft Acids and Bases». J. Am. Chem. Soc. 85 (22): 3533-3539. doi:10.1021/ja00905a001.
- Beck, M. T.; Nagypál, I. (1990). Chemistry of Complex Equilibria. Horwood. p. 354. ISBN 0-85312-143-5.
- Irving, H. M. N. H.; Williams, R. J. P. (1953). «The stability of transition-metal complexes». J. Chem. Soc.: 3192-3210. doi:10.1039/JR9530003192.
- Arena, G.; Contino, A.; Longo, E.; Sciotto, D.; Spoto, G. (2001). «Selective complexation of soft Pb2+ and Hg2+ by a novel allyl functionalized thioamide calix[4]arene in 1,3-alternate conformation: a UV-visible and H-1 NMR spectroscopic investigation». J. Chem. Soc., Perkin Trans. 2 (12): 2287-2291. doi:10.1039/b107025h.
- Runge, V. M.; Scott, S. (1998). Contrast-enhanced Clinical Magnetic Resonance Imaging. University Press of Kentucky. ISBN 0-8131-1944-8.
- Vacca, A.; Nativi, C.; Cacciarini, M.; Pergoli, R.; Roelens, S. (2004). «A New Tripodal Receptor for Molecular Recognition of Monosaccharides. A Paradigm for Assessing Glycoside Binding Affinities and Selectivities by 1H NMR Spectroscopy». J. Am. Chem. Soc. 126 (50): 16456-16465. PMID 15600348. doi:10.1021/ja045813s.
- Marcotte, N.; Taglietti, A. (2003). «Transition-metal-based chemosensing ensembles: ATP sensing in physiological conditions». Supramol. Chem. 15 (7): 617-717. doi:10.1080/10610270310001605205.
- Boiocchi, M.; Bonizzoni, M.; Fabbrizzi, L.; Piovani, G.; Taglietti, A. (2004). «A dimetallic cage with a long ellipsoidal cavity for the fluorescent detection of dicarboxylate anions in water». Angew. Chem. Int. Ed. 43 (29): 3847-3852. PMID 15258953. doi:10.1002/anie.200460036.
- Billo, E. J. (1997). «Chapter 22». Excel for Chemists: A comprehensive guide (2nd edición). Wiley-VCH. ISBN 0-471-18896-4.
- Zekany, L.; Nagypál, I. (1985). «Chapter 8: PSEQUAD: A comprehensive program for the evaluation of potentiometric and/or spectrophotometric equilibrium data using analytical derivatives». En Leggett, ed. Computational methods for the determination of formation constants. Plenum. ISBN 0-306-41957-2.
- Gans, P.; Sabatini, A.; Vacca, A. (1996). «Investigation of equilibria in solution. Determination of equilibrium constants with the HYPERQUAD suite of programs». Talanta 43 (10): 1739-1753. PMID 18966661. doi:10.1016/0039-9140(96)01958-3.
- Martell, A. E.; Motekaitis, R. J. (1992). The determination and use of stability constants. Wiley-VCH.
- Leggett, D. (1985). «Chapter 6: SQUAD: Stability quotients from absorbance data». En Leggett, ed. Computational methods for the determination of formation constants. Plenum. ISBN 0-306-41957-2.
- Gampp, M.; Maeder, M.; Mayer, C. J.; Zuberbühler, A. D. (1985). «Calculation of equilibrium constants from multiwavelength spectroscopic data—I : Mathematical considerations». Talanta 32 (2): 95-101. PMID 18963802. doi:10.1016/0039-9140(85)80035-7.
- Gampp, M.; Maeder, M.; Mayer, C. J.; Zuberbühler, A. D. (1985). «Calculation of equilibrium constants from multiwavelength spectroscopic data—II1: Specfit: two user-friendly programs in basic and standard fortran 77». Talanta (1995) 32 (4): 251-264. PMID 18963840. doi:10.1016/0039-9140(85)80077-1.
- Jplus Consulting Pty Ltd
- Frassineti, C.; Alderighi, L.; Gans, P.; Sabatini, A.; Vacca, A.; Ghelli, S. (2003). «Determination of protonation constants of some fluorinated polyamines by means of 13C NMR data processed by the new computer program HypNMR2000. Protonation sequence in polyamines». Anal. Bioanal. Chem. 376 (7): 1041-1052. PMID 12845401. doi:10.1007/s00216-003-2020-0.
- Hynes, M. J. (1993). «EQNMR: A computer program for the calculation of stability constants from nuclear magnetic resonance chemical shift data». J. Chem. Soc., Dalton Trans. (2): 311-312. doi:10.1039/DT9930000311.
- O'Brien, R.; Ladbury, J. E.; Chowdry, B. Z. (2000). «Chapter 10». En Harding, S. E., ed. Protein-Ligand interactions: hydrodynamics and calorimetry. Oxford University Press. ISBN 0-19-963749-0.
- Paoletti, P. (1984). «Formation of metal complexes with ethylenediamine: a critical survey of equilibrium constants, enthalpy and entropy values». Pure Appl. Chem. 56 (4): 491-522. doi:10.1351/pac198456040491.
- Anderegg, G. (1982). «Critical survey of stability constants of NTA complexes». Pure Appl. Chem. 54 (12): 2693-2758. doi:10.1351/pac198254122693.
- Anderegg, G; Arnaud-Neu, F.; Delgado, R.; Felcman, J.; Popov, K. (2003). «Critical evaluation of stability constants of metal complexes of complexones for biomedical and environmental applications (IUPAC Technical Report)». Pure Appl. Chem. 77 (8): 1445-95. doi:10.1351/pac200577081445.
- Lajunen, L. H. J.; Portanova, R.; Piispanen, J.; Tolazzi, M. (1997). «Critical evaluation of stability constants for alpha-hydroxycarboxylic acid complexes with protons and metal ions and the accompanying enthalpy changes. Part I: Aromatic ortho-hydroxycarboxylic acids (Technical Report)». Pure Appl. Chem. 69 (2): 329-382. doi:10.1351/pac199769020329.
- Portanova, R; Lajunen, L. H. J.; Tolazzi, M.; Piispanen, J. (2003). «Critical evaluation of stability constants for alpha-hydroxycarboxylic acid complexes with protons and metal ions and the accompanying enthalpy changes. Part II. Aliphatic 2-hydroxycarboxylic acids (IUPAC Technical Report)». Pure Appl. Chem. 75 (4): 495-540. doi:10.1351/pac200375040495.
- Arnaud-Neu, F.; Delgado, R.; Chaves, S. (2003). «Critical evaluation of stability constants and thermodynamic functions of metal complexes of crown ethers (IUPAC Technical Report)». Pure Appl. Chem. 75 (1): 71-102. doi:10.1351/pac200375010071.
- Popov, K.; Rönkkömäki, H.; Lajunen, L. H. J. (2001). «Critical evaluation of stability constants of phosphonic acids (IUPAC Technical Report)». Pure Appl. Chem. 73 (11): 1641-1677. doi:10.1351/pac200173101641.
- Popov, K.; Rönkkömäki, H.; Lajunen, L. H. J. (2002). «Errata». Pure Appl. Chem. 74 (11): 2227-2227. doi:10.1351/pac200274112227.
- Sjöberg, S. (1997). «Critical evaluation of stability constants of metal-imidazole and metal-histamine systems (Technical Report)». Pure Appl. Chem. 69 (7): 1549-1570. doi:10.1351/pac199769071549.
- Berthon, G. (1995). «Critical evaluation of the stability constants of metal complexes of amino acids with polar side chains (Technical Report)». Pure Appl. Chem. 67 (7): 1117-1240. doi:10.1351/pac199567071117.
- Smith, R. M.; Martell, A. E.; Chen, Y. (1991). «Critical evaluation of stability constants for nucleotide complexes with protons and metal ions and the accompanying enthalpy changes». Pure Appl. Chem. 63 (7): 1015-1080. doi:10.1351/pac199163071015.
- Stary, J.; Liljenzin, J. O. (1982). «Critical evaluation of equilibrium constants involving acetylacetone and its metal chelates». Pure Appl. Chem. 54 (12): 2557-2592. doi:10.1351/pac198254122557.
- Beck, M. T. (1977). «Critical evaluation of equilibrium constants in solution. Stability constants of metal complexes». Pure Appl. Chem. 49 (1): 127-136. doi:10.1351/pac197749010127.
- Powell, Kipton, J.; Brown, Paul L.; Byrne, Robert H.; Gajda, Tamás; Hefter, Glenn; Sjöberg, Staffan; Wanner, Hans (2005). «Chemical speciation of environmentally significant heavy metals with inorganic ligands. Part 1: The Hg2+–Cl−, OH−, CO2−
3, SO2−
4, and PO3−
4 aqueous systems». Pure Appl. Chem. 77 (4): 739-800. doi:10.1351/pac200577040739. - Powell, Kipton J.; Brown, Paul L.; Byrne, Robert H.; Gajda, Tamás; Hefter, Glenn; Sjöberg, Staffan; Wanner, Hans (2007). «Chemical speciation of environmentally significant metals with inorganic ligands Part 2: The Cu2+–OH−, Cl−, CO2−
3, SO2−
4, and PO3−
4 systems». Pure Appl. Chem. 79 (5): 895-950. doi:10.1351/pac200779050895. - Powell, Kipton J.; Brown, Paul L.; Byrne, Robert H.; Gajda, Tamás; Hefter, Glenn; Leuz, Ann-Kathrin; Sjöberg, Staffan; Wanner, Hans (2009). «Chemical speciation of environmentally significant metals with inorganic ligands Part 3: The Pb2+–OH−, Cl−, CO2−
3, SO2−
4, and PO3−
4 systems». Pure Appl. Chem. 81 (12): 2425-2476. doi:10.1351/PAC-REP-09-03-05. - Powell, Kipton J.; Brown, Paul L.; Byrne, Robert H.; Gajda, Tamás; Hefter, Glenn; Leuz, Ann-Kathrin; Sjöberg, Staffan; Wanner, Hans (2011). «Chemical speciation of environmentally significant metals with inorganic ligands. Part 4: The Cd2+–OH−, Cl−, CO2−
3, SO2−
4, and PO3−
4 systems». Pure Appl. Chem. 83 (5): 1163-1214. doi:10.1351/PAC-REP-10-08-09.
Otras lecturas
Sigel, Roland K. O.; Skilandat, Miriam; Sigel, Astrid; Operschall, Bert P.; Sigel, Helmut (2013). «Chapter 8. Complex formation of cadmium with sugar residues, nucleobases, phosphates, nucleotides and nucleic acids». En Sigel, Astrid, ed. Cadmium: From Toxicology to Essentiality 11. Springer. pp. 191-274. doi:10.1007/978-94-007-5179-8_8.
Sóvágó, Imre; Várnagy, Katalin (2013). «Chapter 9. Cadmium(II) complexes of amino acids and peptides». En Sigel, Astrid, ed. Cadmium: From Toxicology to Essentiality 11. Springer. pp. 275-302. doi:10.1007/978-94-007-5179-8_9.
Yatsimirsky, Konstantin Borisovich; Vasilyev, Vladimir Pavlovich (1960). Instability Constants of Complex Compounds. OUP.
Enlaces externos
- Sitio web de constantes de estabilidad : contiene información sobre programas informáticos, aplicaciones, bases de datos y hardware para titulaciones experimentales.

propane-1%252C3-diol_200.svg.png.webp)