Historia evolutiva de las plantas
La historia evolutiva de las plantas pretende narrar la evolución biológica de las plantas, las cuales se describen en los muy diversos niveles de complejidad, que van desde la aparición de las microalgas unicelulares marinas, pasando por las primeras plantas terrestres como los musgos, luego la aparición de las plantas vasculares como licopodios y helechos, llegando hasta el desarrollo de la mayor complejidad que se observa en las plantas con conos (coníferas) y plantas con flores (angiospermas).[1]
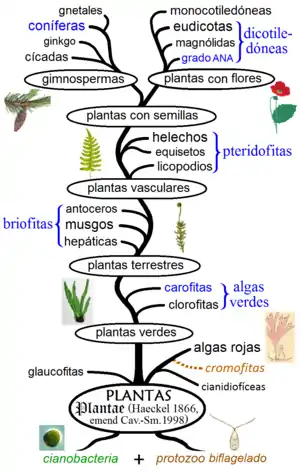
Origen de las algas
El origen de todas las plantas está relacionado con el origen de la primera célula vegetal, la cual constituye a la vez la primera alga, es decir, el primer ser eucariota fotosintético que ha adquirido ya su primer plasto (o cloroplasto). Filogenéticamente, corresponde al clado Archaeplastida (Adl et al. 2005)[2] y taxonómicamente se ha propuesto como reino Plantae (Cavalier-Smith 1998).[3]
Origen simbiogenético

Actualmente se reconoce que el origen de la primera célula vegetal se debe a un proceso llamado simbiogénesis o endosimbiosis seriada, producido de manera similar al origen de la primera célula eucariota (eucariogénesis) y consistió en la fusión biológica entre una cianobacteria (bacteria fotosintética oxigénica) del clado Gloeomargaritales y un protozoo (protista heterótrofo) biflagelado del clado Corticata.
Este proceso constituye una endosimbiosis primaria, en donde el protozoo engloba a la cianobacteria gradualmente desde una relación simbiótica mutualista hasta una obligada con integración de la maquinaria celular. Esto se demostró sobre la base de la similitud genética y ultraestructural entre plastos y cianobacterias, en donde la cianobacteria sufre una drástica reducción de su genoma con pérdida y/o transferencia de genes hacia el núcleo celular.[4]
Historia

El postulado más antiguo sobre el origen de las plantas es de 1883, cuando el botánico francés Andreas Schimper, propuso que la capacidad fotosintética de las células vegetales podría provenir de cianobacterias presentes en la naturaleza. En 1904 Ernst Haeckel sugirió al observar los cloroplastos, que las plantas debían haber evolucionado por simbiosis entre una célula verde con otra célula fagótrofa no-verde.[5] En 1909, el ruso Konstantin Mereschkowski presentó la hipótesis según la cual el origen de los cloroplastos tendría su origen en procesos simbióticos y acuñó el término simbiogénesis.[6] Finalmente se difundió la teoría de la endosimbiosis seriada de Lynn Margulis (1967) y F.J.R. Taylor (1974).[7]
Evidencia
Las teorías evolutivas sobre el origen simbiogenético vegetal tienen el respaldo en la similitud entre cianobacterias y plastos. En glaucofitas, cuyos plastos se denominan cianelas, aún se observan homologías a nivel de las membranas por la presencia de galactolípidos, proteínas y una pared típicamente bacteriana de peptidoglicano. El ADN circular es semejante al procariota y se han detectado genes cianobacterianos tanto en el plasto como en el núcleo. Los ribosomas son de tamaño procariota: 70S. El plasto es sensible a antibióticos como estreptomicina y kanamicina. Hay similitud en los mecanismos de los fotosistemas (I y II), presencia de membranas tilacoides con pigmentos fotosintéticos cianobacterianos como clorofila y caroteno, además de presencia de ficobilisomas en glaucofitas y rodofitas.[4]
Antigüedad
Se estima que las primeras algas (Archaeplastida) serían del Paleoproterozoico, con algo más de 2.100-1.900 Ma (millones de años) y las algas rojas (Rhodophytina) se diversificaron en los grupos actuales hace unos 1.800 Ma. Los fósiles de alga multicelular más antiguo son (Rafatazmia y Ramathallus), con unos 1.600 Ma y la diversificación de las algas verdes (Chlorophyta, Streptophyta) en sus subgrupos actuales tiene unos 1.600 Ma iniciando el Mesoproterozoico.[8]
Evolución de las algas

Uno de los factores más importantes que gravitan en la evolución y diversificación de las algas está en la influencia del medio ambiente. Las algas rodofitas se dividieron en dos grupos muy antiguos: las cianidiofitas por un lado, que son algas unicelulares de color verde cian que han sobrevivido en ambientes termoácidos (acidez de pH 0,05 a 3 y temperaturas de casi 56 °C)[9] donde normalmente solo se encuentran organismos procariotas extremófilos; y por otro lado, las algas rojas (clado Rhodophytina), las cuales desarrollaron los rodoplastos con pigmentos rojos, lo que favoreció la absorción de la luz azul, permitiendo a las algas rojas habitar hasta unos 268m de profundidad y con tan solo 0.0005% de la luz solar.[10]

A partir de las algas rojas y de su interacción con otros protistas, apareció un nuevo tipo de alga: Nuevamente la simbiogénesis actúa como un importante factor de la evolución, pues las algas cromofitas (Chromista) se originaron por una endosimbiosis secundaria entre un protista biflagelado y un alga roja, aunque también es posible que fueran varios eventos endosimbióticos independientes. Por esta razón las algas criptofitas, haptofitas y ocrofitas (estas últimas conocidas como algas heterokontas como las feofíceas) presentan sus plastos rodeados por cuatro membranas y cuentan con clorofilas a y c. Otras endosimbiosis secundarias, terciarias y alguna primaria, dieron lugar a más grupos de algas. Estos nuevos tipo de alga no se clasifican dentro del reino Plantae.

Las algas verdes, por el tipo de pigmentación que le da las clorofilas a y b, requieren buena iluminación, por lo que se extendieron ampliamente en las aguas superficiales; mientras las clorofitas se expandieron principalmente en los ecosistemas marinos, las carofitas lo hicieron en los de agua dulce. Las algas verdes unicelulares fueron dominantes del fitoplancton del Paleozoico, como lo demuestran los fósiles del tipo de las prasinofitas. Durante el Mesozoico, las algas verdes marinas fueron decreciendo paulatinamente en favor de las algas cromofitas (que contienen rodoplastos) tales como cocolitóforos, diatomeas y dinoflagelados.[4] La presencia de algas verdes carofitas en los ecosistemas de agua dulce, condujo a la aparición y posterior colonización de todos los continentes por parte de las plantas terrestres.
Filogenia plastidial
Si bien aún no está bien consensuada la filogenia de las algas, un estudio reciente (2015) basado en el genoma plastidial[11] y tomando en cuenta la distribución de los principales pigmentos,[12][13] se obtiene el siguiente resultado:
| Archaeplastida, primer alga (clorofila a) |
| ||||||||||||||||||||||||||||||||||||||||||||||||
Este cladograma nos permite observar que a pesar de que las algas son un grupo polifilético de acuerdo con su genoma nuclear, partiendo del genoma plastidial vemos por el contrario que todas las algas y plantas están relacionadas. Archaeplastida (etimológicamente, el antiguo plasto) implica el origen de la célula vegetal, contiene clorofila a y caroteno, pigmentos de origen cianobacteriano que son universales, pues se presentan en todas las algas y plantas. La clorofila b aparece en el clado Chloroplastida (= plastos verdes, sinónimo de Viridiplantae), por lo que se presenta en los cloroplastos de algas verdes y plantas terrestres. Las ficobiliproteínas son de origen cianobacteriano y se conservaron en rodofitas y glaucofitas.
Endosimbiosis seriada
Las clorofilas c (variedades c1 y c2) aparecen en el plasto precursor de las cromofitas (algas cromistas). Las primeras algas derivadas serían las criptofitas, las cuales se habrían originado por una endosimbiosis secundaria con un alga roja: el pigmento rojo ficoeritrina y la r-ficocianina son propias de los rodoplastos de las algas rojas y criptofitas.[14] Por otro lado, las algas haptofitas y ocrofitas se habrían originado por endosimbiosis ulteriores a partir de una criptofita,[15] haptofitas y ocrofitas acomparten la presencia de los pigmentos carotenoides fucoxantina y diatoxantina, también clorofila c3 y ambos grupos tienen afinidades en la estructura de los tilacoides.[16]
Sucesivos eventos endosimbióticos produjeron más grupos de algas: Las algas Chromerida son alveoladas que se habrían originado por endosimbiosis terciaria con una microalga ocrofita, mientras que Euglenophyceae (Euglenozoa) y Chlorarachniophyta (Cercozoa) habrían aparecido por endosimbiosis secundarias independientes con clorofitas. Por otro lado, los dinoflagelados fotosintéticos tienen una historia evolutiva más compleja y más reciente, pues varios de ellos se originaron por endosimbiosis subsiguientes con microalgas clorofitas, haptofitas, criptofitas y ocrofitas tales como diatomeas y silicoflagelados.
Multicelularidad
La evolución de formas multicelulares ocurrió en varias ocasiones, tal como se puede observar en algas rojas, pardas, clorofitas y carofitas. Sin embargo, es posible que esto ocurriera en múltiples casos más, debido a que hay grupos que poseen tanto formas unicelulares como multicelulares, tal como se observa en tres subclados de Chlorophytina (Ulvophyceae, Chlorophyceae y Trebouxiophyceae). También es multicelular un grupo de prasinofitas: las Palmophyllales.
En Streptophyta hay dos algas carofitas basales que son unicelulares: Mesostigma y Chlorokybus, el resto de carofitas y las plantas terrestres forman el clado sin nombre de las estreptofitas multicelulares. Esta multicelularidad es gradual en su complejidad; en Klebsormidiales hay filamentos simples, en las algas conjugadas (Zygnematophyceae) los filamentos son ramificados pero también hay unicelulares, luego aparecen Coleochaetales presentando tejido parenquimático, en Charales se desarrollan macroalgas y finalmente en Embryophyta aparecen las primeras plantas terrestres.

 Historia evolutiva morfológica de las algas verdes. |
En las algas rojas, la multicelularidad se produce en tres grupos: Stylonematophyceae, Compsopogonophyceae y en el clado de la eurrodofitas, el cual incluye a las clases Bangiophyceae y Florideophyceae.
Entre las algas cromistas hay un solo grupo multicelular: Phaeophyceae, que son ocrofitas conocidas como algas pardas o feofíceas, de gran desarrollo y diferenciación tisular.
Colonización de la tierra
Las plantas terrestres (Embryophyta) aparecieron como descendientes de algas verdes multicelulares de agua dulce (de Charophyta), y al poblar la tierra marcaron el hito más importante de la evolución y la diversidad biológica terrestre. La presencia de esporas constituye la evidencia fósil que nos señala que estas plantas colonizaron la tierra durante el Ordovícico Medio,[17] específicamente en la etapa temprana Dapingiense hace unos 472 Ma (millones de años) y se inició en la parte occidental del continente Gondwana.[18] Estas esporas fósiles tienen afinidades a las esporas de las actuales hepáticas.[19]
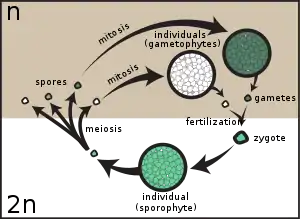
Evolutivamente se produjeron varios cambios, especialmente a nivel reproductivo. Aparece la alternancia de generaciones, es decir, de un ancestro haploide, se origina un ciclo de vida haplo-diploide. El alga haploide se convierte en el gametófito multicelular (fase dominante, como todavía hoy se puede apreciar en las briofitas) y para la fase diploide aparece el esporófito multicelular, el cual pasa primero por una etapa de embrión (de ahí el nombre Embryophyta), que se caracteriza por estar protegido por el gametofito donde se produjo la ovocélula, y donde se nutre a través de un tejido de transferencia llamado placenta. El huevo, y después de la fecundación, el embrión, están protegidos por una estructura multicelular del gametofito llamada arquegonio. Los anterozoides (esperma) provienen de una estructura multicelular del gametofito: el anteridio.
Adaptaciones para la vida terrestre

Para adaptarse a un medio fuera del agua, las embriofitas desarrollaron respuestas a la desecación como la cutícula que protege al esporófito y de la esporopolenina que forma una gruesa pared en la espora. Como protección contra la radiación ultravioleta, que es más intensa fuera del agua, se desarrollaron los flavonoides.
El contacto con el aire se logra a través de pequeños poros en la epidermis llamados estomas. Para sobrellevar la alta concentración de oxígeno atmosférico (mucho más alta que en el agua), ya que demasiado oxígeno inhibe la fijación de dióxido de carbono, el metabolismo incluye un sistema de oxidación del glicolato (fotorrespiración).
Se ha encontrado que como parte de la adaptación al entorno terrestre, se desarrolló una simbiosis micorriza con hongos glomales[20] desde hace 460 millones de años[21] tal como se observa en briofitas primitivas como las hepáticas, lo que facilitó el aprovechamiento de nutrientes y minerales, así como resistencia al estrés mineral del suelo.[22]
Evolución de las briofitas
Las briofitas o briófitos (Bryophyta sensu lato) constituyen el primer grupo de plantas terrestres que se diversificó y aún hoy son las plantas más diversas después de las angiospermas. Las briofitas son un grupo compuesto a su vez por tres clados: hepáticas, musgos y antoceros, los cuales se caracterizan por tener sencillez estructural, esporófito monosporangiado muy simple y siempre unido al gametofito. Al igual que las demás plantas terrestres, hay clara diferenciación histológica, y aunque se considera que son plantas no vasculares, en realidad es frecuente encontrar un incipiente sistema conductor de los nutrientes, así como tejidos aislantes y de sostén. Tradicionalmente las briofitas se consideran un grupo parafilético desde un punto de vista morfológico, sin embargo la mayoría de los análisis moleculares apoyan su monofilia.[23][24][25]

Las briofitas son plantas pequeñas debido a la ausencia de lignina, pues la falta de tejido leñoso limita el crecimiento y no se desarrollan verdaderas hojas, tallo ni raíces, sino simples y análogos filidios, caulidios y rizoides. Los mecanismos de regulación del agua interna son limitados, por lo que dependen de la disponibilidad hídrica del exterior, hidratándose y desecándose con rapidez. En compensación, son reviviscentes, siendo capaces de permanecer en estado de latencia en condiciones de deshidratación, esperando la llegada del agua para la recuperación de sus funciones metabólicas.[26]

Plantas prevasculares
Previamente al desarrollo del tejido vascular, se desarrolló la ramificación de los esporangios en el clado llamado Polysporangiophyta. Esto implica que hubo algunos grupos de plantas de desarrollo intermedio entre las briofitas y las traqueofitas, que han sido denominadas protraqueofitas como Aglaophyton, Caia, Horneophyton y Tortilicaulis.
Vascularización

Aunque no existe un consenso sobre el origen monofilético de las plantas vasculares la bioquímica (presencia de clorofila a y celulosa en las paredes celulares), histología (desarrollo de traqueidas) y ciclo de vida de todas las plantas vasculares actuales (con una alternancia de generaciones y una predominancia del esporófito ) parecen avalar esta posibilidad. Se conoce la presencia de meiosporas triletas con paredes delgadas propias de plantas vasculares y de restos vegetales aislados en estratos del Cámbrico Inferior.[27] Así Aldanophyton, también del Cámbrico, muestra una anatomía similar a licopodios con micrófilos insertados helicoidalmente que podrían sugerir la presencia de una organización compleja de un cilindro vascular que no se ha conservado. Junto a esto, otros restos fraccionarios y esporas triletas del Ordovícico y Silúrico parecen sugerir un origen muy temprano del grupo sin aportar pruebas definitivas.[28]

Los primeros fósiles vegetales terrestres que presentan una organización vascular aparecen en el Silúrico superior. Los vegetales vasculares del tránsito del Silúrico al Devónico muestran una anatomía muy simple. Así, Cooksonia con ejes verticales cilíndricos ramificados dicótoma e isótomamente, esporangios terminales y estelas de tipo protostela fija la edad mínima de formación del grupo en los 420 millones de años. El género Cooksonia parece diversificarse y expandirse durante el Devónico inferior y, sobre la base de la morfología de sus esporangios, se conocen hasta seis especies. El género alcanza el Emsiense (Devónico inferior) donde coincide con Steganotheca y Uskiella que también presentan una anatomía y un sistema vascular simples. Los restos vegetales correspondientes a Baragwanathia muestran una anatomía mucho más compleja con protostela estelada, traqueidas anulares y micrófilos insertados helicoidalente en el tallo. Esta especie fue datada inicialmente en el Silúrico superior aunque posteriores estudios parecen indicar que es posterior, del Devónico inferior.[28]
En los ecosistemas fluviales y lacustres del Devónico inferior (Pragiense y Emsiense) evolucionan los tres grupos de plantas vasculares, Polysporangiophyta (Horneophytopsida y Aglaophyton), Tracheophyta (Rhyniophyta, Trimerophytophyta) y, en este grupo posiblemente, el antecesor directo de Eutracheophyta.[27] Así, algunas investigaciones indican que un representante del clado Rhyniopsida (Huia, Huvenia, Renalia, Rhynia, Yunia...) puede ser el antecesor de las traqueófitas modernas,[29] aunque es posible que sean antecesores de Equisetales, que poseen su mismo tipo de traqueidas.[30]
Las plantas vasculares dejaron un importante registro fósil, y sus relaciones filogenéticas aproximadas puede resumirse en el siguiente diagrama:[31]
| Embryophyta |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Los primeros bosques
A lo largo del Devónico Medio las plantas vasculares sufren una fuerte diversificación y, gracias a las ventajas evolutivas que les proporciona la presencia de un cilindro vascular, adquieren mayor porte y envergadura formando los primeros bosques. Así, los ecosistemas terrestres devónicos están dominados por grandes vegetales pertenecientes a cinco grupos de traqueofitas: Lycopsida (Lycophyta), Pseudosporochnales (Cladoxylopsida), Sphenopsida y Filicopsida (Monilophyta), y Progymnosperma (Lignophyta),[27] todas ellas desarrolladas en zonas húmedas cercanas a lagos y pantanos.

La clase Cladoxylopsida gracias al desarrollo de una estela radial muy compleja es el primer grupo en contar con representantes arbóreos, agrupados todos ellos dentro del orden Pseudosporchnales pues parece ser que los miembros de Iridopteridales eran herbáceos. Pseudosporochnus y Wattieza, del Eifeliense y Emsiense, son las especies mejor conocidas del grupo. Muestran un gran tronco erecto de hasta 13 cm de diámetro con un bulbo basal y una corona de ramificaciones muy amplia.[32] La altura máxima conocida para estos vegetales excede los 8 metros de Wattieza.[27] Una anatomía similar poseen los representantes arbóreos de Progymnosperma, especialmente Archaeopteris, la especie mejor conocida.[33] Sphenopsida, a través del clado Equisetales, Filicopsida y Lycopsida, fundamentalmente el orden Lepidodendrales (Lepidodendron y Sigillaria), desarrollarán también grandes portes a lo largo del Devónico medio y final aunque sus representantes de mayor tamaño se aparecerán a principios del Carbonífero.[34]
Las plantas con semillas

Las plantas con semillas (Spermatophyta) provienen de plantas leñosas llamadas progimnospermas, las cuales evolucionaron la semilla como un medio de propagación en el Devónico Superior. La adquisición de semillas representó la cúspide de la adaptación al medio terrestre en el reino vegetal, ya no solo predominó el esporófito , sino que el gametófito se ha reducido hasta llegar a ser una estructura dependiente encerrada en el arquegonio del esporófito. Los anterozoides de las plantas anteriores (frecuentemente flagelados), fueron sustituidos por el proceso de polinización, la cual fue lo que permitió que las plantas se independizaran del agua como vehículo de fecundación. Asimismo, el cigoto y el embrión en desarrollo (que se convertirá en el nuevo esporófito) dejaron de depender del agua, pues la semilla aloja al embrión dentro de una cubierta dura y protectora.
Las primeras espermatofitas son conocidas como "helechos con semilla" por sus semejanza con los helechos verdaderos, de ahí su nombre Pteridospermae. La abundancia de estos fósiles provenientes del Carbonífero hizo que en el siglo XIX se conociera este periodo como la "era de los helechos", cuando en realidad debería llamársele más propiamente la "era de las pteridospermas".
En el Carbonífero, las plantas con semillas se diversifican en el clado de las actuales gimnospermas y las plantas con flores (Anthophyta). Entre las gimnospermas, las más antiguas son coníferas como Cordaitales y en el Pérmico aparecen claramente ginkgos, cícadas y gnetales.
Angiospermas
.jpg.webp)
Las angiospermas aparecen mucho después, iniciando el Cretácico, como descendientes de plantas con flores del clado Anthophyta. Constituyen actualmente la forma de vida vegetal dominante y su éxito evolutivo está principalmente en el desarrollo de flores y frutos. La flor es un vehículo efectivo de la polinización debido al color, olor y néctar atractivos a insectos y otros animales, por lo que no dependen del viento, el cual es débil en los climas tropicales. Igualmente el fruto es un atractivo para los animales que contribuirán en la dispersión de las semillas.
Los cuatro grupos principales de angiospermas vienen del Cretácico Inferior y los fósiles más antiguos serían magnólidas de hace unos 140 millones de años,[35] Nymphaeales (grado ANITA) de hace 120 Ma,[36] y fósiles de eudicotiledóneas y monocotiledóneas que son también de esta misma época.
Véase también
Referencias
- Monroe, James et al. 2008. Geología, dinámica y evolución de la Tierra. 4a ed. España
- Adl et al. 2005, The new higher level classification of eukaryotes with emphasis on the taxonomy of protists. J. Eukaryot. Microbiol., 52:399–451.
- T. Cavalier-Smith. 1998. A revised six-kingdom system of life. Biological Reviews, 73 : 203-266.
- Olivier De Clerck et al. 2012 Diversity and Evolution of Algae Primary Endosymbiosis. Advances in Botanical Research, Volume 64, Elsevier Ltd. ISSN 0065-2296, http://dx.doi.org/10.1016/B978-0-12-391499-6.00002-5
- Ernst Haeckel, Die Lebenswunder, Stuttgart, 1904
- Margulis, Lynn (2002). Planeta simbiótico. Editorial Debate. p. 35.
- Taylor, F.J.R. 1974, Implications and extensions of the Serial Endosymbiosis Theory of the origin of eukaryotes Taxon 23 (2/3): 229-258.
- Jürgen F. H. Strassert, Iker Irisarri, Tom A. Williams & Fabien Burki (2021). A molecular timescale for eukaryote evolution with implications for the origin of red algal-derived plastids.
- Guillaume Barbier et al 2005. Comparative Genomics of Two Closely Related Unicellular Thermo-Acidophilic Red Algae, Galdieria sulphuraria and Cyanidioschyzon merolae. Plant Physiol. 2005 Feb; 137(2): 460–474. doi: 10.1104/pp.104.051169
- Wise, R.R. 2006. The diversity of plastid form and function. In: Wise, R.R. and J.K. Hoober. The Structure and Function of Plastids, Springer, Amsterdam, pp. 3-26.
- Tereza Ševčíková et al 2015. Updating algal evolutionary relationships through plastid genome sequencing. Scientific Reports 5, Article number: 10134 (2015) doi:10.1038/srep10134
- S. W. Jeffrey 1976. The occurrence of chlorophyll c1 and c2 in algae Journal of Phycology. Volume 12, Issue 3, pages 349–354
- Shinichi Takaichi 2011. Carotenoids in Algae: Distributions, Biosyntheses and Functions. Mar Drugs. 2011; 9(6): 1101–1118.
- Leonel Pereira et al 2015. Marine Algae: Biodiversity, Taxonomy, Environmental Assessment, and Biotechnology. University of Coimbra
- John W. Stiller et al. 2014, The evolution of photosynthesis in chromist algae through serial endosymbioses. Nature Communications 5, Article number: 5764 doi:10.1038/ncomms6764
- Robert A. Andersen 2003-2004 Biology and systematics of heterokont and haptophyte algae. Archivado el 11 de abril de 2016 en Wayback Machine. Am. J. Bot. October 2004 vol. 91 no. 10 1508-1522
- Jane Gray et al 1985. The Microfossil Record of Early Land Plants. Royal Society Publishing. April 1985 Volume: 309 Issue: 1138, DOI: 10.1098/rstb.1985.0077
- Rubinstein CV et al 2010 Early Middle Ordovician evidence for land plants in Argentina (eastern Gondwana). New Phytol. 2010 Oct;188(2):365-9. doi: 10.1111/j.1469-8137.2010.03433.x. Epub 2010 Aug 20.
- Wellman, Charles et al 2003, Fragments of the earliest land plants. Nature, Volume 425, Issue 6955, pp. 282-285
- Redecker, D., Kodner, R., y Graham, L. E. 2000. Glomalean fungi from the Ordovician. Science 289: 1920-1921.
- George R. McGhee Jr 2013, When the Invasion of Land Failed: The Legacy of the Devonian Extinctions. Columbia UP, NY
- Köttke, I, y Nebel, M. 2005. The evolution of mycorrhiza-like associations in liverworts: An update. New Phytol. 167: 330-334.
- Cox, Cymon J. (2018). «Land Plant Molecular Phylogenetics: A Review with Comments on Evaluating Incongruence Among Phylogenies». Critical Reviews in Plant Sciences 37 (2–3): 113-127. S2CID 92198979. doi:10.1080/07352689.2018.1482443. hdl:10400.1/14557.
- Harris, Brogan J. (2020). «Phylogenomic Evidence for the Monophyly of Bryophytes and the Reductive Evolution of Stomata». Current Biology 30 (11): P2201-2012.E2. PMID 32302587. S2CID 215798377. doi:10.1016/j.cub.2020.03.048. hdl:1983/fbf3f371-8085-4e76-9342-e3b326e69edd.
- de Sousa, Filipe (2019). «Nuclear protein phylogenies support the monophyly of the three bryophyte groups (Bryophyta Schimp.)». New Phytologist 222 (1): 565-575. PMID 30411803. doi:10.1111/nph.15587. hdl:1983/0b471d7e-ce54-4681-b791-1da305d9e53b.
- Belén Estébanez et al. 2011, Briófitos: una aproximación a las plantas terrestres más sencillas. Archivado el 18 de abril de 2016 en Wayback Machine. Memorias R. Soc. Esp. Hist. Nat., 2ª ép., 9, 2011
- Kathy Willis, Jennifer McElwain (2014). The Evolution of Plants. OUP Oxford.
- Wilson Nichols Stewart, Gar W. Rothwell (1993). Paleobotany and the Evolution of Plants. Cambridge University Press.
- Vida: La Ciencia De La Biología. Editorial Médica Panamericana. 2009. p. 619.
- Wilson Nichols Stewart et al. (1993). Paleobotany and the evolution of plants. Cambridge University Press.
- Kenrick, Paul & Crane, Peter R. (1997), The Origin and Early Diversification of Land Plants: a Cladistic Study, Washington, D.C.: Smithsonian Institution Press, ISBN 978-1-56098-730-7
- Engler, Adolf (2009). Syllabus der Pflanzenfamilien. Borntraeger. pp. p.319.
- Chester A. Arnold (2013). An Introduction to Paleobotany. Read Books Ltd.
- Chester A. Arnold (2013). An Introduction to Paleobotany. Read Books Ltd.
- Abominable Mystery: The Origin of Flowers and the History of Pollination. Archivado el 15 de octubre de 2016 en Wayback Machine. University of Marylan 2014
- Leonard B. Thien et al. 2008, Pollination biology of basal angiosperms (ANITA grade) Am. J. Bot. January 2009 vol. 96 no. 1 166-182
.jpg.webp)

