Metanol
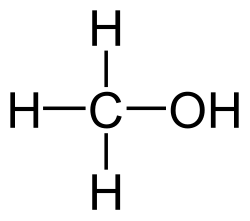
El compuesto químico metanol, también conocido como alcohol de madera, alcohol metílico o raramente alcohol de quemar, es el alcohol más sencillo. A temperatura ambiente se presenta como un líquido ligero (de baja densidad), incoloro, inflamable y tóxico que se emplea como anticongelante, disolvente y combustible. Su fórmula química es CH3OH (CH4O).
| Metanol | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Metanol | ||
| General | ||
| Otros nombres |
Carbinol Alcohol metílico Alcohol de madera Espíritu de madera Hidróxido de metano Monóxido de metano | |
| Fórmula semidesarrollada | CH3-OH | |
| Fórmula estructural | Ver imagen. | |
| Fórmula molecular | CH4O | |
| Identificadores | ||
| Número CAS | 67-56-1[1] | |
| Número RTECS | PC1400000 | |
| ChEBI | 17790 | |
| ChEMBL | CHEMBL14688 | |
| ChemSpider | 864 | |
| PubChem | 887 | |
| UNII | Y4S76JWI15 | |
| KEGG | C00132 D02309, C00132 | |
| Propiedades físicas | ||
| Apariencia | Incoloro | |
| Densidad | 791,8 kg/m³; 0,7918 g/cm³ | |
| Masa molar | 3204 g/mol | |
| Punto de fusión | 176 K (−97 °C) | |
| Punto de ebullición | 337,8 K (65 °C) | |
| Presión crítica | 81±1 atm | |
| Viscosidad | 0,56 e-3 a 15 °C. | |
| Propiedades químicas | ||
| Acidez | ~ 15,5 pKa | |
| Solubilidad en agua | totalmente miscible. | |
| Producto de solubilidad | n/d | |
| Momento dipolar | 1,69 D | |
| Termoquímica | ||
| ΔfH0gas | -205±10 kJ/mol | |
| ΔfH0líquido | -238.4 kJ/mol | |
| S0líquido, 1 bar | 127.19 J·mol–1·K–1 | |
| Peligrosidad | ||
| SGA |
   | |
| Punto de inflamabilidad | 285 K (12 °C) | |
| NFPA 704 |
3
3
0
| |
| Temperatura de autoignición | 658 K (385 °C) | |
| Frases S | S1/2, S7, S16, S36/37, S45 | |
| Riesgos | ||
| Ingestión | Puede producir ceguera, sordera y muerte | |
| Inhalación | Por evaporación de esta sustancia a 20 °C, puede alcanzar rápidamente una concentración nociva en el aire. | |
| Piel | Puede producir dermatitis. | |
| Ojos | Irritación. | |
| Compuestos relacionados | ||
| Alcoholes | Etanol | |
| Otros | Metanal | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El metanol está formado por un grupo metilo unido a un grupo hidroxilo polar. Con una producción anual de más de 20 millones de toneladas, se utiliza como precursor de otros productos químicos básicos, como formaldehído, ácido acético, metil ter-butil éterr, benzoato de metilo, anisol, peroxiácidos, así como una serie de productos químicos más especializados.[2]
Presencia
Pequeñas cantidades de metanol están presentes en personas normales y sanas. Un estudio encontró una media de 4,5 partes por millón en el aliento exhalado de sujetos de prueba. [3] El metanol endógeno medio en humanos de 0,45 g/d puede metabolizarse a partir de la pectina que se encuentra en la fruta; un kilogramo de manzana produce hasta 1. 4 g de pectina (0,6 g de metanol.)[4]
El metanol es producido por bacterias anaeróbicas y fitoplancton.[5][6]
Medio interestelar
El metanol también se encuentra en cantidades abundantes en las regiones de formación estelar del espacio y se utiliza en astronomía como marcador de dichas regiones. Se detecta a través de sus líneas de emisión espectral.[7]
En 2006, astrónomos que utilizaban el conjunto MERLIN de radiotelescopios del Observatorio de Jodrell Bank descubrieron una gran nube de metanol en el espacio a 463 terámetros (288.000 millones de millas) de distancia.[8][9] En 2016, los astrónomos detectaron metanol en un disco de formación planetaria alrededor de la joven estrella TW Hydrae utilizando el radiotelescopio Atacama Large Millimeter Array. [10]
Historia
Fue utilizado en el proceso de embalsamamiento, pero los antiguos egipcios utilizaron una mezcla de sustancias, incluyendo metanol, que obtenían mediante la pirólisis de la madera. Sin embargo, en 1661 Robert Boyle aisló el metanol puro, cuando lo produjo a través de la destilación de madera de boj. Más tarde llegó a ser conocido como el espíritu piroxílico. En 1834, los químicos franceses Jean-Baptiste Dumas y Eugene Peligot determinaron su composición elemental. Ellos también introdujeron la palabra metileno en la química orgánica, formada a partir de la palabra griega methy= "vino" + hȳlē = madera (grupo de árboles). La intención era que significara «alcohol preparado a partir de madera», pero tiene errores de lengua griega: se usa mal la palabra "madera", y un orden erróneo de las palabras debido a la influencia del idioma francés. El término "metilo" fue creado alrededor de 1840 por abreviatura de metileno, y después fue utilizado para describir el alcohol metílico; expresión que la Conferencia Internacional sobre Nomenclatura Química redujo a «metanol» en 1892.
En 1923 los químicos alemanes Alwin Mittasch y Pier Mathias, que trabajan para BASF, desarrollan un medio para convertir un gas de síntesis (una mezcla de monóxido de carbono, dióxido de carbono e hidrógeno) en metanol. La patente fue presentada el 12 de enero de 1926 (referencia no. 1569775). Este proceso utiliza un catalizador de óxido de cromo y manganeso, y requiere de presiones extremadamente elevadas que van desde 50 hasta 220 atm y temperaturas de hasta 450 °C. La producción moderna de metanol es más eficiente: se utilizan catalizadores (comúnmente cobre) capaces de funcionar a presiones más bajas. El metanol moderno de baja presión (LPM) fue desarrollado por ICI a finales de 1960 con la tecnología actualmente propiedad de Johnson Matthey, que es un licenciante líder de tecnología de metanol.
El uso de metanol como combustible de automoción recibió atención durante las crisis del petróleo de la década de 1970 debido a su disponibilidad, bajo coste, y los beneficios medioambientales. A mediados de la década de 1990, más de 20 000 "vehículos de combustible flexible" (VCF) capaces de funcionar con metanol o gasolina se vendieron en Estados Unidos. Además, durante gran parte de la década de 1980 y principios de los 1990, en los combustibles de gasolina que se venden en Europa se mezclan pequeños porcentajes de metanol. Los fabricantes de automóviles dejaron de construir VCFs a metanol a finales de los años 1990, cambiando su atención a los vehículos propulsados por etanol. Aunque el programa de VCF a metanol fue un éxito técnico, el aumento del precio del metanol a mediados y finales de la década de 1990 durante un período de caída en precios de la gasolina disminuyó el interés en el metanol como combustible.
Propiedades químicas
El metanol es el único alcohol que tiene tres hidrógenos en la base de su hidroxilo (alcohol unitario o carbinol). Es el alcohol con el número de oxidación de su carbono más bajo (Nox = -2). Con oxidantes fuertes el metanol puede ser oxidado hasta anhídrido carbónico. Con oxidantes más moderados como el reactivo de Swern, reactivo de Pfitzner-Moffatt o Reactivo de Collins se produce formaldehído.
Cuando el metanol se trata con cloruro de hidrógeno se forma cloruro de metilo:
A escala industrial la oxidación se lleva a cabo con oxígeno del aire y un catalizador de cobre. El único producto posible de la deshidratación de metanol[2] es el éter dimetílico[11] 2 CH3OH → (CH3)2O + H2O[12]
Cuando se trata un ácido carboxílico no funcionalizado en su estructura (por ejemplo, sin insaturaciones alifáticas, sin halógenos, alcoholes o carbonilos) y se emplea metanol y ácido sulfúrico, se forma el éster metílico.
Aplicaciones
El metanol, como todo alcohol, tiene varios usos. Es un disolvente industrial y se emplea como materia prima en la fabricación de formaldehído. El metanol también se emplea como anticongelante en vehículos, combustible de estufetas de acampada, solvente de tintas, tintes, resinas, adhesivos, biocombustibles y aspartame. El metanol puede ser también añadido al etanol para hacer que este no sea apto para el consumo humano (el metanol es altamente tóxico) y para vehículos de modelismo con motores de combustión interna.
Producción de formaldehído, ácido acético, metil tert-éter butílico
El metanol se convierte principalmente en formaldehído, que se utiliza ampliamente en muchas áreas, especialmente polímeros. La conversión conlleva una oxidación:
- 2 CH
3OH + O
2 → 2 CH
2O + 2 H
2O
El ácido acético puede producirse a partir del metanol.
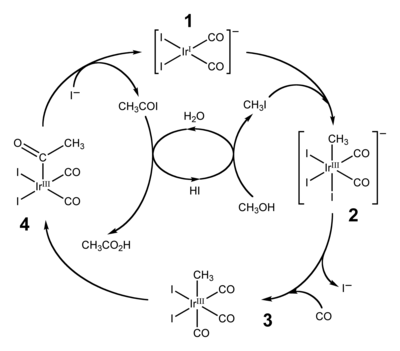
El metanol y el isobuteno se combinan para dar metil tert-butil éter (MTBE). El MTBE es un importante potenciador del octanaje de la gasolina.
Metanol a hidrocarburos, olefinas, gasolina
La condensación del metanol para producir hidrocarbuross e incluso aromáticos es la base de varias tecnologías relacionadas con la conversión de gas a líquidos. Entre ellas se incluyen la conversión de metanol en hidrocarburos (MtH), la conversión de metanol en gasolina (MtG), la conversión de metanol en olefinas (MtO) y la conversión de metanol en propileno (MtP). Estas conversiones son catalizadas por zeolitas como catalizador heterogéneos. El proceso MtG se comercializó una vez en Motunui en Nueva Zelanda.[14][15]
Aditivo para la gasolina
La Directiva europea sobre calidad de los combustibles permite a los productores de combustible mezclar hasta un 3% de metanol, con una cantidad igual de cosolvente, con la gasolina vendida en Europa. China utiliza más de 4500 millones de litros de metanol al año como combustible para el transporte en mezclas de bajo nivel para vehículos convencionales, y mezclas de alto nivel en vehículos diseñados para combustibles de metanol.
Otros productos químicos
El metanol es el precursor de la mayoría de metilaminas simples, haluros de metilo y éteres de metilo.[2] Los ésteres metílicos se producen a partir del metanol, incluida la transesterificación de grasas y la producción de biodiésel mediante transesterificación.[16][17]
Portador de energía
El metanol es un vector energético prometedor porque, como líquido, es más fácil de almacenar que el hidrógeno y el gas natural. Sin embargo, su densidad energética es inferior a la del metano, por kg. Su densidad energética de combustión es de 15,6 MJ/L (LHV), mientras que la del etanol es de 24 y la de la gasolina es de 33 MJ/L.
Otras ventajas del metanol son su fácil biodegradabilidad y su baja toxicidad medioambiental. No persiste ni en ambientes aerobios (con oxígeno) ni anaerobios (sin oxígeno). La vida media del metanol en las aguas subterráneas es de sólo uno a siete días, mientras que muchos componentes comunes de la gasolina tienen vidas medias de cientos de días (como el benceno, de 10 a 730 días). Dado que el metanol es miscible con el agua y biodegradable, es poco probable que se acumule en las aguas subterráneas, las aguas superficiales, el aire o el suelo.[18]
Combustible
El metanol se utiliza ocasionalmente para alimentar motores de combustión internas. Se quema formando dióxido de carbono y agua:
- 2 CH
3OH + 3 O
2 → 2 CO
2 + 4 H
2O
Se ha propuesto el uso del metanol como combustible para el transporte terrestre. La principal ventaja de la economía del metanol es que podría adaptarse a los motores de combustión interna de gasolina con una modificación mínima de los motores y de la infraestructura que suministra y almacena el combustible líquido. Sin embargo, su densidad energética es menor que la de la gasolina, lo que significa que habría que repostar con más frecuencia. Sin embargo, su potencia es equivalente a la de la gasolina de súper alto octanaje, y la mayoría de los sistemas modernos de inyección de combustible controlados por ordenador ya pueden utilizarlo.[19]
El metanol es un combustible alternativo para buques que ayuda a la industria naviera a cumplir las cada vez más estrictas normativas sobre emisiones. Reduce significativamente las emisiones de óxidos de azufre (SOx), óxidos de nitrógeno (NOx) y partículas. El metanol puede utilizarse con gran eficacia en motores diésel marinos tras pequeñas modificaciones utilizando una pequeña cantidad de combustible piloto (combustible dual).[20][21]
En China, el metanol alimenta las calderas industriales, que se utilizan ampliamente para generar calor y vapor para diversas aplicaciones industriales y calefacción residencial. Su uso está desplazando al carbón, que se encuentra bajo la presión de unas normativas medioambientales cada vez más estrictas.[22]
Las pilas de combustible de metanol directos son únicas en su funcionamiento a baja temperatura y presión atmosférica, lo que permite miniaturizarlas en gran medida.[23][24] Esto, combinado con el almacenamiento y la manipulación relativamente fáciles y seguros del metanol, puede abrir la posibilidad de electrónica de consumo alimentada por pilas de combustible, como ordenadores portátiles y teléfonos móviles.[25]
El metanol también es un combustible muy utilizado en estufas de camping y náuticas. El metanol arde bien en un quemador sin presión, por lo que las estufas de alcohol suelen ser muy sencillas, a veces poco más que una taza para contener el combustible. Esta falta de complejidad las convierte en las favoritas de los excursionistas que pasan mucho tiempo en la naturaleza. Asimismo, el alcohol puede gelificarse para reducir el riesgo de fugas o derrames, como ocurre con la marca "Sterno".
El metanol se mezcla con agua y se inyecta en motores diésel y de gasolina de alto rendimiento para aumentar la potencia y reducir la temperatura del aire de admisión en un proceso conocido como inyección de metanol en agua.
Otras aplicaciones
El metanol se utiliza como desnaturalizante del etanol, y el producto se conoce como "alcohol desnaturalizado" o "alcohol metilado". Se utilizó durante la Ley seca en los Estados Unidos para desincentivar el consumo de licor ilegal, y acabó causando varias muertes.[26] En la actualidad, este tipo de prácticas son ilegales en Estados Unidos, considerándose homicidio.[27]
El metanol se utiliza como disolvente y como anticongelante en tuberías y líquido limpiaparabrisas. El metanol se utilizó como anticongelante refrigerante de automóviles a principios de 1900.[28] A partir de mayo de 2018, el metanol quedó prohibido en la UE para su uso en el lavado o desempañado de parabrisas debido a su riesgo para el consumo humano[29][30] como consecuencia de intoxicaciones por metanol en la República Checa en 2012.[31]
En algunas plantas de tratamiento de aguas residuales, se añade una pequeña cantidad de metanol a las aguas residuales para proporcionar una fuente de alimentación de carbono a las bacterias desnitrificantes, que convierten los nitratos en nitrógeno gaseoso y reducen la nitrificación de acuíferos sensibles.
El metanol se utiliza como agente de destinción en la electroforesis en gel de poliacrilamida.
Toxicidad
En concentraciones elevadas (o menores en comparación con el alcohol etílico) el metanol puede causar dolor de cabeza, mareo, náuseas, vómitos y muerte (la ingestión de una dosis entre 20 ml a 150 ml es mortal[32]). La exposición aguda puede causar ceguera o pérdida de la visión, ya que puede dañar seriamente el nervio óptico (neuropatía óptica). Una exposición crónica puede ser causa de daños al hígado o de cirrosis.
El envenenamiento por metanol y su asociación con toxicidad grave sobre el sistema nervioso central y ocular, constituyen un problema de salud. Las características clínicas de la intoxicación aguda por metanol incluyen acidemia fórmica, acidosis metabólica, toxicidad visual, coma y en casos extremos la muerte.
En España (con mayor incidencia en Galicia y Canarias), en 1963 se produjo una intoxicación masiva de personas que habían bebido aguardiente adulterado con metanol, cuyo origen se ubicó en una bodega de Orense. Los sucesos se conocieron como Caso del metílico.
El metanol es metabolizado a formaldehído en el hígado, y por oxidaciones sucesivas a través de una vía dependiente de tetrahidrofurano (THF) se forman ácido fórmico y dióxido de carbono.
El ácido fórmico es el metabolito responsable de los efectos tóxicos del metanol, el cual inhibe la citocromo oxidasa, interfiriendo con el transporte de electrones en la cadena respiratoria. Inhibe la función mitocondrial en la retina y aumenta el estrés oxidativo. Su acción citotóxica se ejerce de manera diferenciada sobre los fotorreceptores, con una recuperación parcial de las respuestas dominadas por los bastones y ninguna recuperación sobre las respuestas mediadas por conos ultravioleta.
La gravedad de la intoxicación con metanol esta causada por los ácidos generados en su metabolismo a través de la enzima alcohol deshidrogenasa (ADH). Estos metabolitos se acumulan en el organismo en las 12-24 horas posteriores a la intoxicación. El etanol actúa como antídoto ya que se une selectiva y competitivamente al ADH, a través de la misma vía enzimática.
Mientras que el metabolismo de metanol da lugar a ácido fórmico, responsable de su toxicidad, el etanol compite con la ADH, y genera acetaldehído, que en última instancia se convierte en acetil coenzima A, para la síntesis de ácidos grasos.
Biometanol
En la industria relacionada con la producción de vino, el metanol proviene de la desmetilación enzimática de las pectinas presentes en la pared celular de la uva y, por consiguiente, su concentración en los vinos estará determinada por la concentración de pectinas en el mosto, que depende de la variedad de uva que se emplee, la concentración de enzimas y el grado de actividad de estas últimas.
En la pila de combustible, se trabaja en su aplicación en base al metanol que puede extraerse de productos vegetales e integraría un proceso de generación natural ecológica y sostenible.
Referencias
- Número CAS
- Manfred Müller, Ute Hübsch, “Dimethyl Ether” in Ullmann’s Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. doi 10.1002/14356007.a08_541
- Turner C (2006). «Estudio longitudinal del metanol en el aliento exhalado de 30 voluntarios sanos mediante espectrometría de masas con tubo de flujo de iones seleccionados, SIFT-MS». Physiological Measurement 27 (7): 637-48. Bibcode:2006PhyM...27..637T. PMID 16705261. S2CID 22365066. doi:10.1088/0967-3334/27/7/007.
- Lindinger W (1997). «Producción endógena de metanol tras el consumo de fruta». Alcoholism: Clinical and Experimental Research 21 (5): 939-43. PMID 9267548. doi:10.1111/j.1530-0277.1997.tb03862.x.
- «Identificada una importante fuente de metanol en el océano». Institución Oceanográfica Woods Hole. 10 de marzo de 2016. Archivado desde el original el 28 de diciembre de 2018. Consultado el 30 de marzo de 2016.
- Mincer, Tracy J.; Aicher, Athena C. (2016). «Producción de metanol por un amplio conjunto filogenético de fitoplancton marino». PLOS ONE 11 (3): e0150820. Bibcode:2016PLoSO..1150820M. PMC 4786210. PMID 26963515.
- Brooks Hays (17 de abril de 2015). «Por qué los astrónomos odian la Roomba que corta el césped». Space Daily. Archivado desde el original el 27 de abril de 2015. Consultado el 20 de abril de 2015.
- «El MERLIN actualizado espía una nube de alcohol que abarca 288.000 millones de millas». Jodrell Bank Centre for Astrophysics. 19 de abril de 2006. Archivado desde el original el 20 de julio de 2011.
- Amos, Jonathan (5 de abril de 2006). «Merlin ve una vasta corriente de alcohol». BBC News. Archivado desde el original el 6 de octubre de 2014. Consultado el 5 de septiembre de 2010.
- «Primera detección de alcohol metílico en un disco de formación planetaria». Archivado desde el original el 22 de junio de 2016. Consultado el 22 de junio de 2016.
- Dimethyl Ether Technology and Markets 07/08-S3 Report, ChemSystems, December 2008. Archivado el 22 de noviembre de 2009 en Wayback Machine.
- Química orgánica industrial. Klaus Weissermel, Hans-Jürgen Arpe, Reverte, 1981
- Sunley, G. J.; Watson, D. J. (2000). «High productivity methanol carbonylation catalysis using iridium – The Cativa process for the manufacture of acetic acid». Catalysis Today 58 (4): 293-307.
- Olsbye, U.; Svelle, S.; Bjorgen, M.; Beato, P.; Janssens, T. V. W.; Joensen, F.; Bordiga, S.; Lillerud, K. P. (2012). «Conversión de metanol en hidrocarburos: cómo la cavidad de la zeolita y el tamaño de los poros controlan la selectividad del producto». Angew. Chem. Int. Ed. 51 (24): 5810-5831. PMID 22511469. S2CID 26585752. hdl:2318/122770.
- Tian, P.; Wei, Y.; Ye, M.; Liu, Z. (2015). «Metanol a olefinas (MTO): From Fundamentals to Commercialization». ACS Catal. 5 (3): 1922-1938. doi:10.1021/acscatal.5b00007.
- «Biodiesel - METHANOL INSTITUTE». METHANOL INSTITUTE. Archivado desde el original el 25 de marzo de 2018. Consultado el 24 de marzo de 2018.
- «Principios y procesos de producción de biodiésel - eXtension». Archivado desde el original el 25 de marzo de 2018. Consultado el 24 de marzo de 2018.
- Evaluation of the Fate and Transport of Methanol in the Environment (enlace roto disponible en este archivo)., Malcolm Pirnie, Inc., enero de 1999.
- «El metanol gana». National Review. Diciembre 2011. Archivado desde el original el 7 de junio de 2022. Consultado el 7 de junio de 2022.
- com/about-methanol/methanol-marine-fuel «El metanol como combustible marino». Methanex Corporation. Archivado desde el original el 21 de enero de 2021. Consultado el 10 de abril de 2021.
- Andersson, Karin; Márquez Salazar, Carlos (2015). «Informe sobre el metanol como combustible marino». FC Business Intelligence. Archivado desde pdf el original el 10 de abril de 2021. Consultado el 10 de abril de 2021.
- «El metanol como combustible para calderas industriales». Methanex Corporation. Archivado desde el original el 20 de enero de 2021. Consultado el 10 de abril de 2021.
- Kamitani, A.; Morishita, S.; Kotaki, H.; Arscott, S. (2008). «MicroDMFC miniaturizada utilizando técnicas de microsistemas de silicio: Rendimiento a bajos caudales de combustible». Journal of Micromechanics and Microengineering 18 (12): 125019. Bibcode:2008JMiMi..18l5019K. S2CID 110214840. doi:10.1088/0960-1317/18/12/125019. Archivado desde pdf el original el 21 de noviembre de 2021. Consultado el 30 de octubre de 2021.
- Kamitani, A.; Morishita, S.; Kotaki, H.; Arscott, S. (2011). «Microfabricated microfluidic fuel cells». Sensors and Actuators B: Chemical 154 (2): 174.
- Berger, Sandy (30 de septiembre de 2006). «Combustible metanol para portátiles». Compu-Kiss. Archivado desde el original el 3 de febrero de 2007. Consultado el 22 de mayo de 2007.
- Blum, Deborah (19 de febrero de 2010). «La historia poco contada de cómo el gobierno de EE.UU. gobierno envenenó el alcohol durante la Ley Seca». Slate Magazine. Archivado desde el original el 6 de agosto de 2018. Consultado el 10 de junio de 2010.
- «22 USC Ch. 75: CHEMICAL WEAPONS CONVENTION IMPLEMENTATION». uscode.house.gov. Archivado desde el original el 17 de octubre de 2020. Consultado el 13 de agosto de 2020.
- Yant, W. P.; Schrenk, H. H.; Sayers, R. R. (1931). «Anticongelante de metanol e intoxicación por metanol». Industrial & Engineering Chemistry 23 (5): 551.
- «EUR-Lex - 32018R0589 - ES - EUR-Lex». eur-lex.europa.eu. Archivado desde el original el 27 de julio de 2020. Consultado el 28 de noviembre de 2018.
- «Corrección de errores del Reglamento (UE) 2018/589 de la Comisión, de 18 de abril de 2018, por el que se modifica el anexo XVII del Reglamento (CE) nº 1907/2006 del Parlamento Europeo y del Consejo, relativo al registro, la evaluación, la autorización y la restricción de las sustancias y preparados químicos (REACH), en lo que respecta al metanol (DO L 99 de 19. 4.2018)» (32018R0589R(01)). 23 de abril de 2018. Archivado desde el original el 26 de mayo de 2021. Consultado el 7 de julio de 2020.
- «Informe de restricción del anexo XV: Propuesta de restricción Nombre de la sustancia: Methanol – table D.1-4-page 79». 16 de enero de 2015. Archivado desde el original el 26 de mayo de 2021. Consultado el 17 de febrero de 2021.
- «Intoxicación por Metanol». Consultado el 4 de enero de 2011.
Enlaces externos
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del metanol.
