Nitrilotriacetonitrilo
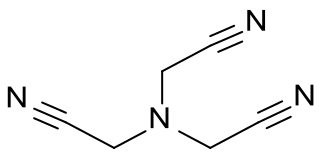
El nitrilotriacetonitrilo, llamado también 2,2',2''-nitrilotriacetonitrilo,[2][3] es un compuesto orgánico de fórmula molecular C6H6N4. En su estructura química, un nitrógeno central se encuentra unido a tres grupos acetonitrilo (-CH2-C≡N).
| Nitrilotriacetonitrilo | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| 2-[bis(cianometil)amino]acetonitrilo | ||
| General | ||
| Otros nombres |
2,2',2''-nitrilotriacetonitrilo nitrilotrisacetonitrilo | |
| Fórmula semidesarrollada | N≡C-CH2-N(CH2-C≡N)-CH2-C≡N | |
| Fórmula molecular | C6H6N4 | |
| Identificadores | ||
| Número CAS | 7327-60-8[1] | |
| ChemSpider | 73778 | |
| PubChem | 81762 | |
| UNII | 86K27312YB | |
|
C(C#N)N(CC#N)CC#N
| ||
| Propiedades físicas | ||
| Apariencia | Sólido húmedo | |
| Densidad | 1166 kg/m³; 1,166 g/cm³ | |
| Masa molar | 13 406 g/mol | |
| Punto de fusión | 126 °C (399 K) | |
| Punto de ebullición | 421 °C (694 K) | |
| Presión de vapor | 0,0 ± 1,0 mmHg | |
| Índice de refracción (nD) | 1,491 | |
| Propiedades químicas | ||
| Solubilidad en agua | 1000 g/L | |
| log P | -0,31 | |
| Familia | Nitrilo, amina | |
| Peligrosidad | ||
| Punto de inflamabilidad | 484,15 K (211 °C) | |
| NFPA 704 |
0
1
0
| |
| Compuestos relacionados | ||
| nitrilos |
dimetilaminoacetonitrilo dialilcianamida | |
| dinitrilos |
(dimetilaminometilen)malononitrilo iminodiacetonitrilo | |
| polinitrilos | tricianoaminopropeno | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
Propiedades físicas y químicas
A temperatura ambiente, el nitrilotriacetonitrilo tiene el aspecto de un sólido húmedo. Su densidad es casi un 20% mayor que la del agua (1,166 g/cm³).[4] Tiene su punto de fusión a 126 °C, mientras que su punto de ebullición es de 421 °C.[2] Es soluble en agua, en proporción aproximada de 1000 g/L, siendo el valor del logaritmo de su coeficiente de reparto, logP = -0,31; ello indica una solubilidad mayor en disolventes polares que en disolventes apolares como el 1-octanol.[2]
En cuanto a su reactividad, este polinitrilo es incompatible con oxidantes fuertes.[4]
Síntesis
Existen diversos procedimientos de síntesis de a partir de cianuro de hidrógeno, formaldehído y amoníaco, reacción tiene lugar a pH bajos:
- 3 H2CO + NH3 + 3 HCN → N(CH2-CN)3 + 3 H2O
El rendimiento de la anterior reacción aumenta si el proceso se desarrolla en dos fases: en una primera mezcla, se hacen reaccionar en agua formaldehído y amoníaco —NH3 o su equivalente como sal de amonio de un ácido fuerte—, no siendo necesario ajuste externo de pH; una segunda mezcla contiene cianuro de hidrógeno en agua, ajustándose el pH de esta segunda mezcla a 1 o menos mediante el uso de un ácido fuerte como ácido sulfúrico, ácido clorhídrico o equivalente. El nitrilotriacetonitrilo se elabora combinando las dos mezclas a una temperatura de 55 °C-70 °C.[5]
El amoníaco (o la correspondiente sal de amonio) de la anterior síntesis puede sustituirse por hexametilentetramina. Con este procedimiento, los reactivos se hacen reaccionar en un reactor de mezcla en una primera etapa, para después continuar en un reactor tubular de flujo a pistón a 95 °C-120 °C. Tras enfriar la mezcla resultante, se recupera el nitrilotriacetonitrilo cristalizado.[6] Esta cristalización también se efectúa en dos etapas: en la primera, se enfría la disolución de nitrilotriacetonitrilo en agua a 85 °C, creando una suspensión acuosa de nitrilotriacetonitrilo, y en la segunda etapa se enfría dicha suspensión a una temperatura inferior a 35 °C.[7]
Usos
El nitrilotriacetonitrilo se ha empleado para la síntesis de tris(2-aminoetil)amina (tren), compuesto de gran interés en la química de coordinación. Esta hidrogenación, catalizada por cobalto Raney, se lleva a cabo a 100 °C y elevada presión en una atmósfera libre de oxígeno.[8] Asimismo, este polinitrilo se puede utilizar para elaborar triaminas cíclicas, como la aminoetilpiperazina (AEP), compuestos útiles como dispersantes, quelantes, catalizadores o precursores para producir otras aminas.[9]
Por otra parte, la hidrólisis de nitrilotriacetonitrilo permite preparar ácido nitrilotriacético o cualquiera de sus sales solubles, como por ejemplo el nitrilotriacetato sódico, de acuerdo a la reacción:[5]
- N(CH2-CN)3 + 3 NaOH → N(CH2-COONa)3 + 3 NH3
Estos últimos compuestos se utilizan como «agentes secuestrantes» —sustancias que eliminan iones de una disolución— en detergentes.
Cabe señalar que, al igual que otros nitrilos, el nitrilotriacetonitrilo puede polimerizarse, dependiendo del pH, siendo también capaz de eliminar cianuro de hidrógeno de forma espontánea. Además, cuando los nitrilos sólidos como el nitrilotriacetonitrilo se calientan en disolución, experimentan una lenta degradación acompañada por un oscurecimiento; cuando dicha disolución se utiliza como precursor en cualquier proceso de síntesis, el catalizador metálico empleado se puede volver rápidamente inactivo. Para evitar todo ello, el nitrilotriacetonitrilo puede estabilizarse con SiO2 y Al2O3, siendo también adecuados para este fin zeolitas (o aluminosilicatos) y vidrio, si bien la combinación SiO2:Al2O3 es particularmente efectiva.[10]
Por último, este polinitrilo puede ser útil como «portador de protones» en composiciones y métodos para producir moléculas de ácidos nucleicos.[11]
Precauciones
El nitrilotriacetonitrilo tiene el punto de inflamabilidad a 211 °C. Puede ser un compuesto tóxico si se ingiere, inhala o entra en contacto con la piel. Es irritante para el aparato respiratorio así como para los ojos.[4]
Véase también
Los siguientes compuestos son isómeros del nitrilotriacetonitrilo:
- 4-amino-2-metil-5-pirimidincarbonitrilo
- 2-amino-4-metil-5-pirimidincarbonitrilo
Referencias
- Número CAS
- 2,2',2''-Nitrilotriacetonitrile (ChemSpider)
- Nitrilotriacetonitrile (PubChem)
- Nitrilotriacetonitrile. MSDS (Pfaltz & Bauer)
- Process for the preparation of nitrilotriacetonitrile (NTN) (1976). Otto A. Homberg; Alan H. Singleton. Patente US 3959342 A.
- Process for producing nitrilotriacetonitrile (1988). Kent P. Lannert; Chung Y. Shen; Dat S. Trieu. Patente US4731465 A.
- Two-stage crystallization of nitrilotriacetonitrile from a hot solution (1984). Kent P. Lannert; Chung Y. Shen; Dat S. Trieu. Patente US 4485049 A.
- The preparation of polyamines (1994). Gerald Joseph O'Neill; Albert Henry Levesque. Patente EP 0382508 B1.
- Methods of making cyclic, N-amino functional triamines (2014). King, S.W. et al. Patente 8,907,088.
- Nitrile stabilization (2000). Albert H. Levesque; Gerald J. O'Neill. Patente EP 1031558 A2.
- HIGH EFFICIENCY, SMALL VOLUME NUCLEIC ACID SYNTHESIS (2016). Poehmerer, T. et al. Patente 20160186166.
