Nitrógeno
El nitrógeno es un elemento químico de número atómico 7, símbolo N, su masa atómica es de 14,0067 g/mol y en condiciones normales forma un gas diatómico (nitrógeno diatómico o molecular) que constituye del orden del 78 % del aire atmosférico.[1] Antiguamente era llamado ázoe (símbolo Az).
| Carbono ← Nitrógeno → Oxígeno | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Nitrógeno líquido | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Nitrógeno, N, 7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | No metales | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 15, 2, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 14,007 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [He] 2s2 2p3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 5 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia | Incoloro | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 65 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 3,04 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 56 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 75 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 155 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | ±3, 5, 4, 2, 1 (ácido fuerte) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 1402,3 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 2856 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 4578,1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 7475 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 9444,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª energía de ionización | 53266,6 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7.ª energía de ionización | 64360 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Gas | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | 1,2506 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 63,14 K (−210 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 77,35 K (−196 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 5,57 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 0,7087 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto crítico |
126,19 K (−147 °C) 3.39 MPa Pa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | hexagonal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 1040 J/(K·kg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad eléctrica | __ 106 S/m | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 0,02598 W/(K·m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 334 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del nitrógeno | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El nitrógeno es el miembro más ligero del grupo 15 de la tabla periódica, a menudo llamado pnicógeno. Es un elemento común en el universo, que se estima en aproximadamente séptimo en abundancia total en la Vía Láctea y el Sistema Solar. A temperatura y presión estándar, dos átomos del elemento se unen para formar dinitrógeno, un gas incoloro e inodoro de fórmula N2. El dinitrógeno forma alrededor del 78% de la atmósfera terrestre, lo que lo convierte en el elemento no combinado más abundante. El nitrógeno está presente en todos los organismos, principalmente en los aminoácidos (y por tanto en las proteínas), en los ácidos nucleicos (ADN y ARN) y en la molécula de transferencia de energía trifosfato de adenosina. El cuerpo humano contiene alrededor de un 3% de nitrógeno en masa, el cuarto elemento más abundante en el cuerpo después del oxígeno, el carbono y el hidrógeno. El ciclo del nitrógeno describe el movimiento del elemento desde el aire, hacia la biosfera y los compuestos orgánicos, y luego de vuelta a la atmósfera.
Muchos compuestos de importancia industrial, como el amoniaco, el ácido nítrico, los nitratos orgánicos (propulsores y explosivos) y el cianuro, contienen nitrógeno. El fortísimo triple enlace del nitrógeno elemental (N≡N), el segundo enlace más fuerte de cualquier molécula diatómica después del monóxido de carbono (CO),[2] domina la química del nitrógeno. Esto provoca dificultades tanto para los organismos como para la industria a la hora de convertir el N2 en compuestos útiles, pero al mismo tiempo significa que la quema, la explosión o la descomposición de los compuestos de nitrógeno para formar gas nitrógeno liberan grandes cantidades de energía a menudo útil. El amoniaco y los nitratos producidos sintéticamente son fertilizantes clave para la industria, y los nitratos de los fertilizantes son contaminantes clave en la eutrofización de los sistemas acuáticos.
Aparte de su uso en fertilizantes y almacenes de energía, el nitrógeno es un constituyente de compuestos orgánicos tan diversos como el Kevlar utilizado en tejidos de alta resistencia y el cianoacrilato utilizado en el superglue. El nitrógeno es un constituyente de todas las principales clases de fármacos, incluidos los antibióticos. Muchos fármacos son imitaciones o profármacos de las moléculas naturales de señalización celular que contienen nitrógeno: por ejemplo, los nitratos orgánicos nitroglicerina y nitroprusiato controlan la presión arterial al metabolizarse en óxido nítrico. Muchas drogas notables que contienen nitrógeno, como la cafeína natural y la morfina o las anfetaminas sintéticas, actúan sobre los receptores de los neurotransmisores animales.
Historia

Los compuestos de nitrógeno tienen una historia muy larga, ya que el cloruro de amonio era conocido por Heródoto. Ya eran bien conocidos en la Edad Media. Los alquimistas conocían el ácido nítrico como aqua fortis (agua fuerte), así como otros compuestos nitrogenados como las sales de amonio y las sales de nitrato. La mezcla de ácido nítrico y clorhídrico era conocida como agua regia (agua real), célebre por su capacidad para disolver el oro, el rey de los metales.[3]
El descubrimiento del nitrógeno se atribuye al médico escocés Daniel Rutherford en 1772, que lo llamó aire nocivo.[4][5] Aunque no lo reconoció como una sustancia química totalmente diferente, lo distinguió claramente del "aire fijo", o dióxido de carbono, de Joseph Black. [6] El hecho de que había un componente del aire que no soportaba la combustión estaba claro para Rutherford, aunque no era consciente de que fuera un elemento. El nitrógeno también fue estudiado casi al mismo tiempo por Carl Wilhelm Scheele,[7] Henry Cavendish,[8] y Joseph Priestley,[9] que se refirió a él como aire quemado o teoría del flogisto. El químico francés Antoine Lavoisier se refirió al gas nitrógeno como "aire mefítico" o azote, de la palabra άζωτικός del griego. (azotikos), "sin vida", debido a que es mayoritariamente inerte. [10][11] En una atmósfera de nitrógeno puro, los animales morían y las llamas se extinguían. Aunque el nombre de Lavoisier no fue aceptado en inglés, ya que se señaló que casi todos los gases (de hecho, con la única excepción del oxígeno) son mefíticos, se utiliza en muchos idiomas (francés, italiano, portugués, polaco, ruso, albanés, turco, etc. El alemán Stickstoff también hace referencia a la misma característica, es decir, ersticken "ahogar o asfixiar") y aún permanece en inglés en los nombres comunes de muchos compuestos de nitrógeno, como la hidracina y los compuestos del ion azida. Finalmente, dio lugar a la denominación "pnicógenos" para el grupo encabezado por el nitrógeno, del griego πνίγειν "ahogar".[3]
La palabra inglesa nitrogen (1794) entró en la lengua a partir del francés nitrogène, acuñado en 1790 por el químico francés Jean-Antoine Chaptal (1756-1832),[12] del francés nitre (nitrato de potasio, también llamado salitre) y el sufijo francés -gène, "producir", del griego -γενής (-genes, "engendrado"). El significado de Chaptal era que el nitrógeno es la parte esencial del ácido nítrico, que a su vez se producía a partir del nitrato de potasio. En épocas anteriores, el nitro se había confundido con el "natrón" egipcio (carbonato de sodio) - llamado νίτρον (nitrón) en griego - que, a pesar del nombre, no contenía nitrato.[13]
Las primeras aplicaciones militares, industriales y agrícolas de los compuestos de nitrógeno utilizaban el salitre (nitrato de sodio o nitrato de potasio), sobre todo en la pólvora, y posteriormente como fertilizante. En 1910, Lord Rayleigh descubrió que una descarga eléctrica en el gas nitrógeno producía "nitrógeno activo", un monoatómico alótropo del nitrógeno.[14] La "nube arremolinada de luz amarilla brillante" producida por su aparato reaccionó con mercurio para producir nitruro de mercurio explosivo.[15]
Durante mucho tiempo, las fuentes de compuestos de nitrógeno fueron limitadas. Las fuentes naturales procedían de la biología o de depósitos de nitratos producidos por reacciones atmosféricas. La fijación de nitrógeno mediante procesos industriales como el proceso Frank-Caro (1895-1899) y el proceso Haber-Bosch (1908-1913) aliviaron esta escasez de compuestos nitrogenados, hasta el punto de que la mitad de la producción mundial de alimentos depende ahora de los fertilizantes nitrogenados sintéticos.[16] Al mismo tiempo, el uso del método de Ostwald (1902) para producir nitratos a partir de la fijación industrial del nitrógeno permitió la producción industrial a gran escala de nitratos como materia prima en la fabricación de explosivos en la Guerra Mundial del siglo XX. [17][18]
Propiedades
Atómicas

Un átomo de nitrógeno tiene siete electrones. En el estado básico, están dispuestos en la configuración electrónica 1s2
2s2
2p1
x2p1
y2p1
z. Por lo tanto, tiene cinco electrones de valencia en los orbitales 2s y 2p, tres de los cuales (los electrones p) no están apareados. Tiene una de las más altas electronegatividades entre los elementos (3,04 en la escala de Pauling), solo superada por el cloro (3,16), el oxígeno (3,44), y el flúor (3.98). (Los gases nobles ligeros, helio, neón y argón, presumiblemente también serían más electronegativos, y de hecho están en la escala de Allen.)[19] Siguiendo las tendencias periódicas, su radio covalente de 71 pm es menor que los del boro (84 pm) y del carbono (76 pm), mientras que es mayor que los del oxígeno (66 pm) y el flúor (57 pm). El anión nitruro, N3-, es mucho mayor, con 146 pm, similar al del óxido. (O2-: 140 pm) y del fluoruro (F-: 133 pm).[19] Las tres primeras energías de ionización del nitrógeno son 1,402, 2,856 y 4,577 MJ-mol-1, y la suma de la cuarta y la quinta es de 16,920 MJ-mol-1}. Debido a estas cifras tan elevadas, el nitrógeno no tiene una química catiónica simple.[20]
La falta de nodos radiales en la subesfera 2p es directamente responsable de muchas de las propiedades anómalas de la primera fila del bloque p, especialmente en el nitrógeno, el oxígeno y el flúor. La subcáscara 2p es muy pequeña y tiene un radio muy similar a la cáscara 2s, facilitando la hibridación orbital. También da lugar a fuerzas electrostáticas de atracción muy grandes entre el núcleo y los electrones de valencia de las cáscaras 2s y 2p, dando lugar a electronegatividades muy altas. La hipervalencia es casi desconocida en los elementos 2p por la misma razón, ya que la alta electronegatividad hace difícil que un pequeño átomo de nitrógeno sea un átomo central en un Enlace de tres centros y cuatro electrones, ya que tendería a atraer los electrones fuertemente hacia sí mismo. Así, a pesar de la posición del nitrógeno en la cabeza del grupo 15 de la tabla periódica, su química muestra enormes diferencias con la de sus congéneres más pesados fósforo, arsénico, antimonio y bismuto. [21]
Isótopos

El nitrógeno tiene dos isótopos estables: 14N y 15N. El primero es mucho más común, constituyendo el 99,634% del nitrógeno natural, y el segundo (que es ligeramente más pesado) constituye el 0,366% restante. Esto lleva a un peso atómico de alrededor de 14,007 u.[19] Ambos isótopos estables se producen en el ciclo CNO en las estrellas, pero el 14N es más común ya que su captura de neutrones es el paso que limita la velocidad. 14N es uno de los cinco núclidos impares estables. (un nucleido que tiene un número impar de protones y neutrones); los otros cuatro son 2H, 6Li, 10B y 180mTa.[22]
La abundancia relativa de 14N y 15N es prácticamente constante en la atmósfera pero puede variar en otros lugares, debido al fraccionamiento isotópico natural de las reacciones redox biológicas y a la evaporación del amoniaco natural o del ácido nítrico. [23] Reacciones mediadas biológicamente (por ejemplo, asimilación, nitrificación, y desnitrificación) controlan fuertemente la dinámica del nitrógeno en el suelo Estas reacciones típicamente resultan en el enriquecimiento de 15N del sustrato y el agotamiento del producto.[24]
El isótopo pesado 15N fue descubierto por primera vez por S. M. Naudé en 1929, poco después de que se descubrieran los isótopos pesados de los elementos vecinos oxígeno y carbono.[25] Presenta una de las secciones transversales de captura de neutrones térmicos más bajas de todos los isótopos. [26] Se utiliza frecuentemente en resonancia magnética nuclear (RMN) para determinar las estructuras de las moléculas que contienen nitrógeno, debido a su espín nuclear fraccionario de la mitad, que ofrece ventajas para la RMN, como una anchura de línea más estrecha. El 14N, aunque también es utilizable en teoría, tiene un espín nuclear entero de uno y, por lo tanto, tiene un momento cuadrupolar que conduce a espectros más amplios y menos útiles.[19] La RMN del 15N tiene, sin embargo, complicaciones que no se encuentran en la espectroscopia de RMN del 1H y del 13C, más comunes. La baja abundancia natural de 15N (0,36%) reduce significativamente la sensibilidad, un problema que se ve agravado por su baja relación giromagnética, (solo el 10,14% de la de 1H). Como resultado, la relación señal-ruido para 1H es unas 300 veces mayor que la de 15N a la misma intensidad de campo magnético. [27] Esto puede aliviarse en cierta medida mediante el enriquecimiento isotópico de 15N por intercambio químico o destilación fraccionada. Los compuestos enriquecidos con 15N tienen la ventaja de que, en condiciones estándar, no sufren el intercambio químico de sus átomos de nitrógeno con el nitrógeno atmosférico, a diferencia de los compuestos con isótopos de hidrógeno, carbono y oxígeno marcados que deben mantenerse alejados de la atmósfera.[19] La relación 15N:14N se utiliza habitualmente en el análisis de isótopos estables en los campos de la geoquímica, la hidrología, la paleoclimatología y la paleoceanografía, donde se denomina δ15N. [28]
Aplicación
La aplicación comercial más importante del nitrógeno diatómico es la obtención de amoniaco por el proceso de Haber. El amoniaco se emplea con posterioridad en la fabricación de fertilizantes y ácido nítrico.
Las sales del ácido nítrico incluyen importantes compuestos como el nitrato de potasio (nitro o salitre empleado en la fabricación de pólvora) y el nitrato de amonio fertilizante.
Los compuestos orgánicos de nitrógeno como la nitroglicerina y el trinitrotolueno son a menudo explosivos. La hidracina y sus derivados se usan como combustible en cohetes.
El ciclo de este elemento es bastante más complejo que el del carbono, dado que está presente en la atmósfera no solo como N2 (78 %) sino también en una gran diversidad de compuestos. Se puede encontrar principalmente como N2O, NO y NO2, los llamados NOx. También forma otras combinaciones con oxígeno tales como N2O3 y N2O5 (anhídridos), "precursores" de los ácidos nitroso y nítrico. Con hidrógeno forma amoniaco (NH3), compuesto gaseoso en condiciones normales.
Al ser un gas poco reactivo, el nitrógeno se emplea industrialmente para crear atmósferas protectoras y como gas criogénico para obtener temperaturas del orden de 78 K de forma sencilla y económica. Inclusive se utiliza para inflar los neumáticos en los trenes de aterrizaje de los aviones, evitando condensación de agua a grandes alturas o su combustión al aterrizar.[29]
Etimología
Se considera que el nitrógeno (del latín nitrum -i, a su vez del griego νίτρον, "nitro" -nombre que históricamente se ha usado en forma vaga para referirse a diversos compuestos de sodio y de potasio que contienen nitrógeno-, y -geno, de la raíz griega γεν-, "generar"; es decir, "que genera salitre"[30]) fue descubierto formalmente por Daniel Rutherford en 1772, al dar a conocer algunas de sus propiedades (lo llamó "aire flogisticado", en función de lo que observó en su experimento de ese año[31]). Sin embargo, por la misma época también se dedicaron a su estudio Carl Wilhelm Scheele, quien lo aisló, Henry Cavendish y Joseph Priestley.
El nitrógeno es un gas tan inerte que Antoine Lavoisier se refería a él con el nombre azote, del griego ázoe, que significa "sin vida"[32][33] (o tal vez lo llamó así por no ser apto para respirar[34]). Se clasificó entre los gases permanentes, sobre todo desde que Michael Faraday no consiguió verlo líquido a 50 atmósferas (atm) y –110 °C hasta los experimentos de Raoul Pictet y Louis Paul Cailletet, quienes en 1877 consiguieron licuarlo.
Los compuestos de nitrógeno ya se conocían en la Edad Media; así, los alquimistas llamaban aqua fortis al ácido nítrico y aqua regia (agua regia) a la mezcla de ácido nítrico y ácido clorhídrico, mezcla conocida por su capacidad para disolver el oro y el platino.
Abundancia y obtención
El nitrógeno es el componente principal de la atmósfera terrestre (78,1 % en volumen) y se obtiene para usos industriales de la destilación del aire líquido. Está presente también en los restos de animales, por ejemplo el guano, usualmente en la forma de urea, ácido úrico y compuestos de ambos. Por deficiencia causa falta de relajación de los músculos, problemas en el sistema cardiovascular, en el nervioso central y periférico.
También ocupa el 3 % de la composición elemental del cuerpo humano.
Se han observado compuestos que contienen nitrógeno en el espacio exterior y el isótopo Nitrógeno-14 se crea en los procesos de fusión nuclear de las estrellas.
La mayor parte del nitrógeno utilizado en la industria química se obtiene por destilación fraccionada del aire líquido, y se usa para sintetizar amoniaco. A partir de este amoniaco se preparan una gran variedad de productos químicos.
Compuestos
Con el hidrógeno forma el amoniaco (NH3), los nitritos (NO2), los nitratos (NO3), los ácidos nítricos (HNO3), la hidracina (N2H4) y el aziduro de hidrógeno (N3H, también conocido como azida de hidrógeno o ácido hidrazoico). El amoniaco líquido, anfótero como el agua, actúa como una base en una disolución acuosa, formando iones amonio (NH4+), y se comporta como un ácido en ausencia de agua, cediendo un protón a una base y dando lugar al anión amida (NH2). Se conocen largas cadenas y compuestos cíclicos de nitrógeno, pero son muy inestables.
Con los halógenos forma: NF3, NF2Cl, NFCl2, NCl3, NBr3.6 NH3, NI3.6 NH3, N2F4, N2F2 (cis y trans), N3F, N3Cl, N3Br y N3I.
Con el oxígeno forma varios óxidos que ya hemos nombrado: el nitroso o gas de la risa, el nítrico y el dióxido de nitrógeno. Son producto de procesos de combustión contribuyendo a la aparición de episodios contaminantes de smog fotoquímico. Otros óxidos son el trióxido de dinitrógeno (N2O3) y el pentóxido de dinitrógeno (N2O5), ambos muy inestables y explosivos.
Importancia biológica
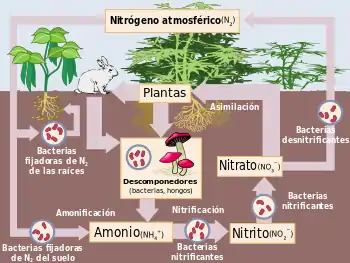
El nitrógeno es un componente esencial de los aminoácidos y los ácidos nucleicos vitales para los seres vivos. De todos los nutrientes minerales, es el que mayor efecto tiene en el crecimiento de las plantas y, por lo tanto, en la productividad primaria de los ecosistemas, lo que afecta a su vez a todos los organismos que dependen de ellas:[35] El aumento en el rendimiento de las cosechas a partir de que se comenzaron a utilizar fertilizantes nitrogenados en el siglo XIX lo demuestra.[36] A pesar de la gran cantidad de nitrógeno atmosférico, este elemento es limitante: pocos organismos pueden asimilarlo en esta forma. Las plantas solamente pueden asimilarlo eficientemente forma de iones amonio (NH4+) o nitrato (NO3-), aunque también pueden absorber pequeñas cantidades de aminoácidos y urea.[37]
Algunas plantas han establecido relaciones simbióticas con hongos y procationtes capaces de reducir el nitrógeno atmosférico a amonio, a cambio de lo cual reciben moléculas energéticas de la planta hospedera. El nitrógeno reducido es así incorporado a la cadena trófica (véase también el ciclo del nitrógeno). Quizás el caso más conocido sea el de las bacterias del género Rhizobium con las leguminosas, pero también existen asociaciones con bacterias del género Frankia e inclusive algunas cianobacterias. Finalmente, también algunos hongos, llamados ectomicorrízicos, extienden sus filamentos más allá del alcance de las raíces, formando micorrizas que hacen más eficiente la absorción de nitritos, nitratos y amonio del suelo en ambientes limitantes.[38]
Isótopos
Existen dos isótopos estables del nitrógeno, 14N y 15N, siendo el primero —que se produce en el ciclo carbono-nitrógeno de las estrellas— el más común sin lugar a dudas (99,634 %). Se ha logrado sintetizar diez isótopos de nitrógeno de los cuales, el 13N tiene un periodo de semidesintegración de nueve minutos. En el resto de isótopos, el periodo de semidesintegración es menor a 10 segundos, e incluso algún isótopo tiene un periodo de semidesintegración mucho menor al segundo.
Las reacciones biológicas de nitrificación y desnitrificación influyen de manera determinante en la dinámica del nitrógeno en el suelo, casi siempre produciendo un enriquecimiento en N-15 del sustrato.
Precauciones
Los fertilizantes nitrogenados son una importante fuente de contaminación del suelo y de las aguas. Los compuestos que contienen iones de cianuro forman sales extremadamente tóxicas y son mortales para numerosos animales, entre ellos los mamíferos. El amoniaco también es altamente tóxico.
Efectos del nitrógeno sobre la salud
Las moléculas de nitrógeno, en estado natural, se encuentran principalmente en el aire. En el agua y en los suelos el nitrógeno puede ser encontrado compuesto, en forma de nitratos y nitritos.
Los humanos han cambiado radicalmente las proporciones naturales de nitratos y nitritos, mayormente debido a la aplicación de estiércoles que contienen nitrato. El nitrógeno es emitido en grandes cantidades por las industrias. A lo largo de la historia, se nota un incremento de la presencia de nitratos y nitritos en el suelo y en el agua como consecuencia de reacciones que tienen lugar en el ciclo del nitrógeno. Esto se refleja en un incremento de la concentración de nitrógeno en las fuentes utilizadas para consumo humano, y por ende también en el agua potable.
Los nitratos y nitritos son conocidos por causar varios efectos sobre la salud humana. Estos son los efectos más comunes:[39]
- Tiene reacciones con la hemoglobina en la sangre, causando una disminución en la capacidad de transporte de oxígeno por la sangre. (nitrito)
- Provoca la disminución del funcionamiento de la glándula tiroidea. (nitrato)
- Ocasiona un bajo almacenamiento de la vitamina A. (nitrato)
- Favorece la producción de nitrosaminas, las cuales son conocidas como una de las causas más comunes de cáncer. (nitratos y nitritos)
Desde un punto de vista metabólico, el óxido de nitrógeno (NO) es mucho más importante que el nitrógeno. En 1987, Salvador Moncada descubrió que este era un mensajero vital del cuerpo para la relajación de los músculos, y hoy se sabe que está involucrado en el sistema cardiovascular, el sistema inmunitario, el sistema nervioso central y el sistema nervioso periférico. La enzima que produce el óxido nítrico, la óxido-nítrico sintasa, es abundante en el cerebro.[40]
Aunque el óxido nítrico tiene una vida relativamente corta, se puede difundir a través de las membranas para llevar a cabo sus funciones. En 1991, un equipo encabezado por K. E. Anderson del hospital universitario de Lund, Suecia, demostró que el óxido nítrico activa la erección por medio de la relajación del músculo que controla el flujo de sangre en el pene. La droga Viagra trabaja liberando óxido nítrico para producir el mismo efecto.[41]
Véase también
Referencias
- NASA Earth Fact Sheet, (actualizado al 17 de noviembre de 2010). Consultado el 26 de febrero de 2013.
- Energías de enlace comunes (D) y longitudes de enlace (r). wiredchemist.com
- Greenwood y Earnshaw, pp. 406-07
- Rutherford, Daniel (1772) "Dissertatio Inauguralis de aere fixo, aut mephitico]" (Disertación inaugural sobre el aire [llamado] fijo o mefítico), disertación de doctorado, Universidad de Edimburgo, Escocia. Traducción al inglés: Dobbin, Leonard (1935). «Daniel Rutherford's inaugural dissertation». Journal of Chemical Education 12 (8): 370-75. Bibcode:1935JChEd..12..370D.
- Weeks, Mary Elvira (1932). «El descubrimiento de los elementos. IV. Tres gases importantes». Journal of Chemical Education 9 (2): 215. Bibcode:1932JChEd...9..215W. doi:10.1021/ed009p215.
- Aaron J. Ihde, The Development of Modern Chemistry, Nueva York 1964.
- Carl Wilhelm Scheele, Chemische Abhandlung von der Luft und dem Feuer [Tratado químico sobre el aire y el fuego] (Upsala, Suecia: Magnus Swederus, 1777; y Leipzig, (Alemania): Siegfried Lebrecht Crusius, 1777). En la sección titulada "Die Luft muß aus elastischen Flüßigkeiten von zweyerley Art, zusammengesetzet seyn". (El aire debe estar compuesto por fluidos elásticos de dos clases), pp. 6-14, Scheele presenta los resultados de ocho experimentos en los que se hizo reaccionar el aire con diversas sustancias. Concluyó (p. 13): "Así veo yo en los experimentos realizados, que el aire está compuesto por dos fluidos diferentes, de los cuales el primero no tiene el efecto del flogisto, y el segundo tiene la misma fuerza de atracción, y está compuesto por el 3:10 y el 4:10 de la masa de aire total". (Así veo [esto] por los experimentos [que se] realizaron: que el aire consiste en dos fluidos [que] difieren entre sí, de los cuales el uno no expresa en absoluto la propiedad de atraer el flogisto; el otro, sin embargo, es capaz de tal atracción y que constituye entre 1/3 y 1/4 de la masa total del aire.)
- Priestley, Joseph (1772). «Observations on different kinds of air». Philosophical Transactions of the Royal Society of London 62: 147-256. S2CID 186210131. ; ver p. 225.
- Priestley, Joseph (1772). «Observations on different kinds of air». Philosophical Transactions of the Royal Society of London 62: 147-256. S2CID 186210131. doi:10.1098/rstl.1772.0021. ; ver: "VII. Del aire infectado con los humos del carbón vegetal encendido". pp. 225-28.
- Lavoisier, Antoine con Robert Kerr, trans., Elements of Chemistry, 4ª ed. (Edimburgo, Escocia: William Creech, 1799). (Edimburgo, Escocia: William Creech, 1799), pp. 85-86. [p. 85]: "Al reflexionar sobre las circunstancias de este experimento, percibimos fácilmente; que el mercurio, durante su calcinación [es decir, su tostado en el aire], absorbe la parte salubre y respirable del aire, o, para hablar más estrictamente, la base de esta parte respirable; que el aire restante es una especie de mefitis [es decir, un gas venenoso emitido por la tierra], incapaz de soportar la combustión o la respiración; ... " [p. 86]: "Más adelante demostraré que, al menos en nuestro clima, el aire atmosférico está compuesto de aire respirable y mefítico, en la proporción de 27 y 73; ..."
- Lavoisier, Antoine con Robert Kerr, trans., Elements of Chemistry, 4ª ed., Edimburgo, Escocia: William Kerr. (Edimburgo, Escocia: William Creech, 1799), p. 101: "Siendo hasta ahora poco conocidas las propiedades químicas de la parte nociva del aire atmosférico, nos hemos conformado con derivar el nombre de su base de su conocida cualidad de matar a los animales que se ven obligados a respirarlo, dándole el nombre de azot, de la partícula privativa griega α y ξωη, vita; de ahí que el nombre de la parte nociva del aire atmosférico sea gas azótico. "
- Chaptal, J. A. y Nicholson, William trans. (1800) Elements of Chemistry, 3ª ed. Londres, Inglaterra: C.C. y J. Robinson, vol. 1. pp. xxxv-xxxvi: "Para corregir la Nomenclatura sobre este punto [es decir, a este respecto], no es necesario más que sustituir a [es decir, por] esta palabra una denominación que se derive del sistema general utilizado; y he presumido de proponer la de Gas Nitrógeno. En primer lugar, se deduce de la propiedad característica y exclusiva de este gas, que forma el radical del ácido nítrico. Por este medio conservaremos a las combinaciones [es decir, a los compuestos] de esta sustancia las denominaciones recibidas [es decir, prevalecientes], como las de Ácido Nítrico, Nitratos, Nitritos, &c."
- nitrón. Etymonline.com. Recuperado 2011-10-26.
- Strutt, R. J. (1911) "Bakerian Lecture. Una modificación químicamente activa del nitrógeno, producida por la descarga eléctrica". Proceedings of the Royal Society A, 85 (577): 219-29.
- El nitrógeno activo de Lord Rayleigh Archivado el 1 de noviembre de 2012 en Wayback Machine.. Lateralscience.co.uk. Recuperado 2011-10-26.
- Erisman, Jan Willem; Sutton, Mark A.; Galloway, James; Klimont, Zbigniew; Winiwarter, Wilfried (2008). «Cómo un siglo de síntesis de amoniaco cambió el mundo». Nature Geoscience 1 (10): 636. Bibcode:2008NatGe...1..636E. doi:10.1038/ngeo325.
- Ostwald, Wilhelm, ed. (9 de enero de 1902). Mejoras en la fabricación de ácido nítrico y óxidos de nitrógeno.
- Ostwald, Wilhelm, ed. (18 de diciembre de 1902). Mejoras en y relacionadas con la fabricación de ácido nítrico y óxidos de nitrógeno.
- Greenwood y Earnshaw, pp. 411-12
- Greenwood y Earnshaw, p. 550
- Kaupp, Martin (1 de diciembre de 2006). «El papel de los nodos radiales de los orbitales atómicos para el enlace químico y la tabla periódica». Journal of Computational Chemistry 28 (1): 320-25. PMID 17143872. S2CID 12677737. doi:10.1002/jcc.20522.
- Bethe, H. A. (1939). «Producción de energía en las estrellas». Physical Review 55: 434-56. Bibcode:1939PhRv...55..434B. PMID 17835673. doi:10.1103/PhysRev.55.434.
- CIAAW (2003). «Peso atómico del nitrógeno». ciaaw.org. CIAAW. Consultado el 13 de octubre de 2016.
- Flanagan, Lawrence B.; Ehleringer, James R.; Pataki, Diane E. (15 de diciembre de 2004). Stable Isotopes and Biosphere - Atmosphere Interactions: Processes and Biological Controls. pp. 74-75. ISBN 978-0-08-052528-0.
- Greenwood y Earnshaw, p. 408
- «Evaluated Nuclear Data File (ENDF) Retrieval & Plotting». National Nuclear Data Center.
- Arthur G Palmer (2007). Protein NMR Spectroscopy. Elsevier Academic Press. ISBN 978-0-12-164491-8.
- Katzenberg, M. A. (2008). «Capítulo 13: Análisis de isótopos estables: A Tool for Studying Past Diet, Demography, and Life History». Antropología biológica del esqueleto humano (2nd edición). ISBN 978-0-471-79372-4.
- Brian Chelius (2005). «Airplane Wheel and Tire Servicing». www.boeing.com. Consultado el 14 de diciembre de 2016.
- Asimov, Isaac (2014). Breve historia de la química: Introducción a las ideas y conceptos de la química. Alianza Editorial (El Libro de Bolsillo). p. 81. ISBN 978-84-206-6421-7.
- Asimov, Isaac (2014). Breve historia de la química: Introducción a las ideas y conceptos de la química. Alianza Editorial (El Libro de Bolsillo). pp. 69-70. ISBN 978-84-206-6421-7.
- Asimov, Isaac (1999). Momentos estelares de la ciencia. Alianza. 842063980X.
- Asimov, Isaac (2014). Breve historia de la química: Introducción a las ideas y conceptos de la química. Alianza Editorial (El Libro de Bolsillo). p. 83. ISBN 978-84-206-6421-7.
- Salvat, Juan (1970). Diccionario enciclopédico Salvat universal. Salvat. 8434532212.
- Campbell, Neil A.; Reece, Jane B. (1 de enero de 2007). Biología. Ed. Médica Panamericana. ISBN 9788479039981. Consultado el 14 de diciembre de 2016.
- Chaillou, Sylvain; Lamaze, Thierry (2001). «Ammoniacal Nutrition of Plants». En Jean-Francois Morot-Gaudry, ed. Nitrogen assimilation by plants: physiological, biochemical and molecular aspects. Science Publishers. ISBN 1-57808-139-4. OCLC 44702175.
- Grignon, Claude; Thibaud, Jean-Baptiste; Lamaze, Thierry (2001). «Transport of Nitrate by Roots». En Jean-Francois Morot-Gaudry,, ed. Nitrogen assimilation by plants : physiological, biochemical and molecular aspects. Science Publishers. ISBN 1-57808-139-4. OCLC 44702175.
- Jean-Francois, Morot-Gaudry (2001). Nitrogen assimilation by plants : physiological, biochemical and molecular aspects. Science Publishers. OCLC 44702175.
- Mayor información sobre los efectos en la salud humana.
- «El sistema nervioso central humano». p. 431.
- «Fisiología Humana». p. 198.
Enlaces externos
 Wikimedia Commons alberga una galería multimedia sobre Nitrógeno.
Wikimedia Commons alberga una galería multimedia sobre Nitrógeno.- Enciclopedia Libre.
- WebElements.com – Nitrógeno.
- EnvironmentalChemistry.com – Nitrógeno.
- It's Elemental – Nitrógeno.
- Schenectady County Community College – Nitrógeno.
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del nitrógeno licuado.
- Termoquímica, Configuración Electrónica y la Vinculación, Isótopos, y Reacciones.