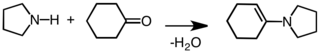Pirrolidina
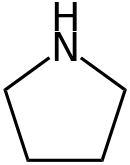
La pirrolidina, también conocido como tetrahidropirrol, es un compuesto orgánico con fórmula (CH2)4NH. Se trata de una amina heterocíclica secundaria de cinco miembros, siendo el heterociclo saturado (sin dobles enlaces).
| Pirrolidina | ||
|---|---|---|
 | ||
 | ||
| Nombre IUPAC | ||
| Pirrolidina | ||
| General | ||
| Otros nombres |
Azolidina Azaciclopentano Tetrahidropirrol | |
| Fórmula semidesarrollada | CH2(CH2)3NH | |
| Fórmula molecular | C4H9N | |
| Identificadores | ||
| Número CAS | 123-75-1[1] | |
| Número RTECS | UX9650000 | |
| ChEBI | 33135 | |
| ChEMBL | CHEMBL22830 | |
| ChemSpider | 29008 | |
| PubChem | 31268 | |
|
C1CCNC1
| ||
| Propiedades físicas | ||
| Apariencia | Líquido transparente e incoloro | |
| Olor | Amoniacal | |
| Densidad | 856 kg/m³; 0,856 g/cm³ | |
| Masa molar | 7112 g/mol | |
| Punto de fusión | −63 | |
| Punto de ebullición | 87 °C (360 K) | |
| Temperatura crítica | 568,6 K (295 °C) | |
| Presión de vapor | 58,6 ± 0,2 mmHg | |
| Viscosidad | 6,15 × 10-3 Pa.s | |
| Índice de refracción (nD) | 1,4431 | |
| Propiedades químicas | ||
| Acidez | 11,27 pKa | |
| Solubilidad en agua | 5,6 × 102 g/L | |
| log P | 0,37 | |
| Familia | Amina | |
| Peligrosidad | ||
| Punto de inflamabilidad | 275,15 K (2 °C) | |
| Compuestos relacionados | ||
| Heterociclos nitrogenados |
Pirrol Pirimidina Piperidina Piperazina Azepano Azocano Azecano | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
De forma general, se conocen como pirrolidinas a los miembros de una clase de aminas heterocíclicas que tienen un anillo saturado de cinco átomos. Esta estructura cíclica está compuesta por un átomo de nitrógeno y cuatro de carbono. Químicamente son consideradas como compuestos orgánicos heteromonocíclicos y compuestos heterocíclicos nitrogenados.[2]
Propiedades físicas y químicas
La pirrolidina es un líquido incoloro con un penetrante olor amoniacal o a semen,[3] y un sabor fuerte, también amoniacal. Su punto de ebullición es de 87 °C y su punto de fusión -63 °C. Menos denso que el agua (ρ = 0,856 g/cm³), es soluble en etanol y éter, además de ser miscible en agua. En cloroformo y benceno es sólo ligeramente soluble. El valor del logaritmo de su coeficiente de reparto, logP = 0,37, indica una solubilidad algo mayor en disolventes apolares que en disolventes polares. Su vapor es 2,5 veces más denso que el aire.[4][5]
En comparación con aminas secundarias acíclicas, la pirrolidina es cerca de unas diez veces más básica (pKa = 11,27). Por ello, neutraliza ácidos en reacciones exotérmicas formando sales y agua. Al combinarse con agentes reductores fuertes como hidruros, puede generar hidrógeno gaseoso.[6]
Síntesis
La pirrolidina se suele sintetizar por reducción del pirrol, reacción que puede ser catalizada por nanopartículas de rutenio sobre óxido de magnesio.[7]
También puede ser obtenida a partir de butanodiol y amoníaco, bien empleando un catalizador de óxido de aluminio-torio a 300 °C o bien sobre un catalizador de níquel a 200 °C y 20 MPa en condiciones de hidrogenación. Otra vía de síntesis consiste en hacer reaccionar tetrahidrofurano y amoníaco en presencia de óxido de aluminio a una temperatura de 275-375 °C.[5]
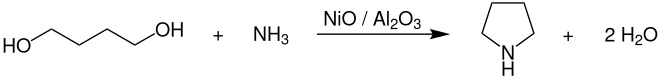
La pirrolidina también se genera por la reacción de 1,4-dihidroxialcanos con aminas en presencia de agentes deshidratantes a temperaturas elevadas, o por reacción entre aminas primarias y 1,4-dihaloalcanos. Asimismo, la destilación en seco de dihidrocloruro de 1,4-butanodiamina también produce esta amina.[5]
Aplicaciones
La pirrolidina se utiliza como bloque de construcción en la síntesis de compuestos más complejos. En química orgánica, la pirrolidina se emplea para activar cetonas y aldehídos hacia la adición nucleófila por formación de enaminas:[8]
De esta manera, el grupo carbonilo es mucho más sensible a una adición nucleófila. Este método es también una alternativa a la formación de enolatos de cetonas utilizando bases fuertes tales como LDA.
Precauciones
La pirrolidina es un compuesto muy inflamable que al arder desprende gases tóxicos e irritantes. Su punto de inflamabilidad es 2 °C. La mezcla del vapor de esta amina con el aire puede ser explosiva.[5]
Esta sustancia puede ser tóxica si se inhala o ingiere. Su contacto puede ocasionar severas quemaduras en piel y ojos.[6]
Véase también
Los siguientes compuestos contienen una anillo de pirrolidina en su estructura:
- Metilpirrolidina
- 2-metilpirrolidina
- 3-pirrolidinamina
- 1-(2-aminoetil)pirrolidina
- 2-aminometil-1-etilpirrolidina
- 4-(1-pirrolidinil)-piperidina
Los siguientes compuestos son aminas heterocíclicas:
- Piperidina
- Piperazina
- Imidazolidina
- Pirazolidina
Referencias
- Número CAS
- Chebi. «Pyrrolidines» (en inglés). Consultado el 20 de enero de 2013.
- John E. Amoore, L. Janet Forrester, Ron G. Buttery (1975). «Specific anosmia to 1-pyrroline: The spermous primary odor». Journal of Chemical Ecology 1 (3): 299-310. Consultado el 12 de mayo de 2014.
- Pyrrolidine (ChemSpider)
- Pyrrolidine (PubChem)
- Pyrrolidine (Chemical Book)
- Minfeng Fang, Roberto A. Sánchez-Delgado (2014). «Ruthenium nanoparticles supported on magnesium oxide: A versatile and recyclable dual-site catalyst for hydrogenation of mono- and poly-cyclic arenes, N-heteroaromatics, and S-heteroaromatics». Journal of Catalysis 311: 357-368. Consultado el 12 de junio de 2016.
- R. B. Woodward, I. J. Pachter, and M. L. Scheinbaum (1974). "2,2-(Trimethylenedithio)cyclohexanone". Org. Synth. 54: 39; Coll. Vol. 6: 1014.