Subtilisina
La subtilisina (serina endopeptidasa) es una proteasa (una enzima que realiza la digestión de las proteínas que inicialmente se obtuvo de la bacteria Bacillus subtilis).
| Subtilisina | ||||
|---|---|---|---|---|
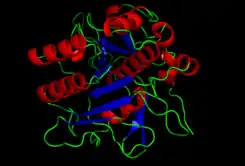 Estructura cristalográfica de la subtilisina | ||||
| Estructuras disponibles | ||||
| PDB | ||||
| Identificadores | ||||
| Identificadores externos |
Bases de datos de enzimas
| |||
| Número EC | 3.4.21.62 | |||
| Estructura/Función proteica | ||||
| Peso molecular | 27 KDa. (Da) | |||
| Tipo de proteína | Serín proteasa | |||
| PubMed (Búsqueda) |
| |||
| PMC (Búsqueda) |
| |||
Pertenece al grupo de las Serín proteasas que inician el ataque nucleofílico en el enlace peptídico (amida) mediante un residuo de serina en su centro activo. Son enzimas bien caracterizadas tanto física como químicamente. Típicamente tienen un peso molecular entre 20-45 KDa.. Se puede obtener a partir de bacterias del suelo, por ejemplo de Bacillus amyloliquefaciens. Las subtilisinas son secretadas en grandes cantidades por muchas especies del género Bacillus.
Las subtilisinas están ampliamente utilizadas en productos comerciales, por ejemplo en detergentes de uso doméstico, procesamiento de alimentos,[1] cosméticos,[2] líquidos limpiadores de lentes de contacto y también en la investigación y síntesis de compuestos orgánicos.
La estructura de la subtilisina ha sido determinada mediante cristalografía de rayos X. Es una proteína globular de 275 residuos con varias alfa-hélices y una gran lámina Beta. Estructuralmente no está relacionada con el grupo de la quimotripsina de las serín proteasas, aunque utiliza el mismo tipo de tríada catalítica (serina, ácido aspártico e histidina) en su centro activo. Esto constituye un ejemplo clásico de convergencia evolutiva.
Sitio de relevo de carga en la subtilisina
El centro activo despliega una red de relevo de carga que implica los aminoácidos Asp-32, His-64, y el lugar activo Ser-221 organizados según una tríada catalítica. La red de relevo de carga funciona del siguiente modo: la cadena lateral carboxilato del Asp-32 se une mediante puentes de hidrógeno a un protón unido a nitrógeno en el anillo imidazol de la His-64. Esto es posible porque el Asp está cargado negativamente a pH fisiológico. El otro nitrógeno de la His-64 se une al protón O-H de la Ser-221. Esta última interacción produce una separación de cargas en O-H, haciendo que el átomo de oxígeno sea más nucleofílico. Esto permite al átomo de oxígeno de la Ser-221 atacar a los sustratos que acceden al centro activo (es decir, enlaces peptídicos), asistido por la cadena cercana carboxiamida del of Asn-155.
Aunque en la secuencia de aminoácidos Asp-32, His-64, y Ser-221 están muy alejadas, convergen en la estructura tridimensional para formar el centro activo.
Para resumir las interacciones descritas anteriormente, la Ser-221 actúa como nucleófilo y escinde enlaces peptídicos con su átomo de oxígeno parcialmente negativo. Esto es posible debido a la naturaleza del lugar de relevo de carga de la subtilisina.
Referencias
- «Applications of proteases in the food industry». Archivado desde el original el 11 de mayo de 2012. Consultado el 2009.
- https://web.archive.org/web/20080509093825/http://www.xenna.com/product_callex.html
- Deber, C.M. (Conferenciante). (2006, Sep. 29). BCH210H1F. [Conferencia]. Toronto: Universidad de Toronto.