Butan-1-ol
Le butan-1-ol, ou n-Butanol est un alcool primaire de formule semi-développée CH3-(CH2)3-OH. Il a pour isomères l'isobutanol, le butan-2-ol et le tert-butanol. Le butan-1-ol est un alcool dit de "fusel", produit en faible quantité lors de la fermentation alcoolique de l'éthanol.
| Butan-1-ol | |||
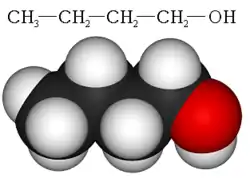
| |||
| Structure chimique du butan-1-ol | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Butan-1-ol | ||
| Synonymes |
n-Butanol |
||
| No CAS | |||
| No ECHA | 100.000.683 | ||
| No CE | 200-751-6 | ||
| PubChem | 263 | ||
| FEMA | 2178 | ||
| Apparence | liquide incolore, d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule | C4H10O [Isomères] |
||
| Masse molaire[2] | 74,121 6 ± 0,004 2 g/mol C 64,82 %, H 13,6 %, O 21,59 %, |
||
| Moment dipolaire | 1,66 ± 0,03 D [3] | ||
| Diamètre moléculaire | 0,558 nm [4] | ||
| Propriétés physiques | |||
| T° fusion | −90 °C[1] | ||
| T° ébullition | 117 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 77 g·l-1[1], complète dans les solvants polaires organiques (Éther, autres alcools). |
||
| Paramètre de solubilité δ | 23,3 MPa1/2 (25 °C)[5] | ||
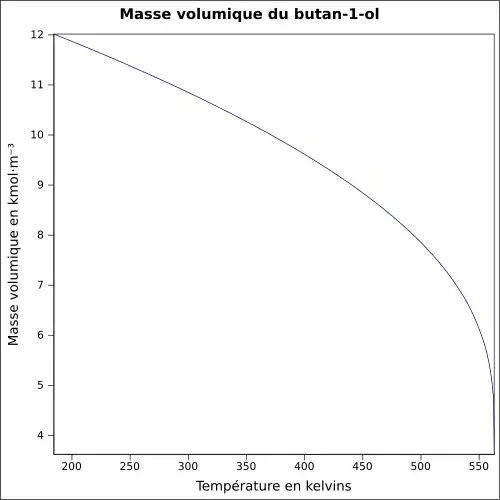
| Masse volumique | 0,8 g·cm-3[1]
|
||
| T° d'auto-inflammation | 345 °C[1] | ||
| Point d’éclair | 29 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 1,4–11,3 %vol[1] | ||
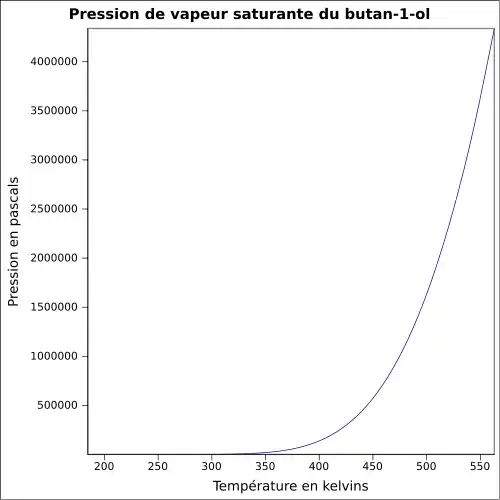
| Pression de vapeur saturante | à 20 °C : 0,6 kPa[1]
|
||
| Point critique | 289,85 °C, 4,41 MPa, 0,274 l·mol-1[7] | ||
| Vitesse du son | 1 258 m·s-1 à 20 °C [8] | ||
| Thermochimie | |||
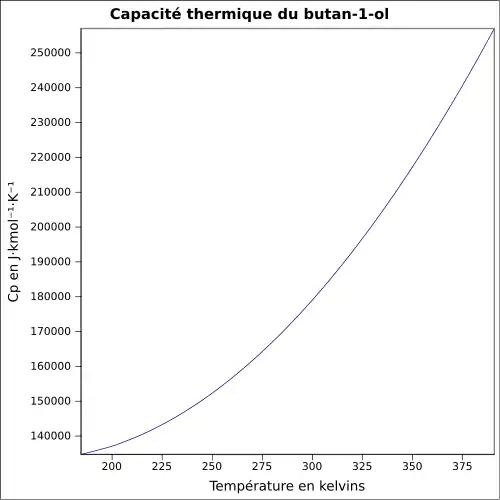
| Cp | |||
| PCS | 36,1 MJ·kg-1[10] | ||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,99 ± 0,05 eV (gaz)[11] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,3974 [4] | ||
| Précautions | |||
| SGH[12] | |||
   Danger |
|||
| SIMDUT[13] | |||
  B2, D2B, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| LogP | 0,9[1] | ||
| Seuil de l’odorat | bas : 0,12 ppm haut : 11 ppm[14] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
On le trouve naturellement dans de nombreux aliments et boissons.
Production
Depuis les années 50, la majorité du butan-1-ol est produit par l'hydroformylation du propène (procédé oxo) pour former du butanal. Les catalyseurs habituels sont à base de cobalt ou de rhodium. Le butanal est ensuite hydrogéné pour produire le butan-1-ol.

Une deuxième méthode pour produire du butan-1-ol est la carbonylation du propène avec du monoxyde de carbone et de l'eau.
Autrefois, le butan-1-ol était produit à partir de crotonaldéhyde, qui peut être obtenue à partir d'éthanal.
Le butan-1-ol peut aussi être produit par la fermentation de matière végétale par des bactéries. Avant les années 50, Clostridium acetobutylicum était utilisé en fermentation industrielle pour produire du butanol.
Utilisations
La majorité (85%) du butan-1-ol est utilisé dans la production de vernis. C'est un solvant populaire, par exemple pour la nitrocellulose. Une multitude d'esters butyliques sont utilisés comme solvants comme le 2-Buthoxyéthanol. De nombreux plastifiants sont à base d'esters butyliques comme le phtalate de dibutyle. L'acrylate de butyle est un monomère utilisé pour produire des polymères. C'est le précurseur aux n-butylamines.
Biocarburant
Le butan-1-ol a été proposé comme un substitut pour le gazole et l'essence. Il est produit en faible quantités dans la plupart des fermentations (voir alcools de fusel), mais certaines espèces de Clostridium ont des rendements de butan-1-ol bien plus importants, et des recherches sont en cours pour augmenter le rendement total de biobutanol à partir de biomasse.
Le butan-1-ol est considéré un biocarburant potentiel. Le butan-1-ol à 85% peut être utilisé dans des voitures à essence sans aucun changement au moteur (contrairement à de l'éthanol à 85%), et il fournit plus d'énergie que l'éthanol pour un volume équivalent grâce à la concentration inférieure d'oxygène du butan-1-ol, et presque autant que de l'essence. Par conséquent, un véhicule fonctionnant au butan-1-ol aurait une consommation de carburant plus comparable à celle de l'essence que de l'éthanol. Le butan-1-ol peut aussi être ajouté à du gazole pour réduire les émissions de suie.
Références
- 1 - BUTANOL, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) Claudio A. Faúndez et José O. Valderrama, « Activity Coefficient Models to Describe Vapor-Liquid Equilibrium in Ternary Hydro-Alcoholic Solutions », Chinese Journal of Chemical Engineering, vol. 17, no 2, , p. 259-267 (DOI 10.1016/S1004-9541(08)60203-7)
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 93e éd., 2670 p. (ISBN 9781439880494, présentation en ligne), p. 5-69
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Alcool butylique normal » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « n-Butyl alcohol », sur hazmap.nlm.nih.gov (consulté le )
- Portail de la chimie