Hydrocarbure aromatique polycyclique
Les hydrocarbures aromatiques polycycliques (HAP) sont une sous-famille des hydrocarbures aromatiques, c'est-à-dire des molécules constituées d’atomes de carbone et d’hydrogène mais dont la structure comprend au moins deux cycles aromatiques condensés.
Pour les articles homonymes, voir HAP.
Depuis de nombreuses années, les HAP sont très étudiés car ce sont des composés présents dans tous les milieux environnementaux et qui montrent une forte toxicité. D’ailleurs, c’est une des raisons qui ont conduit à leur ajout dans la liste des polluants prioritaires par l’agence de protection de l'environnement des États-Unis (EPA US Environmental Protection Agency), dès 1976. Aujourd’hui, ils font également partie des listes de l’OMS (Organisation mondiale de la santé) et de la Communauté européenne. Bien qu'ils ne soient pas cités dans la liste déclaratoire de la convention de Stockholm portant sur les polluants organiques persistants (POP)[2], ils sont répertoriés en tant que tels dans le protocole d'Aarhus (en)[3].
Les HAP semblent par ailleurs jouer un rôle majeur dans le milieu interstellaire.
Généralités
Selon le nombre de cycles, les hydrocarbures aromatiques polycycliques (HAP) sont classés en HAP légers (jusqu’à trois cycles) ou lourds (au-delà de trois cycles), et ont des caractéristiques physico-chimiques et toxicologiques très différentes.
Le nombre de HAP susceptibles d’être rencontrés est sans limite. En effet, non seulement il n’y a pas de limite au nombre de noyaux accolés, mais le nombre d’isomères augmente considérablement avec le nombre de cycles aromatiques. De plus, ils peuvent être alkylés.
Les HAP purs sont des substances colorées et cristallines à température ambiante. Les propriétés physiques des HAP varient selon leur masse moléculaire et leur structure. À l’exception du naphtalène, les HAP sont très hydrophobes, et donc leurs solubilités dans l’eau sont faibles. Parallèlement, leurs coefficients de partage octanol/eau (Kow) sont relativement élevés, témoignant d’un important potentiel d’adsorption sur les matières organiques particulaires en suspension dans l’air ou dans l’eau, ainsi que d’un fort potentiel de bioconcentration dans les organismes.
Principaux HAP
| Composé chimique | Composé chimique | ||
|---|---|---|---|
| Anthracène | Benzo[a]pyrène | 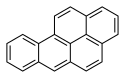 | |
| Chrysène | 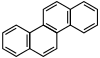 | Coronène | 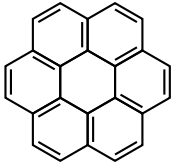 |
| Corannulène | 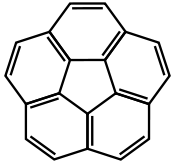 | Tétracène | |
| Naphtalène | Pentacène | ||
| Phénanthrène | Pyrène | 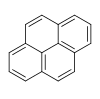 | |
| Triphénylène |  | Ovalène | 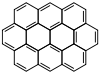 |
Sources des HAP
La formation des HAP peut avoir de nombreuses origines qui peuvent être regroupées en trois catégories. On peut distinguer les origines pyrolytiques, diagénétiques et pétrogéniques. Cependant, les deux dernières sont négligeables dans l’atmosphère, en comparaison des sources pyrolytiques.
HAP d'origine pyrolytique
Avant l’utilisation du charbon, du pétrole et du gaz naturel comme sources d’énergie, l’apport de HAP d’origine pyrolytique était principalement dû à des phénomènes naturels tels que les feux de forêt et de prairies. Aujourd’hui, c’est l’origine pyrolytique anthropique qui est considérée comme la source majeure de HAP dans l’environnement, notamment à cause des émissions domestiques et industrielles. Les HAP pyrolytiques sont générés par des processus de combustion incomplète de la matière organique à haute température. Les mécanismes mis en jeu lors de leur formation font intervenir la production de radicaux libres par pyrolyse à haute température (≥ 500 °C) de la matière fossile (pétroles, fioul, matières organiques, etc.) dans des conditions déficientes en oxygène. Les HAP d’origine pyrolytique proviennent de la combustion du carburant automobile, de la combustion domestique (charbon, bois…), de la production industrielle (aciéries, alumineries…), de la production d’énergie (centrales électriques fonctionnant au pétrole ou au charbon…) ou encore des incinérateurs.
Également, une partie des HAP présents dans l’environnement provient de processus naturels tels que les éruptions volcaniques.
En fonction de l’origine, certains HAP se formeront préférentiellement. Ceci permet de les utiliser comme indicateurs d’origine. Ainsi, les rapports de concentration en différents HAP permettent de calculer des indices moléculaires. Par exemple, si le rapport de la concentration en anthracène sur celle du phénantrène est supérieur à 10, alors l’origine sera pétrogénique tandis que s'il est inférieur à 10, il sera d’origine pyrolytique.
En France, les émissions anthropiques de HAP sont dominées par le secteur domestique (69 %), du fait de la consommation énergétique (notamment les chaudières 64 % et le chauffage au bois 4,8 %). Ensuite viennent le secteur des transports routiers, notamment des véhicules diesel (8 %), puis celui de l’industrie manufacturière[4].
Cinétique environnementale
Les HAP sont hydrophobes ; ils ne persistent donc pas facilement dans l'eau, sauf associés à des surfactants ou adsorbés sur des particules en suspension ou dans le sédiment ; Ils sont surtout présents dans les sols où ils peuvent être stockés ou circuler (adsorption, percolation, bioturbation), mais ils peuvent contaminer l'air en phase vapeur, et être présents dans l'eau ou dans le biofilm. Ils peuvent passer d'un compartiment environnemental (eau, air, sol) à l'autre.
Concentrations atmosphériques
Dans l’atmosphère, les concentrations de HAP particulaires sont très variables. En effet, les concentrations peuvent être faibles dans les lieux reculés, comme l’Antarctique où on retrouve quelques dizaines de pg/m3, et élevées en ville, à proximité de voies routières, où les concentrations peuvent atteindre quelques centaines de ng/m3, comme à Santiago du Chili.
En milieu urbain, les taux de HAP varient de 2 à 300 ng/m3, voire plus. Ces valeurs tendent à diminuer dans les pays riches, compte tenu de l’avancée des technologies sur la limitation des émissions automobiles (réduction de la consommation, utilisation de pots catalytiques, développement des filtres à particules, etc.).
Il existe une variabilité saisonnière, marquée par des concentrations plus importantes en hiver, surtout pour les HAP particulaires, et expliquée principalement par quatre processus :
- les variations des émissions dues au chauffage domestique ;
- les processus de dégradation des HAP (car la photodégradation par les UV solaires se fait de moins en moins en hiver, qui est aussi le moment où l'on se chauffe le plus) ;
- la température plus faible qui fait que les HAP auront tendance à rester en phase particulaire ;
- une plus grande stabilité de la colonne atmosphérique en hiver (hors moments venteux), ou phénomènes d'inversions atmosphériques limitant la dispersion.
Des variations importantes existent entre les différents lieux de prélèvements et pour les différents HAP.
En s’éloignant des sources de combustions, les concentrations en HAP diminuent très rapidement. En milieu rural, les concentrations sont très faibles. Cependant, les HAP sont présents sur toute la planète du fait du transport atmosphérique.
Les sols pollués de certaines friches industrielles (carbochimie, pétrochimie en particulier) ou urbaines (anciennes stations d'essence…) peuvent contenir des taux élevés de HAP, parfois très perceptibles par l'odorat humain.
Toxicité
L’une des raisons ayant conduit au classement des HAP dans la liste des polluants prioritaires de l’EPA est le caractère toxique de certains d’entre eux. Ce sont des molécules biologiquement actives qui, une fois absorbées par les organismes, se prêtent à des réactions de transformation sous l’action d’enzymes conduisant à la formation d’époxydes et/ou de dérivés hydroxylés. Les métabolites ainsi formés peuvent avoir un effet toxique plus ou moins marqué en se liant à des molécules biologiques fondamentales telles que les protéines, l’ARN, l’ADN et provoquer des dysfonctionnements cellulaires.
Dans l'alimentaire, la consommation de produits mettant en œuvre certains procédés de séchage, fumage, grillage[5] ou cuisson à haute température, peut fournir un apport très faible en HAP d'origine pyrolytique et en AHC (Amines Hétérocycliques (en)). Ce constat a conduit à multiplier les règlementations, par exemple dans l'Union européenne[6].
| HAP | Toxicité | Cancérogénèse | Mutagenèse | Rapporté dans |
|---|---|---|---|---|
| Naphtalène | Modérée | Non confirmée | EPA-TSCA | |
| Acénaphtène | Modérée | Constatée | EPA-TSCA | |
| Acénaphtylène | Modérée | Constatée | EPA-TSCA | |
| Fluorène | Faible | Constatée | EPA-TSCA, CIRC | |
| Phénanthrène | Modérée | Constatée | EPA-TSCA, CIRC | |
| Anthracène | Modérée | Constatée | EPA-TSCA, CIRC | |
| Fluoranthène | Modérée | Non confirmée | Constatée * | EPA-TSCA, CIRC |
| Pyrène | Modérée | Non confirmée | Constatée * | EPA-TSCA, CIRC |
| Benzo[a]anthracène | Élevée | Confirmée | Constatée * | EPA-TSCA, CIRC |
| Chrysène | Confirmée | Constatée * | EPA-TSCA, CIRC | |
| Benzo[b]fluoranthène | Confirmée | Constatée | CIRC | |
| Benzo[k]fluoranthène | Confirmée | Constatée | CIRC | |
| Benzo[a]pyrène | Élevée | Confirmée | Constatée * | EPA-TSCA, CIRC |
| Benzo[e]pyrène | Non confirmée | Constatée * | CIRC | |
| Indéno[1,2,3-cd]pyrène | Confirmée | Constatée | EPA-TSCA, CIRC | |
| Benzo[ghi]pérylène | Non confirmée | Constatée | CIRC | |
| Dibenzo[a,h]anthracène | Élevée | Confirmée | Constatée * | EPA-TSCA, CIRC |
- (*) Mutagène pour l’Homme ;
- CIRC : Centre international de recherche sur le cancer ;
- EPA-TSCA : Environmental Protection Agency - Toxic Substances Control Act.
Synergies toxiques
De telles synergies (effets additionnels voire multiplicatifs) peuvent exister entre HAP et d'autres produits toxiques, dont :
- synergie entre HAP et métaux, par exemple avec le cuivre (déplétion de la croissance et de la photosynthèse aggravée en présence de HAP et Cu[8] ;
- synergie (multiplicative) pour certains cancers entre HAP et gaz d'échappement de moteur diesel [9].
Benzo[a]pyrène
Le benzo[a]pyrène (B[a]P) est un des HAP les plus toxiques. En effet, il est reconnu comme cancérogène par l’IARC (International Association for Research on Cancer). Ceci est lié à sa capacité à former des adduits avec l’ADN. Il existe plusieurs voies d’activation du B[a]P, mais la plus importante est celle des diols époxydes car elle conduit à la formation d’adduits stables. Le B[a]P va être oxydé par les systèmes enzymatiques du cytochrome P450, pour finalement former un époxyde. Ce dernier produit, le benzo[a]pyrène-7,8-dihydrodiol-9,10-époxyde (BPDE), est susceptible de réagir avec l’ADN. Ainsi, la toxicité du benzo[a]pyrène est en partie directement liée au pouvoir cancérogène de l’un de ses métabolites, le BPDE, qui se fixe au niveau de l’ADN des cellules et entraîne des mutations pouvant à terme aboutir au développement de cancers.
Outre leurs propriétés cancérogènes, les HAP présentent un caractère mutagène dépendant de la structure chimique des métabolites formés. Ils peuvent aussi entraîner une diminution de la réponse du système immunitaire augmentant ainsi les risques d’infection.
Partition gaz/particule
À l’issue des processus de formation essentiellement pyrolytiques, les HAP sont émis dans l’atmosphère, compartiment à partir duquel ils peuvent ensuite se disperser dans les autres compartiments de l’environnement. Durant leur temps de résidence dans l’atmosphère, les HAP coexistent à la fois en phase gazeuse et en phase particulaire.
Ce qui détermine la répartition des HAP entre la phase gazeuse et la phase particulaire, c’est la pression de vapeur saturante des composés. En effet, les HAP les plus légers, dont les pressions de vapeur saturante sont élevées, seront majoritairement présents dans la phase gazeuse alors que les HAP les plus lourds, dont les pressions de vapeur saturante sont plus faibles, seront plutôt liés à la phase particulaire. En général, les composés possédant deux cycles benzéniques seront présents en phase gazeuse alors que ceux possédant plus de six cycles seront plutôt rencontrés dans la phase particulaire.
Pour les composés intermédiaires (entre trois et six cycles), la répartition se fait entre la phase particulaire et la phase gazeuse. Lorsque la masse moléculaire des HAP augmente, et donc que le nombre de cycles aromatiques croît, la partition se fait en faveur de la phase particulaire. Jusqu’à quatre cycles benzéniques, les HAP sont majoritairement présents en phase gazeuse, et qu’au-delà, ils sont plutôt retrouvés en phase particulaire.
La température ambiante influence également la partition gaz/particule. En effet, la pression de vapeur saturante dépend de la température. Ainsi, plus la température augmente, plus les HAP auront tendance à être présents en phase gazeuse. D’ailleurs, il a été observé qu’en été le pourcentage des HAP en phase gazeuse est plus élevé qu’en hiver. Cependant, cette variation selon les saisons est beaucoup moins importante que celle du degré d’aromaticité des HAP.
Dégradation des HAP
La dégradation biotique
Les HAP sont dégradés par certaines bactéries présentes dans l’eau. Les bactéries présentent un potentiel important de métabolisation des HAP dans des conditions particulières. Ces conditions environnementales affectent le taux de dégradation des HAP ,la température, le pH, le taux d’oxygène, type de sol, population microbienne sont les facteurs contrôlant l’activité microbienne. La biodégradation peut se faire en présence d’oxygène comme en son absence.
Dégradation en anaérobiose
Ils peuvent subir une dégradation anaérobie. Le noyau benzénique peut être dégradé en présence de nitrates par Pseudomonas sp. et Moraxella sp. Le benzène est tout d’abord saturé en cyclohexane , puis oxydé en cétone, puis coupé par hydrolyse, pour donner finalement un acide carboxylique. Au cours de ce processus, le nitrate est réduit en azote.
Le processus de la biodégradation anaérobie dans les sédiments est lent et les voies métaboliques restent peu décrites, mais ce type de biodégradation est plus efficace.
Dégradation en aérobiose
La biodégradation aérobie est la plus rapide. Le taux de dégradation est inversement proportionnel au nombre du cycle benzénique ce qui conduit à des temps de demi-vie qui augmentent avec la taille de la molécule.
Oxydation chimique
En plus de la dégradation biologique des HAP, ces derniers peuvent être dégradés aussi par voie chimique, soit par oxydation soit par photo-oxydation sous l’action des rayonnements ultraviolets, de l’ozone, du peroxyde d’hydrogène, du dioxygène, du radical •OH et d'autres.
La photo-oxydation des HAP est une importante voie de dégradation de ces composés qui forment rapidement, après une exposition à la lumière, en effet la plupart des HAP subissent une photo-oxydation, une réaction qui joue un rôle majeur dans leur élimination de l’atmosphère. En revanche, dans l’environnement professionnel, les réactions de photo-oxydation n’ont aucun impact sur l’élimination des HAP. La contribution de la photodégradation pour la biodégradation est particulièrement importante car elle est rapide et se traduit préférentiellement par l’attaque de l’atome de carbone terminal qui tend à limiter l’attaque biologique.
La volatilisation
C’est le passage en phase gazeuse des polluants à l’interface eau-air dans les sols, avec dégazage vers l'atmosphère. Dans le sol , la volatilisation est fonction de l’humidité, du niveau d'absorption du composé. De plus, d'autres facteurs jouent un rôle au niveau de ce mécanisme, tel que la température, le vent et les perturbations atmosphériques.
Dans le milieu interstellaire
Les HAP font l'objet de recherches actives chez les astrophysiciens et astrochimistes, depuis qu'Alain Léger et Jean-Loup Puget[10] les ont proposés en 1984 comme responsables de l'émission interstellaire des bandes infrarouges entre 3 et 15 µm. Bien qu'aucune molécule HAP précise n'ait à ce jour () été identifiée, la communauté astrophysique accepte majoritairement l'hypothèse que les HAP constituent une partie des grains de poussière interstellaire et jouent un rôle majeur dans le milieu interstellaire.
Les HAP pourraient survivre à l'explosion d'une supernova, soit à une onde de choc portée à huit millions de degrés Celsius[11].
Notes et références
- Publiée par Müllen et al., Chem. Eur. J., 2000, 1834-1839
- Marc J. Olivier, Chimie de l'environnement, 5e éd., PJB Éditeur, Lévis, 2007 (ISBN 978-2-9810039-0-4), chap. 6 (« La pollution par les produits organiques anthropiques »)
- Polluants Organiques Persistants
- « Hydrocarbures Aromatiques Polycycliques - HAP », CITEPA (consulté le )
- Jérôme NORMAND, « Les résidus toxiques générés lors de la cuisson de la viande bovine, Compte rendu final no 17 07 32 024 », sur Idele.fr, (consulté le )
- « Règlement (UE) no 835/2011 de la Commission du 19 août 2011 modifiant le règlement (CE) no 1881/2006 en ce qui concerne les teneurs maximales pour les hydrocarbures aromatiques polycycliques dans les denrées alimentaires, JOCE L-215 du 20.08.2011, p. 4–8 », sur eur-lex.europa.eu (consulté le )
- « Hydrocarbures Aromatiques Polycycliques dans l’air ambiant » [PDF], sur lcqsa.org, INERIS, , p. 9, 45, 46
- Babu TS, Marder JB, Tripuranthakam S, Dixon DG, Greenberg BM (2001), Synergistic effects ofa photooxidized polycyclic aromatic hydrocarbon and copper on photosynthesis and plantgrowth: Evidence that in vivo formation of reactive oxygen species is a mechanism of coppertoxicity, Environ. Toxicol. Chem., 20:1351-1358
- Paris, C., & Stücker, I. (2016). Multi-expositions et risque de cancer: approche épidémiologique. Archives des Maladies Professionnelles et de l'Environnement, 77(3), 494-495. | résumé
- Identification of the 'unidentified' IR emission features of interstellar dust?, Leger, A. ; Puget, J. L., Astronomy and Astrophysics (ISSN 0004-6361), vol. 137, no 1, août 1984, p. L5-L8.
- (en) Linda Vu, Spitzer Searches for the Origins of Life, Achim Tappe (centre d'astrophysique de Harvard), NASA, .
Voir aussi
Bibliographie
- Anyakora, C. (2007). Polynuclear Aromatic Hydrocarbons. Tiré de : Nollet, L.M .L. (éd.), Handbook of water analysis, CRC Press, 579-598.
- European Food Safety Autority (EFSA) (2008). Polycyclic Aromatic Hydrocarbons in Food - Scientific Opinion of the Panel on Contaminants in the Food Chain. The EFSA Journal, 724, 1-114.
- Harrison, R., M., Perry, R., Wellings, R., A. (1975). Polynuclear aromatic hydrocarbons in raw, potable and waste water. Water Res., 9, 331-46.
- Haritash, A., K., Kaushik, C., P. (2009). Biodegradation aspects of polycyclic aromatic hydrocarbons (PAHs): a review. Journal of Hazardous Materials, 169, 1–15.
- Höner, A. (2001). Polycyclic aromatic hydrocarbon (PAH) metabolites. Tiré de : Kleïbohmer, W. (éd.), Environmental Analysis, Handbook of Analytical Separations, Elsevier, 3, 99-121.
- Manoli, E., Samara, C. (1999). Polycyclic aromatic hydrocarbons in natural waters: sources, occurrence and analysis. Trends in analytical chemistry, 18, 6.
- United States Environmental Protection Agency (US-EPA) (1985). Evaluation and estimation of potential carcinogenic risks of polynuclear aromatic hydrocarbons: carcinogen assessment group. Office and Health and Environmental Assessment.
- Varanasi, U. (1989). Metabolism of polycyclic aromatic hydrocarbons in the aquatic environment. CRC Press, 341 p.
- Walker, H.C. (2008). Polycyclic Aromatic Hydrocarbons. Tiré de : Organic pollutants: an ecotoxicological perspective, CRC Press, 181-192.
Articles connexes
Lien externe
- Portail de la chimie
- Portail de l’environnement