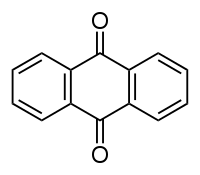
Anthraquinone
L'anthraquinone appartient à la famille chimique des hydrocarbures aromatiques polycycliques. C'est un dérivé de l'anthracène. Présent à l'état naturel chez un certain nombre d'animaux et de plantes, il est aussi une substance active de produit phytosanitaire (ou produit phytopharmaceutique, ou pesticide), qui présente un effet répulsif à l'égard des oiseaux. Isolé, il a l'apparence d'une poudre cristalline solide, du jaune et du gris-clair au gris-vert. Plus généralement, une anthraquinone est un composé chimique qui possède ce motif dans sa structure.
| Anthraquinone | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Synonymes |
9,10-dihydro-9,10-dioxoanthracène, anthradione, 9,10-anthraquinone, anthracène-9,10-quinone, Hoelite, Morkit, Corbit |
|
| No CAS | ||
| No ECHA | 100.001.408 | |
| No CE | 201-549-0 | |
| SMILES | ||
| InChI | ||
| Apparence | solide jaune ou gris-clair à gris-vert | |
| Propriétés chimiques | ||
| Formule | C14H8O2 [Isomères] |
|
| Masse molaire[1] | 208,212 1 ± 0,012 4 g/mol C 80,76 %, H 3,87 %, O 15,37 %, |
|
| Propriétés physiques | ||
| T° fusion | 286 °C | |
| T° ébullition | 379,8 °C | |
| Solubilité | 0,12 à 0,60 mg l−1 dans l'eau à 20 °C, sol. dans l'éther, le nitrobenzène, le benzène et l'aniline |
|
| Masse volumique | 1,44 g cm−3 à 20 °C | |
| Point d’éclair | 185 °C | |
| Pression de vapeur saturante | 0,000 13 mbar à 50 °C | |
| Thermochimie | ||
| Cp | ||
| Précautions | ||
| NFPA 704 | ||
| Inhalation | irritant | |
| Peau | irritant | |
| Yeux | irritant | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Les autres noms de l'anthraquinone sont 9,10-dihydro-9,10-dioxoanthracène, anthradione, 9,10-anthraquinone et anthracène-9,10-quinone, et ses noms de vulgarisation sont entre autres anthranoïde, hoelite, morkit, et corbit.
L'Autorité européenne de sécurité des aliments (EFSA) envisage de diminuer la quantité de résidus autorisés de cette molécule irritante[3].
Origines naturelles

L'anthraquinone existe à l'état naturel dans certaines plantes (la bourdaine, le séné (senna), l'aloès, la rhubarbe, un type de nerprun nord-américain parfois appelé le cascara, les champignons, les lichens, et la plupart des insectes, où il sert de squelette de base aux pigments). Les dérivés naturels de l'anthraquinone ont tendance à avoir des effets laxatifs.
Chimie
Il existe plusieurs moyens d'obtenir de l'anthraquinone :
- l'oxydation de l'anthracène ;
- la condensation du benzène avec l'acide phtalique en présence d'AlCl3 (substitution de Friedel et Crafts). Le produit de cette réaction est l'acide o-benzoylbenzoïque, qui subit ensuite une nouvelle condensation, cette fois intramoléculaire, pour former l'anthraquinone ;
- la réaction de Diels-Alder (à partir de la naphtoquinone et du buta-1,3-diène), suivie d'une oxydation ;
- la réaction de rétro-Diels-Alder.
Dans une réaction chimique classique appelée la synthèse de Bally-Scholl (1905), l'anthraquinone se condense avec le glycérol pour former le benzanthrone. Dans cette réaction, la quinone est d'abord réduite par du cuivre dans de l'acide sulfurique (transformant un groupe cétone en un groupe méthylène), puis on ajoute du glycérol.
Réglementation
Sur le plan de la réglementation des produits phytopharmaceutiques :
- pour l’Union européenne : cette substance active est en révision en vue de l’inscription à l’annexe I de la directive 91/414/CEE ;
- pour la France : cette substance active est autorisée dans la composition de préparations bénéficiant d’une autorisation de mise sur le marché.
Caractéristiques physico-chimiques
L'anthraquinone est seulement très partiellement soluble dans l'eau, mais est miscible dans l'alcool, le nitrobenzène et l'aniline. Cette substance est chimiquement stable dans des conditions normales.
Les caractéristiques physico-chimiques dont l'ordre de grandeur est indiqué ci-après, influencent les risques de transfert de cette substance active vers les eaux, et le risque de pollution des eaux :
- hydrolyse à pH 7 : très stable ;
- solubilité : 0,084 mg l−1 ;
- coefficient de partage carbone organique-eau : 3 215 cm3 g−1. Ce paramètre, noté « Koc », représente le potentiel de rétention de cette substance active sur la matière organique du sol. La mobilité de la matière active est réduite par son absorption sur les particules du sol ;
- demi-vie : huit jours. Ce paramètre, noté « DT50 », représente le potentiel de dégradation de cette substance active et sa vitesse de dégradation dans le sol ;
- coefficient de partage octanol-eau : 3,52. Ce paramètre, noté « Log Kow » ou « LogP », mesure l’hydrophilie (valeurs faibles) ou la lipophilie (valeurs fortes) de la substance active.
Écotoxicologie
Sur le plan de l’écotoxicologie, les concentrations létales 50 (CL50) dont l'ordre de grandeur est indiqué ci-après, sont observées :
Applications médicales
L'anthraquinone et ses dérivés naturels sont dotés d'un pouvoir thérapeutique avéré pour soigner tous les troubles fonctionnels intestinaux comme la colopathie fonctionnelle, la laxophobie ou la constipation. L'anthraquinone et ses dérivés actifs comme les glucosides d'anthraquinone stimulent le péristaltisme de l'intestin grêle et augmentent les mouvements péristaltiques du côlon. Les glucosides d’anthraquinone se transforment dans le côlon en sennosides. Ces derniers sont hydrophiles et réduisent l’absorption de l’eau en vue d’avoir un bol fécal fluide. Ils évitent par conséquent, la formation de selles grumeleuses. L'anthraquinone est utilisé comme laxatif ou purgatif à partir d'un seuil de 30 mg à 36 mg par jour. Au-delà de ce seuil de sennosides, les selles tendent à devenir très molles ou liquides. Les sennosides et les glucosides d'anthraquinone contiennent un groupe d'aglycone (voir glycoside). Ils sont présents dans les gousses et les feuilles de séné, le rhizome de la rhubarbe, la bourdaine, le cascara et notamment l'aloès.
Mise en garde : une utilisation prolongée au-delà de huit semaines, ou un abus mène à un mélanisme du côlon, dû à la libération de lipofuscine (présente dans les histiocytes et mastocytes) dans le côlon[4].
Applications industrielles
- L'anthraquinone est utilisée dans la fabrication de teintures et pigments.
- Elle est aussi utilisée dans la fabrication industrielle de pâte à papier.
- Une autre utilisation est celle de répulsif à l'égard des oiseaux pour les plantations.
- Un dérivé, la 2-éthylanthraquinone, est utilisé pour la fabrication commerciale du peroxyde d'hydrogène :
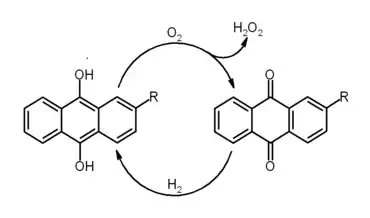
- L'anthraquinone et la benzoquinone peuvent être utilisées comme électrolytes dans le fonctionnement de batteries à flux redox organique[5].
- Elle est aussi à l'étude dans des batteries aluminium - anthraquinone[6].
Pigments
Les colorants anthraquinoniques existent dans le règne végétal et animal : carmin, garance (alizarine, purpurine), kermès, nerprun.
Depuis le XIXe siècle, ils sont aussi fabriqués de manière synthétique. Environ 25 pigments ont été mis sur le marché mais une dizaine seulement sont employés. Leur prix de revient les rend de plus en plus rares.
Parmi les pigments anthraquinoniques courants, on trouve :
- bleu d'indanthrène (PB60) ;
- jaune anthraquinonique (PY108) ;
- rouge anthraquinonique (PR169) ;
- rouge anthraquinonique (PR177).
Pollution aux hydrocarbures, dans l'eau du robinet, à destination de la consommation humaine
L'anthraquinone peut être impliquée dans la pollution de l'eau du robinet aux hydrocarbures.
Le phénomène est décrit dans le rapport ANSES n°2010-SA-0184 (Juillet 2011)[7] :
Jusque dans les années 80, on utilisait des conduites en fonte ou en acier, avec un revêtement interne d’étanchéité en matière « hydrocarbonées » (c-à-d du goudron, ou du brai de houille), ce produit était aussi utilisé pour les joints des conduites, mais aussi pour les joints des réservoirs d’eau (en acier ou en béton), sur le site de production. Ces matières hydrocarbonées, utilisées comme étanchéifiant, contienne un composé : l’anthracène, qui, en réagissant avec le chlore contenu dans l’eau, forme de l’anthraquinone (Hydrocarbure Aromatique polycyclique). Il faut savoir que environ 20% des canalisations de France sont concernées, essentiellement en milieu urbain.
Il y a donc des hydrocarbures qui se forment (par réaction chimique) à l’intérieur des anciennes conduites d’eau, et ces hydrocarbures peuvent occasionnellement se détacher, et venir polluer l’eau du robinet. Cela se produit notamment lors d’opérations de maintenance effectuées par le distributeur : par exemple : nettoyage de cuves, manœuvre de vannes, cela provoque des fluctuations de débit dans les conduites (ce qu’on appelle des « coups de bélier »), les fluctuations de concentration en chlore dans l’eau, peut aussi favoriser le relargage de l’anthraquinone dans le réseau d’eau potable.
Le rapport scientifique de l'ANSES a débouché sur une instruction Ministérielle (Instruction du Ministère de la Santé n° DGS/EA4 2011-487 (du 27/12/2011)[8] réglementant la manière de remédier à ce type de pollution.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 3, Huston, Texas, Gulf Pub. Co., (ISBN 978-0-88415-859-2)
- EFSA, Reasoned opinion on the review of the existing maximum residue levels (MRLs) for anthraquinone according to Article 12 of Regulation (EC) No 396/2005, 12 juin 2012.
- (en) Müller-Lissner SA, « Adverse effects of laxatives: fact and fiction », Pharmacology, vol. 47 Suppl 1, , p. 138-45 (PMID 8234421).
- (en) S. R. Narayanan, G. K. Surya Prakash, Advaith Murali et Sankarganesh Krishnamoorthy, « High-Performance Aqueous Organic Flow Battery with Quinone-Based Redox Couples at Both Electrodes », Journal of The Electrochemical Society, vol. 163, no 7, , A1442–A1449 (ISSN 0013-4651 et 1945-7111, DOI 10.1149/2.1371607jes, lire en ligne, consulté le ).
- (en) Jan Bitenc, Niklas Lindahl, Alen Vizintin, Muhammad E. Abdelhamid, Robert Dominko et Patrik Johansson, « Concept and electrochemical mechanism of an Al metal anode ‒ organic cathode battery », Energy Storage Materials, (lire en ligne).
- « Origines et risques sanitaires liés à la présence d’anthraquinone dans les eaux destinées à la consommation humaine »
- « Instruction no DGS/EA4 2011-487 du 27 décembre 2011 »
Voir aussi
- Liste de substances actives de produits phytosanitaires
- Liste de substances actives de produits phytopharmaceutiques autorisées par l'Union européenne
- Liste de substances actives de produits phytopharmaceutiques interdites par l'Union européenne
- Liste de couleurs (pigments)
- Anthracénoside, dérivé de l'anthraquinone
- Portail de la chimie
- Portail de l’agriculture et l’agronomie
- Portail de la protection des cultures
