Cabozantinib
Le cabozantinib est un inhibiteur de tyrosine kinases à cibles multiples : les récepteurs hepatocyte growth factor receptor (HGFR) ou c-Met (en), le récepteur à activité tyrosine kinase AXL (en) et le récepteur du facteur de croissance de l’endothélium vasculaire VEGFR-2.
| Cabozantinib | |
| |
| Cabozantinib | |
| Identification | |
|---|---|
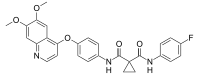
| Nom UICPA | N-(4-((6,7-diméthoxyquinolin-4-yl)oxy)phényl)-N'-(4-fluorophényl)cyclopropane-1,1-dicarboxamide |
| Synonymes |
N'-(4-((6,7-diméthoxy-4-quinolinyl)oxy]pényl]-N-(4-fluorophényl)-1,1-cyclopropanedicarboxamide |
| No CAS | |
| No ECHA | 100.221.147 |
| Code ATC | |
| DrugBank | DB08875 |
| PubChem | 25102847 |
| ChEBI | 72317 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C28H24FN3O5 [Isomères] |
| Masse molaire[1] | 501,505 7 ± 0,026 2 g/mol C 67,06 %, H 4,82 %, F 3,79 %, N 8,38 %, O 15,95 %, |
| Données pharmacocinétiques | |
| Liaison protéique | ≥99,7 %[2] |
| Métabolisme | Hépatique (via le CYP3A4) |
| Demi-vie d’élim. | 55 heures[2] |
| Excrétion |
Fèces (54 %), urine (27 %) |
| Unités du SI et CNTP, sauf indication contraire. | |
Efficacité
Il est actif dans le cancer médullaire de la thyroïde[3].
Il augmente la survie du cancer du rein par rapport à un traitement par évérolimus[4]. Dans les formes graves ou métastatiques, il augmente la durée de rémission[5], et fait, en particulier, mieux que le sunitinib[6].
Aspects commerciaux
Il a été développé par la société Exelixis (en) sous le nom de code XL184. Il est commercialisé par Exelixis aux Etats-Unis, par Takeda au Japon, et par Ipsen hors Etats-Unis et Japon[7].
Son nom commercial est :
- Cometriq dans le traitement d'un type de cancer de la thyroïde (AMM octroyée le par la Commission européenne dans l'indication : « traitement du cancer médullaire de la thyroïde (CMT), localement avancé ou métastatique, progressif et non résécable de l’adulte »)[8] ;
- Cabometyx dans le traitement du carcinome rénal (AMM octroyée le par la Commission européenne dans l'indication : « traitement des patients adultes atteints d’un carcinome rénal avancé après une thérapie ciblée des récepteurs du facteur de croissance de l’endothélium vasculaire (VEGF) »)[9].
Le cabozantinib est considéré comme un médicament orphelin :
- par la Commission européenne depuis le dans le traitement du carcinome médullaire de la thyroïde[10] ;
- par la Food and Drug Administration (FDA) depuis pour les indications de traitement du carcinome folliculaire, médullaire et anaplasique de la thyroîde, ainsi que le traitement du cancer papillaire de la thyroïde métastatique ou localement avancé[11].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- PubChem
- Viola D, Cappagli V, Elisei R, Cabozantinib (XL184) for the treatment of locally advanced or metastatic progressive medullary thyroid cancer, Future Oncol, 2013;9:1083-1092
- Choueiri TK, Escudier B, Powles T et al. Cabozantinib versus everolimus in advanced renal-cell carcinoma, N Engl J Med, 2015;373:1814-1823
- Schmidt E, Lister J, Neumann M et al. Cabozantinib versus standard-of-care comparators in the treatment of advanced/metastatic renal cell carcinoma in treatment-naive patients: a systematic review and network meta-analysis, Target Oncol, 2018;13:205-216
- Choueiri TK, Halabi S, Sanford BL et al. Cabozantinib versus sunitinib as initial targeted therapy for patients with metastatic renal cell carcinoma of poor or intermediate risk: the Alliance A031203 CABOSUN trial, J Clin Oncol, 2017;35:591-597.
- « Ipsen reçoit un avis positif du CHMP pour Cabometyx® en association avec Opdivo® comme traitement en première »
- Cometriq sur le site de l'Agence européenne du médicament
- Cabometyx sur le site de l'Agence européenne du médicament
- Désignation orpheline EU/3/08/610 sur le site de l'EMA
- (en)Exelixis’ XL184 Granted Orphan Drug Designation and Assigned the Generic Name Cabozantinib. janvier 2011
- Portail de la médecine
- Portail de la pharmacie
- Portail de la chimie