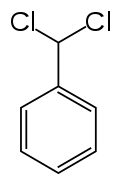
(Dichlorométhyl)benzène
Le (dichlorométhyl)benzène, aussi connu comme l'α,α-dichlorotoluène, est un composé organique halogéné de formule moléculaire C6H5CH3Cl2. Ce liquide incolore est lacrymogène et est utilisé comme précurseur en synthèse organique.
| (Dichlorométhyl)benzène | |
| |
| Identification | |
|---|---|
| Nom UICPA | (Dichlorométhyl)benzène |
| Synonymes |
α,α-Dichlorotoluène |
| No CAS | |
| No ECHA | 100.002.463 |
| No CE | 202-709-2 |
| No RTECS | CZ5075000 |
| PubChem | 741124855098 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore à l'odeur âcre |
| Propriétés chimiques | |
| Formule | C7H8Cl2 [Isomères] C6H5CH3Cl2 |
| Masse molaire[1] | 163,044 ± 0,01 g/mol C 51,57 %, H 4,95 %, Cl 43,49 %, |
| Propriétés physiques | |
| T° fusion | −16 °C[2] |
| T° ébullition | 205 °C[2] |
| Solubilité | 0,2 g·l-1 (eau, 20 °C)[2] |
| Masse volumique | 1,248 5 g·cm-3 à 20 °C[3] |
| T° d'auto-inflammation | 525 °C[2] |
| Point d’éclair | 88 °C[2] |
| Limites d’explosivité dans l’air | 1,1–11 %vol[2] |
| Pression de vapeur saturante | 0,5 mbar à 20 °C 0,9 mbar à 30 °C 3 mbar à 50 °C 8 mbar à 70 °C[2] |
| Viscosité dynamique | 2,104 mPa·s à 20 °C[4] |
| Conductivité électrique | 3,4×10-9 S·cm-1 à 20 °C[4] |
| Thermochimie | |
| ΔvapH° | 50,4 kJ·mol-1 à 72 °C[4] |
| Cp | 222 J·K-1·mol-1 (solide, 24,85 °C)[4] |
| PCI | −3 852 kJ·mol-1[4] |
| Propriétés optiques | |
| Indice de réfraction | [5] |
| Précautions | |
| NFPA 704[6] | |
| Directive 67/548/EEC[7] | |
 T |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Historique
Ce composé fut synthétisé pour la première fois par A. Cahours par réaction entre le pentachlorure de phosphore et le benzaldéhyde[4].
Utilisation
Le (dichlorométhyl)benzène est pratiquement exclusivement utilisé pour la fabrication du benzaldéhyde par hydrolyse acide ou basique[4] :
Les amines et les catalyseurs de Friedel-Crafts sont recommandés pour la conversion en benzaldéhyde[4]. Il est important d'éviter la présence de chlorure de benzyle lors de cette opération, car ce composé et le benzaldéhyde ont des points d'ébullition très proches, ce qui rend leur séparation par distillation difficile.
Propriétés physico-chimiques
Le (dichlorométhyl)benzène est soluble dans l'éthanol, l'éther, le chloroforme et le tétrachlorure de carbone. La solubilité du dichlore dans 100 g de (dichlorométhyl)benzène est de 6,2 g à 30 °C, 4,3 g à 50 °C et de 1,5 g à 100 °C[4].
Le (dichlorométhyl)benzène fume dans l'air humide et a un puissant effet irritant sur les muqueuses et les yeux[4].
L'addition d'une base forte sur le (dichlorométhyl)benzène produit du phénylcarbène (C6H5CH).
Production et synthèse
Le (dichlorométhyl)benzène est produit par chloration radicalaire du toluène, catalysé par la lumière ou des initiateurs radicalaires comme le peroxyde de benzoyle. Un intermédiaire et une réaction consécutive sont observés :
- C6H5-CH3 + Cl2 C6H5-CH2Cl + HCl
- C6H5-CH2Cl + Cl2 C6H5-CHCl2 + HCl
- C6H5-CHCl2 + Cl2 C6H5-CCl3 + HCl
La réaction est contrôlée de manière à éviter la réaction consécutive de chloration. Il en résulte un mélange de chlorure de benzyle et de (dichlorométhyl)benzène qui est purifié par distillation. Le (dichlorométhyl)benzène peut être considéré comme un sous-produit de la fabrication du chlorure de benzyle[4].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Benzal chloride » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Benzylidene chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 19 janvier 2010 (JavaScript nécessaire)
- (en) Irwin B. Douglass et Frederic T. Martin, « SULFENYL CHLORIDE STUDIES. I. THE ANHYDROUS CHLORINATION OF CERTAIN s-TRITHIANES », Journal of Organic Chemistry, vol. 15, no 4, , p. 795-799
- (en) Manfred Rossberg, Wilhelm Lendle, Gerhard Pfleiderer, Adolf Tögel, Eberhard-Ludwig Dreher, Ernst Langer, Heinz Rassaerts, Peter Kleinschmidt, Heinz Strack, Richard Cook, Uwe Beck, Karl-August Lipper, Theodore R. Torkelson, Eckhard Löser, Klaus K. Beutel, Trevor Mann, Chlorinated Hydrocarbons, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry »,
- (en) B. Bensley et G. Kohnstam, « The effect of -chloro-substituents on the SN1 reactivity of the C—Cl linkage », Journal of the Chemical Society, , p. 287-296
- UCB Université du Colorado
- « α,α-dichlorotoluene », sur ESIS, consulté le 19 janvier 2010

