Capacité thermique massique
La capacité thermique massique (symbole usuel c), anciennement appelée chaleur massique ou chaleur spécifique[alpha 1],[1],[2], est la capacité thermique d'un matériau rapportée à sa masse. C'est une grandeur qui reflète la capacité d'un matériau à accumuler de l'énergie sous forme thermique, pour une masse donnée, quand sa température augmente. Une grande capacité thermique signifie qu'une grande quantité d'énergie peut être stockée, moyennant une augmentation relativement faible de la température.
| Unités SI | joule par kilogramme kelvin (J K−1 kg−1). |
|---|---|
| Dimension | L 2·T −2·Θ −1 |
| Nature | Grandeur scalaire intensive |
| Symbole usuel |
La capacité thermique massique s'exprime en joules par kilogramme kelvin, de symbole J K−1 kg−1 [alpha 2]. C'est une grandeur intensive : elle est indépendante de la quantité de matière.
La détermination des valeurs des capacités thermiques des substances relève de la calorimétrie.
Caractérisation
La capacité thermique massique est déterminée par la quantité d'énergie à apporter par échange thermique pour élever d'un kelvin (ou degré Celsius) la température de l'unité de masse d'une substance. C'est donc une grandeur intensive égale à la capacité thermique rapportée à la masse du corps étudié.
L'unité dérivée du Système international est alors le joule par kilogramme-kelvin (J K−1 kg−1). Les unités de base du système international pour exprimer la valeur d'une capacité thermique massique sont des L 2·T −2·Θ −1.
En ce qui concerne les équations aux dimensions, le joule ayant pour dimension M·L 2·T −2, une capacité thermique massique a pour dimension : L 2·T −2·Θ −1.
À pression ou volume constant
Suivant le type de transformation thermodynamique, on considère soit l'énergie interne massique, soit l'enthalpie massique. Si on note U l'énergie interne, H l'enthalpie et m la masse d'un corps on a donc les capacités thermiques massiques :
- à volume constant, la capacité thermique isochore massique : ;
- à pression constante, la capacité thermique isobare massique : .
La différence entre la capacité thermique massique à pression constante et la capacité thermique massique à volume constant est liée au travail qui doit être fourni pour dilater le corps en présence d'une pression externe. Si elle est souvent négligeable pour les phases condensées réputées peu compressibles et peu dilatables (liquides ou solides) la différence entre et est importante pour les gaz.
La capacité thermique volumique, exprimée en joules par mètre cube-kelvin (J K−1 m−3), est égale à la capacité thermique massique multipliée par la masse volumique.
Gaz
Gaz parfaits
D'après la théorie cinétique des gaz, l'énergie interne d'une mole de gaz parfait monoatomique est égale à (3/2)RT, et plus élevée pour les gaz dont les molécules sont polyatomiques ; par exemple, (5/2)RT pour un gaz diatomique. Le calcul théorique n'est plus possible pour les molécules complexes.
La capacité massique à volume constant est ainsi de :
- pour un gaz parfait monoatomique ;
- pour un gaz parfait diatomique, lorsque sa température vérifie . En effet si on aura (son comportement sera celui d'un gaz monoatomique), et si on aura pour un gaz diatomique.
La capacité massique à pression constante d'un gaz parfait peut être déterminée à partir de la capacité massique à volume constant, puisque l'équation des gaz parfaits exprime que :
- , et donc : ,
p étant la pression, v le volume massique[alpha 3], R la constante molaire des gaz[alpha 4] et M la masse molaire du gaz considéré.
La différence théorique entre ces deux valeurs donne alors la relation de Mayer :
où p, V, v, N et T sont respectivement la pression, le volume, le nombre de particules et la température du système considéré ; soit :
- ,
u (l'énergie interne massique) ne dépendant que de la température.
Le rapport des deux capacités d'un gaz est important en thermodynamique ; il est noté gamma :
- .
Sa valeur dépend de la nature du gaz considéré ; pour un gaz parfait, la valeur théorique de γ est :
- γ = 5/3 = 1,67 pour un gaz monoatomique (1/(γ-1)=3/2=1,5) ;
- γ = 7/5 = 1,4 pour un gaz diatomique (1/(γ-1)=5/2=2,5).
Gaz réels
| Gaz | Masse molaire (kg/mol) |
Température (°C) |
Capacité thermique massique (J K−1 kg−1) |
|
|---|---|---|---|---|
| Air | 29 × 10−3 | 0-100 | 1 004 | 2,48 |
| Argon | 39,948 × 10−3 | 15 | 520 | 1,54 |
| Diazote | 28,013 × 10−3 | 0-200 | 1 025 | 2,46 |
| Dioxyde de carbone | 44,01 × 10−3 | 20 | 842[4][réf. incomplète] | 3,44 |
| Hélium | 4,003 × 10−3 | 18 | 5 193 | 1,52 |
| Dihydrogène | 2,016 × 10−3 | 16 | 14 300 | 2,46 |
| Dioxygène | 31,999 × 10−3 | 13-207 | 920 | 2,50 |
| Vapeur d'eau | 18,015 × 10−3 | 100 | 2 010 | 3,65 |
D'une manière générale pour les gaz parfaits, on a les capacités thermiques molaires (en J K−1 mol−1) suivantes : et .
Solides
Mesure de la capacité thermique massique d'un solide
La capacité thermique massique d'un solide peut être mesurée en utilisant un appareil de type ATD (analyse thermodifférentielle) ou DSC (differential scanning calorimetry). Elle peut se définir de la façon suivante : quand un système passe de la température T à une température T+dT, la variation d’énergie interne du système dU est liée à la chaleur échangée δQ selon :
avec pe la pression extérieure à laquelle est soumis le système et dV la variation de volume. Si V = cte :
En revanche, si la transformation est isobare (pression constante), on obtient en utilisant la fonction enthalpie du système, la relation :
Si P = cte
avec Cp la capacité à pression constante. La mesure consiste donc à mesurer la différence de température créée par un échange thermique donné, où le flux d'énergie se traduit par une différence de température.
Le schéma suivant illustre la technique instrumentale utilisée dans le cas de la première méthode (mesure de la différence de température).
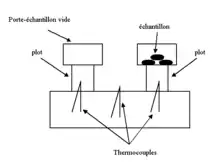
L’appareil est constitué de deux « plots » indépendants et d’un four. Des thermocouples permettent de mesurer la température de la face supérieure des plots en contact avec l’échantillon, ainsi que la température du four. Celle-ci correspond à la température de mesure. Toutes les mesures sont effectuées en utilisant un porte-échantillon d’aluminium vide sur l’un des plots. Une première mesure d’un autre porte-échantillon d’aluminium vide permet d’obtenir une ligne de base (dépendant de la mesure de température par les thermocouples). Puis une mesure d’un échantillon de référence de capacité thermique massique connue permet d’étalonner l’appareil. Enfin, l’échantillon sous forme de poudre est mesuré et sa capacité thermique massique est obtenue par comparaison avec celle de l’échantillon de référence. Pour améliorer la précision de la mesure, il convient de prendre en compte, le cas échéant, la différence de masse entre les deux porte-échantillons (la correction s'effectue en utilisant la capacité thermique massique de l'aluminium). La source d’erreur principale provient de la qualité du contact thermique entre le plot et le porte-échantillon.
Valeurs courantes
| Substance (phase solide) |
Capacité thermique massique (J K−1 kg−1) |
|---|---|
| Asphalte | 1 021 |
| Brique | 840 |
| Béton | 880 |
| Granite | 790 |
| Gypse | 1 090 |
| Marbre | 880 |
| Sable | 835 |
| Verre | 720[5] |
| Bois | ≈ 1200-2700[6],[7] |
Solides cristallisés
Dans le cas des solides, à température suffisamment haute, la loi de Dulong et Petit est applicable et permet notamment de retrouver que, à basse température, du fait de la contribution des phonons. Si le solide est un métal, il faut ajouter la contribution des électrons qui est proportionnelle à la température.
Les coefficients de dilatation des corps solides et liquides sont généralement suffisamment faibles pour qu'on néglige la différence entre Cp et CV pour la plupart des applications.
| Substance | (K) |
|---|---|
| Al | 398 |
| C (diamant) | 1 860 |
| Cu | 315 |
| Fe | 420 |
| K | 99 |
| Pb | 88 |
Suivant la théorie de Debye, la capacité thermique molaire d'un corps simple solide peut être déterminée au moyen de la formule :
avec ,
- est la température de Debye, qui est une caractéristique de chaque substance,
R est la constante molaire des gaz[alpha 4],
- et .
Cette formule se simplifie à basse température, ainsi qu'à haute température ; dans ce dernier cas, on retrouve la loi de Dulong et Petit :
La théorie n'est plus valable pour les corps composés.
Formules empiriques
Pour des corps purs (solides, liquides ou gazeux) et à pression constante, deux formules empiriques à trois paramètres ont pu être dégagées, pour un intervalle de température donné :
- ou bien .
Les valeurs des coefficients sont indiquées dans des tables et sont caractéristiques d'un corps donné.
Pour le bois sec, par exemple, on a[7] :
avec :
- : exprimé en kJ K−1 kg−1
- T : température thermodynamique (K).
À 20 °C, on obtient 1 236 J K−1 kg−1 pour le bois sec.
Pour le bois humide[7] :
où Hs est la masse d'eau rapportée à la masse du bois sec en %.
Valeurs pour différentes substances
| Substance | Phase | Capacité thermique massique (J K−1 kg−1) |
|---|---|---|
| Air (sec) | gaz | 1 005 |
| Air (saturé en vapeur d'eau) | gaz | ≈ 1 030 |
| Aluminium | solide | 897 |
| Diazote | gaz | 1 042 |
| Cuivre | solide | 385 |
| Diamant | solide | 502 |
| Dioxygène | gaz | 920 |
| Eau | gaz | 1 850 |
| liquide | 4 185 | |
| solide (0 °C) | 2 060 | |
| Éthanol | liquide | 2 460 |
| Éthylène glycol | liquide | ≈ 2 400 à 25 °C[8] |
| Fer | solide | 444 |
| Graphite | solide | 720 |
| Hélium | gaz | 5 193 |
| Hexane | liquide | ≈ 2 267,95 |
| Huile | liquide | ≈ 2 000 |
| Dihydrogène | gaz | 14 300 |
| Laiton | solide | 377 |
| Lithium | solide | 3 582 |
| Mercure | liquide | 139 |
| Octane | liquide | ≈ 1 393,33 |
| Or | solide | 129 |
| Zinc | solide | 380 |
Notes et références
Notes
- Les termes spécifique et massique sont équivalents.
- Le BIPM ne met pas le kilogramme et le kelvin dans le même ordre pour le symbole que pour le nom de l'unité (il écrit « joule par kilogramme kelvin » mais « J K−1 kg−1 »), sans donner d'explication[3]. Il fait de même pour la capacité thermique molaire : « joule par mole kelvin » mais « J K−1 mol−1 ».
- Le volume massique est la grandeur inverse de la masse volumique.
- R = 8,314 4 J K−1 mol−1.
Références
- « Mesure de la chaleur spécifique d'un solide », sur Faculté des Sciences exactes et naturelles - Université du Maine (consulté le ).
- Michel Lagière, Physique industrielle des fluides : Notions fondamentales et applications numériques, Technip, (ISBN 978-2-7108-1090-2, lire en ligne), p. 274.
- BIPM, Le Système international d’unités, , 9e éd., 218 p. (lire en ligne [PDF]), p. 28.
- (en) Perry, Chemical Engineering Handbook, 5e éd..
- « Les propriétés thermiques du verre », sur Verre online (consulté le ).
- Eugène Péclet, Traité de la chaleur, considérée dans ses applications, D. Avanzo et Ce, , 420 p. (lire en ligne), p. 17Les valeurs indiquées sont en cal kg−1 K−1.
- « Bois énergie », Techniques de l'ingénieur, 10 juillet 2004, réf BE 8535.
- (en) « 1,2-Ethanediol », sur National Institute of Standards and Technology (consulté le ), « Constant pressure heat capacity of liquid ».
Voir aussi
Bibliographie
- Lev Landau et Evgueni Lifchits, Physique théorique, t. 5 : Physique statistique [détail des éditions]
- Charles Kittel (trad. Nathalie Bardou, Évelyne Kolb), Physique de l’état solide [« Solid state physics »], [détail des éditions]
- J. Boutigny, Thermodynamique, Vuibert
Articles connexes
- Coefficients calorimétriques et thermoélastiques
- Loi de Joule
- Capacité thermique
- Capacité thermique volumique
- Capacité thermique isobare
- Capacité thermique isochore
- Méthode de Joback
- Portail de la physique
- Portail de la chimie
- Portail de l’énergie
- Portail des sciences des matériaux