Demi-vie
La demi-vie[alpha 1] est le temps mis par une substance (molécule, médicament ou autre) pour perdre la moitié de son activité pharmacologique ou physiologique. Employée par extension dans le domaine de la radioactivité, la demi-vie, également appelée période radioactive, est le temps au bout duquel la moitié des noyaux radioactifs d'une source se sont désintégrés.
Le terme demi-vie est souvent mal interprété : deux demi-vies ne correspondent pas à la vie complète du produit. La demi-vie est en fait la médiane de la durée de vie d'un produit, c'est-à-dire la durée en deçà de laquelle il reste plus de 50 % du produit, et au-delà de laquelle il en reste moins de 50 %. En biologie ou biochimie, la demi-vie est parfois notée L50 ou B50 (durée de vie d'espérance 50 %). La demi-vie est différente de la durée de vie moyenne.
La demi-vie se mesure en secondes (s). Les demi-vies supérieures à 1 000 s sont souvent données en heures (h), jours (j), années (a) ou multiples d'années (il s'agit alors, sauf mention contraire, de l'année julienne : 1 a = 365,25 j = 31 557 600 s exactement).
Différents contextes scientifiques
En biologie et pharmacologie
En biologie, la demi-vie d'une enzyme correspond au temps nécessaire pour que l'enzyme perde la moitié de son activité spécifique pour cause de dénaturation et d'inactivation.
En pharmacologie, la demi-vie désigne par extension le temps nécessaire pour que la concentration d’une substance contenue dans un système biologique soit diminuée de la moitié de sa valeur initiale (par exemple la concentration d’un médicament dans le plasma sanguin).
Ce paramètre varie légèrement d'un individu à l'autre, selon le processus d'élimination et le fonctionnement relatif chez l'individu.
En pratique, on considère qu'un médicament n'a plus d'effet pharmacologique après cinq à sept demi-vies.
En chimie
Pour une réaction chimique, la notion de demi-vie est appelée temps de demi-réaction.
Différence entre demi-vie et demi-réaction
Dans un cas simple, par exemple pour la réaction d'équation A → P, la définition donnée ci-dessus du temps de demi-vie s'applique parfaitement au temps de demi-réaction. En revanche, dans le cas général, cette définition est incorrecte comme le montrent les deux exemples suivants :
- cas de la réaction d'équation A + B → P avec, comme conditions initiales sur les quantités de matière, n(A) = 10 mol et n(B) = 1 mol. Quand le temps de demi-vie est atteint, la quantité restant de A n'est pas n(A)/2, qui vaudrait 5 mol, mais n(A) = 9,5 mol ;
- cas de la réaction équilibrée A = P de constante d'équilibre K = 0,25 avec la condition initiale n(A) = 10 mol et n(P) = 0 mol. A l'équilibre, n(A)éq = 8 mol et n(P)éq = 2 mol. Le temps de demi-réaction est le temps au bout duquel n(A) = 9 mol (et non le temps au bout duquel n(A) = 5 mol, situation qui n'arrivera jamais dans ce cas).
Ces deux exemples montrent qu'il faut une autre définition du temps de demi-réaction, que celle donnée pour le temps de demi-vie. La définition généralement donnée est : "Le temps de demi-réaction est le temps au bout duquel la moitié de l'avancement final est atteint". En termes moins scientifiques, c'est le temps au bout duquel la moitié de l'évolution possible est atteinte, ou encore, le temps pour lequel la moitié de ce qui doit se faire est fait.
L'IUPAC donne la définition suivante[1]
« For a given reaction the half life t1/2 of a reactant is the time required for its concentration to reach a value that is the arithmetic mean of its initial and final (equilibrium) values. »
Pour une réaction donnée, le temps de demi-réaction t1/2 d'un réactif est le temps pour lequel sa concentration atteint la valeur qui est la moyenne arithmétique entre sa concentration à l'état initial et celle à l'état final (à l'équilibre).
Cas des réactions d'ordre 1
Le cas des réactions d'ordre 1 est intéressant car le temps de demi-réaction est indépendant des conditions initiales. La loi de vitesse (pour l'équation A → P) est
vitesse = -d[A] / dt = k[A] (ou k est la constante de vitesse)
Le temps de demi-réaction est τ1/2 = ln(2) / k
Le fait que le temps de demi-réaction est indépendant de la concentration initiale est caractéristique de l'ordre 1.
Cas des autres réactions
Les réactions qui ne sont pas d'ordre 1 ont toutes un temps de demi-réaction qui dépend de la concentration initiale.
- Cas de l'ordre 2
Le temps de demi-réaction, dans le cas des cinétiques d'ordre 2, dont la loi de vitesse est de la forme
vitesse de réaction = k [A]2
le temps de demi-réaction est τ1/2 = [A]0 / k
- Cas de l'ordre 0
Le temps de demi-réaction, dans le cas des cinétiques d'ordre 0, dont la loi de vitesse est de la forme
vitesse de réaction = k
le temps de demi-réaction est τ1/2 = [A]0 / 2k
Cas d'une décomposition
Le cas de certaines molécules qui présentent une faible stabilité et qui se décomposent, généralement en se transformant en d'autres espèces moléculaires, se traduit par l'équation A → P. Dans ce cas, la définition de la demi-vie est équivalente à la définition mettant en jeu l'avancement. Cette décomposition n'est pas instantanée mais fait décroître la quantité de molécules en fonction du temps, le temps de demi-réaction caractérise cette décroissance en indiquant la durée au bout de laquelle la quantité de molécules est diminuée de moitié. Cette demi-vie moléculaire dépend de la température.
En physique
En physique, la demi-vie (ou période) d'un isotope radioactif est le temps au bout duquel la moitié des noyaux de cet isotope initialement présents se sont désintégrés. S'il n'y a pas par ailleurs de création de tels noyaux (comme produits d'une réaction nucléaire ou de la désintégration d'autres radioisotopes), c'est aussi le temps au bout duquel le nombre de noyaux de l'isotope considéré a été divisé par deux.
Demi-vie selon la loi statistique
Cas d'une décroissance exponentielle
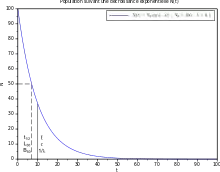
La désintégration d'une particule est « totalement aléatoire », c'est-à-dire que sa probabilité de désintégration est uniforme dans l'avenir, et ne dépend que de la durée de l'intervalle d'avenir considéré. Le taux de proportionnalité temporel est noté . La probabilité pour la particule de se désintégrer entre les instants futurs et vaut donc :
C'est également la probabilité que la durée de vie d'une particule soit égale à (puisqu'elle existe à l'instant et n'existe plus à ) :
Ceci décrit également les systèmes présentant un taux de défaillance instantané constant, c'est-à-dire une défaillance sans faiblesse de jeunesse, ni usure, ni effet de mémoire, comme les composants électroniques.
À l'échelle d'une population de particules (ou systèmes), la loi de désintégration (ou de défaillance) s'écrit donc :
où :
- est la population à l'instant ;
- (lettre grecque lambda) est une constante homogène à l'inverse d'un temps (elle s'exprime en s−1, a−1, etc.) ; dans le contexte de la radioactivité on l'appelle constante de désintégration.
La résolution de cette équation différentielle fait apparaître une fonction exponentielle décroissante :
- dans lequel est la concentration au temps initial.
La demi-vie (notée ) est définie comme étant l'instant tel que l'on ait :
On a donc :
|
|
Si est la durée de vie d'une particule, on a également, par simple application de la définition des probabilités donnée ci-dessus :
Remarque importante : La durée de vie moyenne de la particule - notée : - n'est pas à confondre avec la demi-vie, notée :
|
|
Cas général
Tous les systèmes ne suivent pas une loi exponentielle. En particulier, le taux de défaillance instantané n'a aucune raison d'être uniforme :
- il peut décroître, ce qui indique que le système devient plus robuste avec le temps ou bien que les systèmes présentant des défauts de jeunesse sont éliminés dans les premiers temps (voir Mortalité infantile, Mortalité juvénile et Rodage) ;
- il peut croître, ce qui indique un phénomène de vieillissement, d'usure ;
- il peut avoir une courbe « en baignoire », avec trois étapes dans la vie du système : décroissant, puis constant, puis croissant.
Dans tous les cas, la demi-vie t1/2 reste égale à la médiane.
| Loi | Fonction de survie R(t ) = N(t )/N0[alpha 3] |
Durée de vie moyenne τ = t |
Durée de demi-vie t1/2 = L50 = B50 |
|---|---|---|---|
| Exponentielle | exp(-λt) | 1/λ | ln(2)/λ |
| Normale | μ | μ | |
| Log-normale | exp(μ + σ2/2) | exp(μ) | |
| Weibull | λΓ(1 + 1/β) | λln(2)1/β | |
| Χ2 | k | ≈ k - 2/3 | |
| Logistique | μ | μ | |
| Log-logistique | α |
Notes et références
- Demi- est un élément préfixé invariable, cf. « Demi », sur http://atilf.atilf.fr, Dictionnaire de l'Académie, 9e éd.
- Dans la relation , (> 0) représente l'activité (exprimée en désintégrations par seconde, et généralement notée ) de la population de particules .
- C'est le complémentaire de la fonction de répartition : R(t) = 1 – F(t).
Voir aussi
Articles connexes
Lien externe
- (Histoire des sciences) L'article de Rutherford et Soddy (1903) mettant en évidence la demi-vie radioactive, site BibNum.
- Portail de la physique
- Portail de la chimie
- Portail de la protection des cultures