Acide fumarique
L'acide fumarique, ou acide trans-butènedioïque, est un acide dicarboxylique insaturé de formule chimique HOOC–CH=CH–COOH. Il se présente sous la forme d'une poudre blanche cristallisée et inodore, combustible mais faiblement inflammable et faiblement soluble dans l'eau. Il présente une saveur rappelant celle des fruits. C'est l'isomère trans de l'acide maléique : ses deux groupes carboxyle sont en position E (trans) tandis que ceux de l'acide maléique sont en position Z (cis), ce qui le rend plus stable que ce dernier. Ses sels et esters sont appelés fumarates.
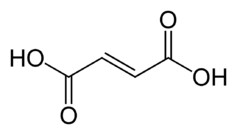 Acide fumarique (E, trans)
Acide fumarique (E, trans) Acide maléique (Z, cis)
Acide maléique (Z, cis)
| Acide fumarique | |
  Structure de l'acide fumarique |
|
| Identification | |
|---|---|
| Nom UICPA | acide (E)-but-2-èn-1,4-dioïque |
| Synonymes |
acide trans-butènedioïque |
| No CAS | |
| No ECHA | 100.003.404 |
| No CE | 203-743-0 |
| Code ATC | D05 |
| DrugBank | DB01677 |
| PubChem | |
| No E | E297 |
| FEMA | 2488 |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline incolore, inodore[1] |
| Propriétés chimiques | |
| Formule | C4H4O4 [Isomères] |
| Masse molaire[2] | 116,072 2 ± 0,004 7 g/mol C 41,39 %, H 3,47 %, O 55,14 %, |
| pKa | 3,03 ; 4,44 |
| Propriétés physiques | |
| T° fusion | 287 °C[3] (tube fermé) |
| T° ébullition | Point de sublimation : ~200 °C[3] à 101,3 kPa |
| Solubilité | 4,9 g·L-1[3] à 20 °C 6,3 g·L-1 à 25 °C[1] dans l'eau |
| Masse volumique | 1,64 g·cm-3[3] à 20 °C |
| T° d'auto-inflammation | 375 °C[3] |
| Point d’éclair | 273 °C[3] |
| Thermochimie | |
| Cp | |
| Précautions | |
| SGH[3],[5] | |
 Attention |
|
| SIMDUT[6] | |
Produit non classé |
|
| Écotoxicologie | |
| DL50 | 9,3 g·kg-1[3] (souris, voie orale) |
| Composés apparentés | |
| Isomère(s) | Acide maléique |
| Unités du SI et CNTP, sauf indication contraire. | |
Chimie
L'acide fumarique a été obtenu pour la première fois en 1892 à partir d'acide succinique[7]. On l'obtient traditionnellement par oxydation du furfural, obtenu à partir du traitement du maïs, à l'aide de chlorate en présence d'un catalyseur à base de vanadium[8]. De nos jours, l'acide fumarique est produit industriellement essentiellement par isomérisation catalytique de l'acide maléique en solution aqueuse à pH faible. L'acide maléique est disponible en abondance par hydrolyse de l'anhydride maléique, lui-même obtenu en grande quantité par oxydation catalytique du benzène ou du butane.
Les propriétés chimiques de l'acide fumarique peuvent être facilement déduites de sa structure chimique. Il s'agit d'un acide faible qui forme des diesters, il peut subir des additions sur sa double liaison carbone-carbone, et est un excellent diénophile.
Il est moins combustible que l'acide maléique, et ne brûle pas dans les conditions qui font déflagrer ce dernier. Il peut être utilisé en milieu éducatif pour illustrer la différence d'enthalpie de formation entre les isomères cis et trans par différence entre les enthalpies de combustion.
L'acide fumarique est le stéréo-isomère E de l'acide maléique.
Biologie
L'acide fumarique est présent dans les fumeterres, les bolets, les lichens et la mousse d'Islande.
Il est également universellement distribué chez tous les êtres vivants dont le métabolisme utilise le cycle de Krebs pour oxyder leurs nutriments. C'est en effet un intermédiaire de ce cycle, où se forme par oxydation du succinate sous l'action de la succinate déshydrogénase, et donne du malate sous l'action de la fumarase.
De l'acide fumarique est également produit par le cycle de l'urée sous l'action de l'argininosuccinate lyase à partir de l'argininosuccinate.
Utilisation
Alimentaire
L'acide fumarique est utilisé comme additif alimentaire par l'industrie agroalimentaire depuis 1946. Il est utilisé comme régulateur alimentaire de pH avec le numéro E297. Il est utilisé dans les boissons et les levures chimiques. On l'emploie généralement à la place de l'acide tartrique et parfois de l'acide citrique, à raison de 1 g d'acide fumarique à la place d'environ 1,5 g d'acide citrique, afin d'ajouter une touche acide de manière semblable à l'acide malique.
Médicale
Plusieurs esters d'acide fumarique ont des propriétés immunorégulatrices (c'est-à-dire une légère immunosuppression) utilisées pour traiter le psoriasis. En Europe, l'Allemagne, l'Autriche et le Benelux utilisent des dérivés de l'acide fumarique à cet effet depuis le milieu du XXe siècle[9].
Par ailleurs, le fumarate de diméthyle est en phase III d'essai clinique chez des patients atteints de sclérose en plaques pour en réduire le taux de rechute et la progression des handicaps par activation du facteur de transcription NFE2L2 de réponse au stress oxydant[10].
Autres
L'acide fumarique est utilisé dans la fabrication de résines polyester et de polyols ainsi que dans la fixation de certaines teintures. Il a été utilisé pour démontrer la faisabilité d'un réseau métal-organique[11]. Il serait également employé par l'industrie pétrolière pour contrôler le pH dans les fluides de fracturation utilisés dans les forages profonds et horizontaux d'exploitation du gaz de schiste[12][source insuffisante]
Notes et références
- ACIDE FUMARIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Fumaric acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 15 juillet 2016 (JavaScript nécessaire)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Acide fumarique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (de) J. Volhard, « Darstellung von Maleïnsäureanhydrid », Justus Liebigs Annalen der Chemie, vol. 268, nos 1-2, , p. 255-256 (DOI 10.1002/jlac.18922680108, lire en ligne)
- (en) Nicholas A. Milas, Roger Adams et K. L. Amstutz, « Fumaric Acid », Organic Syntheses, vol. 11, , p. 46 (DOI 10.15227/orgsyn.011.0046, lire en ligne)
- (en) D. M. W. Balak, S. Fallah Arani, E. Hajdarbegovic, C. A. F. Hagemans, W. M. Bramer, H. B. Thio et H. A. M. Neumann, « Efficacy, effectiveness, and safety of fumaric acid esters in the treatment of psoriasis: a systematic review of randomized and observational studies », British Journal of Dermatology, (PMID 26919824, DOI 10.1111/bjd.14500, lire en ligne)
- (en) Ralf Gold, Ludwig Kappos, Douglas L. Arnold, Amit Bar-Or, Gavin Giovannoni, Krzysztof Selmaj, Carlo Tornatore, Marianne T. Sweetser, Minhua Yang, Sarah I. Sheikh et Katherine T. Dawson, « Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis », The New England Journal of Medicine, vol. 367, no 12, , p. 1098-1107 (PMID 22992073, DOI 10.1056/NEJMoa1114287, lire en ligne)
- (en) Pascal G. Yot, Louis Vanduyfhuys, Elsa Alvarez, Julien Rodriguez, Jean-Paul Itié, Paul Fabry, Nathalie Guillou, Thomas Devic, Isabelle Beurroies, Philip L. Llewellyn, Veronique Van Speybroeck, Christian Serrec et Guillaume Maurina, « Mechanical energy storage performance of an aluminum fumarate metal–organic framework », Chemical Science, vol. 7, no 1, , p. 446-450 (DOI 10.1039/C5SC02794B, lire en ligne)
- tableaux Exel listant quelques substances et produits
Annexes
Articles connexes
- Acide maléique l'isomère cis de l'acide fumarique
- Acide citrique
- Acide malique
- Liste d'acides
Lien externe
- (en) Fumaric Acid Compendium of Food Additive Specifications (Addendum 7) Joint FAO/WHO Expert Committee on Food Additives 53 rd session
- Portail de la chimie
- Portail de la biochimie