Sclérose en plaques
La sclérose en plaques (SEP) est une maladie auto-immune qui touche des individus génétiquement prédisposés et préalablement infectés par le virus EBV. La myéline (gaine d'isolation des cellules nerveuses du cerveau et de la moelle spinale) du système nerveux central est endommagée par des lésions qui altèrent la capacité des différentes parties du système nerveux à communiquer entre elles, et engendrent de nombreux symptômes physiques et mentaux[1],[2],[3]. Deux formes principales existent : la forme rémittente, qui évolue par poussées, caractérisées par l’apparition de troubles en quelques jours, pouvant régresser complètement ou non en quelques semaines, et la forme progressive, dépourvue de poussées et qui évolue peu à peu[4].
Ne doit pas être confondu avec Sclérose.
| Symptômes | Douleur neuropathique chronique (d) |
|---|
| Médicament | Mitoxantrone, dantrolène, hydroxocobalamine, azathioprine, (RS)-baclofène, interféron bêta-1a, interféron bêta-1b (en), (RS)-cyclophosphamide, cyanocobalamine, cladribine, tériflunomide, fingolimod, aprémilast, alemtuzumab, rituximab, 4-aminopyridine, gabapentine, daclizumab, modafinil, natalizumab, armodafinil (en), méthylprednisolone, fumarate de diméthyle, prégabaline, 4-aminopyridine, bétaméthasone, monomethyl fumarate (en), fingolimod, tériflunomide et hormone corticotrope |
|---|---|
| Spécialité | Neurologie |
| CISP-2 | N86 |
|---|---|
| CIM-10 | G35 |
| CIM-9 | 340 |
| OMIM | 126200 |
| DiseasesDB | 8412 |
| MedlinePlus | 000737 |
| eMedicine |
1146199 oph/179 emerg/321 pmr/82 radio/461 |
| MeSH | D009103 |
| GeneReviews | Multiple Sclerosis Overview |
| Patient UK | Multiple-sclerosis-pro |
![]() Mise en garde médicale
Mise en garde médicale
Plusieurs hypothèses de causes (étiologie) ont été avancées, comme une destruction de la myéline par le système immunitaire ou une incapacité des cellules à la produire[5]. Des causes génétiques et environnementales, telles que des infections, ont aussi été proposées[2]. Le diagnostic est généralement posé d'après les signes et symptômes et grâce à des examens complémentaires.
Il n'existe pas de traitement curatif. Les médicaments et soins visent à améliorer les fonctions après une poussée ou à repousser de nouvelles crises[2]. Les médicaments utilisés sont modérément efficaces et peuvent avoir des effets secondaires. L'espérance de vie du patient diminue de 5 à 10 ans en moyenne[1].
C'est la maladie auto-immune affectant le système nerveux central la plus fréquente[6]. En 2008, 2 à 2,5 millions de personnes dans le monde étaient atteintes avec des prévalences très variables selon la géographie et les populations[7]. La sclérose en plaques n'est pas une maladie mortelle[8],[9]. La maladie débute généralement entre 20 et 50 ans et est près de deux fois plus fréquente chez les femmes[10].
Étymologie médicale
Le nom de la sclérose en plaques se réfère à des cicatrices (plaques) retrouvées dans la substance blanche[11].
L’étymologie du terme sclérose en plaques est fondée sur le grec ancien σκλήρωσις (sclérosis) qui signifie durcissement et le mot « plaque » (d'origine néerlandaise) indiquant l’étendue de ce « durcissement des tissus » dans plusieurs régions du cerveau et de la moelle spinale.
Histoire médicale
À l’époque antique des Grecs, Romains ou Égyptiens, aucune description de la sclérose en plaques n’a été retrouvée, même si Galien parlait déjà de tremblements d’action paralytique « tremor », et de tremblements de repos clonique, convulsif « palpitation ». La plus ancienne description évocatrice de la maladie « sclérose en plaques » (SEP) proviendrait de Scandinavie, d’une femme du peuple viking (1293-1323) présentant des troubles de la parole, de la marche avec des périodes de récupération.
Lidwine de Schiedam (XIVe siècle, Hollande) fait également partie des cas connus les plus anciens de la maladie. Cette jeune fille vécut une enfance normale puis présenta après ses 16 ans une maladie progressant lentement avec des périodes d’amélioration dont les symptômes étaient : des troubles de la marche, une paralysie au bras droit, une perte de la vue unilatérale, des douleurs lancinantes à la figure et des difficultés de déglutition.
Un troisième exemple ancien est celui d’Auguste d'Este (1794-1848, Angleterre), petit-fils du roi George III. Il retrace dans des passages de son journal l’historique de ses symptômes suggérant qu’il avait été touché par la sclérose en plaques[12]. Le début de sa maladie s’exprimait par une névrite optique bilatérale, une fatigue permanente, et des troubles de la sensibilité. Au fil du temps, la maladie progressa lentement avec l’apparition de paralysie des deux membres supérieurs, des raideurs dans les jambes qui s’accompagnaient de contractions très douloureuses des muscles des jambes et des pieds, l’empêchant parfois même de dormir[13]. Une période de récupération de la marche a été décrite et aurait eu lieu en quelques semaines d’après ses écrits[14]. Charles-Prosper Ollivier (d'Angers) publie à Paris en 1824, son Traité des maladies de la moelle épinière, une étude pionnière en matière d'anatomie, de physiologie et de pathologie de la moelle épinière. L'édition enrichie des livres parait en 1827[15]. Dans ces ouvrages, il décrit ce qui est probablement le premier cas de sclérose en plaques[16],[17].
Pendant qu’Auguste d’Este décrivait sa maladie en Angleterre, le professeur et anatomiste Jean Cruveilhier met en évidence, en 1835, les premières représentations des lésions médullaires antéropostérieures, dénommées « sclérose en taches ou en îles », complétées trois années plus tard par les illustrations du docteur Robert Carswell (1838).
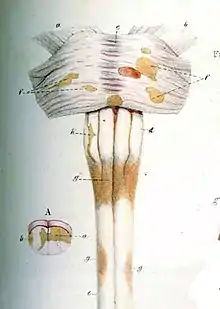
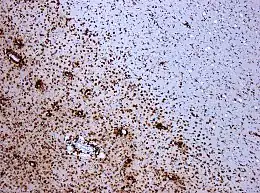
Les lésions sont à la fois présentes dans les matières blanche et grise, apparaissant sur l’image comme de petites taches brunes.
En 1863, Eduard Rindfleisch met en évidence une « inflammation de la substance blanche » et évoque la possibilité qu’elle soit responsable de la démyélinisation. Il note en effet la présence d’infiltrats inflammatoires périvasculaires au sein des plaques de sclérose, l’amenant à postuler que la maladie était de nature inflammatoire[18].
« Sclérose en taches ou en îles » est la première dénomination de la maladie remplacée par le terme sclérose en plaques et utilisé pour la première fois par un médecin français, A. Vulpian, en 1866 dans une présentation de trois malades devant la Société médicale des hôpitaux de Paris.
Jean-Martin Charcot[11], neurologue à l’hôpital de la Salpêtrière à Paris, contribua non pas à la première description mais à la première synthèse de la pathogénicité de la maladie dans ses célèbres « leçons sur les maladies du système nerveux », encore valable de nos jours. Sa description des symptômes cliniques s’inspire notamment de l’une de ses servantes qui présentait trois symptômes : une élocution mal articulée (dysarthrie), des mouvements saccadés des yeux (nystagmus), et un tremblement des bras lorsqu’elle voulait prendre un objet (tremblement intentionnel). À l’autopsie de son cerveau, Charcot montre la première corrélation anatomoclinique, puisqu’il découvrit de « petites taches » typiques de la SEP au niveau du cerveau et de la moelle épinière. Il proposa de poser le diagnostic de sclérose en plaques chez des malades qui présentaient l’association de ces trois symptômes, appelée triade de Charcot. Il a constaté rapidement que la sclérose en plaques pouvait se manifester par d’autres signes, notamment sur des formes bénignes, qu’il appelait formes frustes.
D’autres pathologies ont été décrites par Charcot dont la sclérose latérale amyotrophique (maladie de Charcot) qui porte son nom, et les lésions articulaires non douloureuses observées dans la syphilis. Il est le premier à distinguer le tremblement lié à la paralysie agitante décrit par James Parkinson au tremblement d’action de la sclérose en plaques. Pierre Marie, élève de Charcot et neurologue, proposa en 1884 une origine infectieuse (virale et bactérienne) de la sclérose en plaques liée à une réaction non spécifique aux infections à tropisme vasculaire comme la typhoïde, la variole, l’érésipèle, la pneumonie, la rougeole, la scarlatine, la coqueluche, la dysenterie ou le choléra[19].
Au XXe siècle, la présence de plaques dans la matière blanche du cerveau était déjà connue et a été observée également dans la matière grise par Jean-Martin Charcot. J.D. Dowson développe la notion de préservation des axones des neurones présents aux niveaux des plaques anciennes démyélinisées et confirme aussi la notion d’inflammation péri-vasculaire. En 1921, Hortega et Penfield mettent en évidence un type de cellule gliale chargé de produire la gaine de myéline entourant les axones, ce sont les oligodendrocytes. Des capacités de remyélinisation ont été découvertes au niveau du système nerveux après une démyélinisation induite expérimentalement au niveau de la moelle épinière chez le chat en 1961 par Richard et Mary Bunge.
Pendant la première moitié du XXe siècle ont été réalisées de nombreuses expériences d’inoculation non conclusives. L’injection de liquide cérébrospinal de patients atteints de sclérose en plaques à des animaux sains était censée déclencher les symptômes de la maladie. La recherche d’un agent infectieux (bactérien, viral, fongique) causal reste toujours infructueuse à ce jour. Cette piste infectieuse a donné lieu à des essais thérapeutiques antibiotiques, antiviraux et antifongiques en 1940 et par la suite en 2004 avec un essai pour la minocycline[19].
En parallèle de la conception d’une origine infectieuse de la maladie, la deuxième moitié du XXe siècle est marquée par le concept d’auto-immunité en tant que mécanisme physiopathologique. À cette période, E.A. Kabat révèle (en 1942) l’existence d’une augmentation du taux des gammaglobulines dans le liquide cérébrospinal, et Laterre celle de bandes oligoclonales (1964). L’hyperactivité du système immunitaire a conduit au développement d’immunosuppresseurs et d’immunomodulateurs, notamment les interférons b prescrits pour la première fois en 1993 et l’acétate de glatiramère mis sur le marché en 1996.
La fin du XXe siècle est marquée par l’essor de nouveaux outils diagnostiques tels que les potentiels évoqués visuels, auditifs, sensitifs, l’examen du liquide cérébrospinal par la recherche qualitative de bandes oligoclonales et quantitatives d’immunoglobuline G (IgG), et l’imagerie par résonance magnétique (IRM).
À ce jour, même si la pathogénie reste encore mal connue, la prise en charge se fonde sur une approche pluridisciplinaire.
Diagnostic
Clinique
Interrogatoire
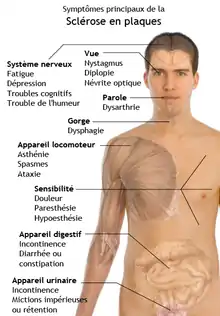
La maladie débute typiquement entre 20 et 40 ans (70 % des SEP sont diagnostiqués entre 20 et 40 ans, 10 % dans l'adolescence, 20 % après 40 ans dont 3 % après 50 ans). Elle est rare chez les enfants de moins de 10 ans. Elle touche plus les femmes que les hommes (en France le rapport est de 1,7)[20].
Certains éléments caractéristiques doivent faire suspecter une sclérose en plaques : des accidents neurologiques répétés, régressifs (au moins en début de maladie), touchant des fonctions variables (vision, motricité, sensibilité, etc.), des poussées disséminées dans le temps et dans l'espace.
Assez rarement, des troubles psychotiques peuvent inaugurer une sclérose en plaques[21] ou apparaître plus tard, avec une modification du comportement sous forme de dysthymie, dépression[1], syndrome maniaque (trouble de l'humeur) plus ou moins marqué. Ils peuvent être dus à des lésions cérébrales liées à la SEP affectant les zones du système limbique (structure subcorticale située autour du thalamus) mais plus souvent associés à un état d'anxiété sous-jacent engendré par l'incertitude de la maladie.
Examen physique
- Le syndrome pyramidal est inaugural (révélateur) de la maladie dans 20 % des cas. Il se manifeste par des troubles de la marche avec une fatigabilité importante, une spasticité, des réflexes exagérés au niveau des membres inférieurs, la présence d'un signe de Babinski, une abolition des réflexes cutanés abdominaux. À l'issue de la poussée, le signe de Babinski persiste souvent comme séquelle.
- La névrite optique rétrobulbaire est également révélatrice de la maladie dans près d'un tiers des cas : c'est le symptôme le plus évocateur. Il se manifeste pour le malade par une baisse d'acuité visuelle rapide et profonde, des douleurs oculaires et orbitaires, augmentées aux mouvements des yeux, un scotome central ou cæcocentral et un trouble de la vision des couleurs (dyschromatopsie de l'axe rouge-vert). Au stade aigu, le fond d'œil est normal (« le patient ne voit rien, et l'ophtalmo non plus »), et ce n'est qu'après une quinzaine de jours qu'apparaît une atrophie de la papille, témoin de l'atteinte du nerf optique et persistant parfois comme séquelle. Les potentiels évoqués visuels sont altérés, on obtient un ralentissement de l'onde P100. La récupération visuelle est souvent bonne et se fait en quelques semaines.
- Troubles de la sensibilité :
Ils sont essentiellement subjectifs : paresthésies, fourmillements, signe de Lhermitte positif (sensation de décharge électrique le long du rachis lors de la flexion du cou). Un syndrome cordonal postérieur est parfois diagnostiqué, avec des troubles de la sensibilité profonde, et plus rarement une atteinte du faisceau spinothalamique avec une anesthésie thermoalgésique. Des douleurs de la face, ou, à l'opposé, une anesthésie, sont possibles[22] en cas d'atteinte du nerf trijumeau dans sa portion bulbaire. - Un syndrome vestibulaire associant vertige rotatoire, nystagmus, et ataxie.
- Un syndrome cérébelleux : les plaques de démyélinisation sont fréquentes dans le cervelet et dans la fosse postérieur en général, pouvant donner un syndrome cérébelleux avec station debout instable, marche ébrieuse, mouvements dysmétriques, etc.
- Une diplopie consistant en une sensation de vision dédoublée par anomalie des muscles oculomoteurs (généralement le droit latéral innervé par la sixième paire de nerfs crâniens). Une ophtalmoplégie internucléaire est possible en cas d'atteinte des bandelettes longitudinales postérieures (qui font le lien entre les noyaux des nerfs oculomoteurs et assurent leur fonctionnement harmonieux) qui se manifeste dans le regard latéral par une adduction incomplète d'un œil associée à un nystagmus de l'œil en abduction.
- Des troubles génitosphinctériens qui sont fréquents et liés à une atteinte de la moelle épinière. Ils se manifestent par des mictions impérieuses (ou une rétention urinaire), la constipation, l'impuissance. Ces troubles sont source de rétention aigüe d'urine, d'infections urinaires et de détresse psychologique et sont une priorité thérapeutique.
- Une paralysie faciale par atteinte du nerf facial dans son trajet protubérantiel (c’est-à-dire dans le tronc cérébral).
- Une asthénie (fatigue), symptôme fréquent de la sclérose en plaques et qui est considéré par près de 55 % des patients comme étant le symptôme le plus invalidant[23].
- Une hyperacousie peut aussi apparaître[24].
Examens complémentaires
- L'IRM représente le meilleur examen pour visualiser les lésions caractéristiques de la SEP : on retrouve en séquence T2 des zones d'hypersignal (c’est-à-dire très blanches) de taille variable, de forme arrondie, sans effet de masse sur les autres structures, disposées préférentiellement autour des ventricules cérébraux, dans la moelle et dans la fosse postérieure. En séquence T1, ces zones peuvent être en iso- ou en hyposignal.
Les lésions visualisées sont souvent anciennes et asymptomatiques. Les lésions jeunes, responsables de la poussée en cours, se remarquent car elles prennent le contraste lors de l'injection de gadolinium (elles se rehaussent). Ces signes ne sont pas spécifiques de la sclérose en plaques, et se voient fréquemment chez le sujet âgé normal. Ainsi, en cas de diagnostic incertain, une IRM peut à tort qualifier de malade un patient qui en est indemne[25] : c'est essentiellement la conjonction temporelle entre accident neurologique et plaques jeunes qui fait la valeur de ces images IRM. L'évolution clinique reste cependant l'élément le plus utile au diagnostic : 2 poussées distinctes à plus de 30 jours d'intervalle ou deux lésions de localisations différentes.
- La ponction lombaire n'est pas toujours indispensable au diagnostic. Elle a une intéressante valeur diagnostique lorsqu'elle retrouve un liquide cérébrospinal inflammatoire, avec un taux de protéines élevé (supérieure à 1 g·l-1, la normale étant de moins de 0,4 g·l-1) et au sein de ces protéines une proportion trop élevée d'immunoglobulines (plus de 14 %), qu'une électrophorèse démontrera être de nature oligoclonale (c’est-à-dire constituée de plusieurs types d'immunoglobulines). Enfin, la lymphocytose est modérée, inférieure à 50 lymphocytes par millimètre cube de liquide cérébrospinal. Leur étude sur les potentiels évoqués retrouve fréquemment un allongement du temps de latence centrale.
Critères diagnostiques
Les critères ont été publiés en 2001[26] et modifiés en 2005[27]. Le diagnostic recherche une dissémination dans le temps et l'espace des lésions.
| Présentation clinique | Éléments complémentaires requis pour le diagnostic |
|---|---|
| Au moins 2 poussées, et au moins 2 sites affectés | Aucun |
| Au moins deux poussées, et un seul site affecté | Dissémination spatiale des lésions à l'IRM, ou poussée clinique suivante dans un site différent |
| 1 poussée et au moins 2 sites affectés |
Dissémination temporelle des lésions à l'IRM, ou 2e poussée clinique |
| 1 seule poussée | Dissémination spatiale des lésions à l'IRM ou au moins 2 lésions évocatrices à l'IRM et LCR + et dissémination temporelle sur des IRM successives ou 2e poussée clinique |
| Progression insidieuse évocatrice de SEP | Une année de progression de la maladie établie de manière prospective ou rétrospective et 2 des critères suivants :
|
Formes

La sclérose en plaques peut avoir quatre formes évolutives:
- Forme récurrente-rémittente (SEP-RR)
Exacerbations alternant avec des rémissions lors desquelles on observe une reprise partielle ou totale ou une stabilité des symptômes. Les rémissions peuvent durer des mois ou des années. Les exacerbations peuvent survenir spontanément ou être déclenchées par une infection comme la grippe. 85 % des patients atteints de SEP ont initialement une forme récurrente-rémittente[28]. - Forme secondairement progressive (SEP-SP)
Aussi appelée progressive secondaire. Cette tendance commence avec des rechutes alternant avec des rémissions, suivies par une progression graduelle de la maladie. Près de 90 % des cas de SEP-RR évoluent en SEP avec une forme progressive secondaire[29]. - Forme progressive primaire (SEP-PP)
Ou progressive d'emblée. La maladie évolue progressivement sans rémissions, mais il peut y avoir des plateaux temporaires pendant lesquels la maladie ne progresse pas. Contrairement à la tendance cyclique, il n'y a pas d’exacerbations claires. Environ 10 % des patients atteints de SEP ont une forme progressive primaire[28]. - Forme récurrente-progressive (SEP-PR)
C'est le cas le plus rare, environ 5 % des patients atteints de SEP ont une forme récurrente-progressive. La maladie évolue progressivement et s'accompagne de rechutes. Il peut y avoir ou non une forme de rétablissement après ces rechutes, mais la maladie continue de progresser sans rémission[28].
Diagnostic différentiel
Des pathologies voisines de la sclérose en plaques sont également observées se situant aux alentours des frontières imprécises des limites de la maladie et recensant les cas que l'on ne peut classifier dans ou hors de la SEP. Elles sont[30] :
- la neuromyélite optique de Eugène Devic ;
- trois autres formes pathologiques : la sclérose concentrique de Balo, la maladie de Schilder et sa forme maligne, appelée la sclérose de Marburg ;
- d'autres affections : la neuropathie périphérique autoimmune et l'encéphalomyélite aigüe disséminée (ADEM).
La maladie ne doit pas être confondue avec une borréliose (de type maladie de Lyme au stade II ou III), la sarcoïdose, un neurolupus, une encéphalite à VIH, une myofasciite à macrophages ou la fibromyalgie. D'autres diagnostics peuvent être évoqués devant des déficits neurologiques intermittents (il n'est cependant pas difficile de les différencier de la SEP) incluant des migraines accompagnées d'aura migraineuse, les accidents vasculaires cérébraux (ischémiques ou hémorragiques) transitoires répétés, une thrombose veineuse cérébrale, un déficit post-critique à la suite d'une crise d'épilepsie et d'un trouble de conversion.
Étiologie, physiopathologie
Les causes de la sclérose en plaques sont encore discutées mais le rôle du EBV semble se préciser.
Elles associent des facteurs génétiques (la famille d'un malade risque plus d'être touchée que la population générale), des facteurs environnementaux (les pays riches et tempérés sont par exemple beaucoup plus touchés que les pays tropicaux, quelle que soit l'origine ethnique, peut-être en raison d'une diminution de l'exposition aux UV solaires et donc de la vitamine D[31],[32]). Des facteurs déclencheurs semblent exister (par exemple infectieux, par hypersensibilité ou naissance d'une réponse auto-immune après une infection banale)[33]. La maladie semble être déclenchée par des éléments environnementaux qui agissent comme des facteurs de dérégulation de l'immunité, d'inflammation et de dégénérescence des nerfs[34]. À ce titre, chez les patients atteints de SEP peut être trouvé un taux très élevé d'anticorps dirigés contre certains virus (en particulier la rougeole et le virus Epstein-Barr[35]).
En 1952, Butler[36] ne peut confirmer l'hypothèse que certains symptômes (neuropsychiatriques notamment) de cette maladie pourraient provenir d'un saturnisme discret induit par le relarguage (au moment des crises) de plomb stocké dans le squelette.
La glande pinéale semble directement ou indirectement impliquée ; des taux nocturnes de mélatonine inférieurs à la normale et même aux valeurs diurnes (c.-à-d. < 25 pg/ml) étaient trouvés chez environ 50 % des patients étudiés dans une étude conduite par Sandyk & Awerbuch en 1992[37] ; le taux de mélatonine n'est pas lié à l'âge ni au sexe du patient, mais il existait dans ces cas une corrélation positive avec l'âge d'apparition des symptômes et une corrélation inverse avec la durée de la maladie. En outre, une calcification de la glande pinéale a été constatée chez 24 des 25 patients (96 %) et les niveaux d'alpha-MSH étaient anormaux chez plus de 70% de ces patients (avec une corrélation avec l'exacerbation des symptômes)[37]
Une autre étude montre qu'un traitement par la mélatonine améliore légèrement le sommeil des malades (1999)[38]. En 2008, Akpınar & al. montrent qu'une production nocturne anormalement faible de mélatonine augmente le risque de dépression sévère chez ces malades[39], ce qui suggère qu'une luminothérapie pourrait aider certains malades à abréger leurs crises ou en réduire la gravité[40].
En 2012, une étude finlandaise montre que des caractéristiques génétiques induisant une dérégulation dans la voie de la mélatonine aggravent les symptômes de la sclérose en plaques[41], ce qui invite selon les auteurs à explorer les liens entre la voie de la mélatonine et la progression de la maladie ou des moyens de lutter contre ce type de neurodégénérescence[41].
En 2018, une équipe suisse d'immunologistes de l'Hôpital universitaire de Zurich pense avoir peut-être trouvé la molécule auto-antigène (depuis longtemps cherchée) qui serait très impliquée dans le retournement du système immunitaire contre l'organisme du malade[42],[43].
Jusqu'ici les molécules suspectées de rendre les lymphocytes autoréactifs étaient les protéines de la myéline. Le lymphocyte T CD4+ ne devrait s'activer que quand elle est confrontée à des fragments de protéines contenant des séquences d'acides aminés typiques de microbes reconnus par notre organisme comme extérieurs à lui-même et potentiellement dangereux. Mais elle s'active aussi chez les personnes atteintes de Sclérose en plaques[42]. 200 mélanges de fragments contenant chacun 300 milliards de variétés de fragments de protéines ont été testés en laboratoire : 2 fragments ayant déclenché les réactions les plus fortes provenaient d'une enzyme humaine dite guanosine diphosphate-L-fucose synthase qui est abondante dans le cerveau mais qu'on n'avait jamais pensé à associer à la SEP. Cette enzyme permet aux cellules de remodeler des sucres, lesquels sont en jeu dans un très grand nombre de mécanismes, dont par exemple le type de groupe sanguin ou la mémoire[42]. Des lymphocytes T CD4+ ont été prélevés dans le liquide cérébrospinal de 12 des 31 patients diagnostiqués pour une SEP ou présentant les symptômes précoces de la maladie[42]. Ils se sont activés face à cet enzyme[43]. Et chez quatre patients testés parmi huit, ils ont aussi réagi face à une version bactérienne de l'enzyme, ce qui pourrait étayer l'hypothèse que des bactéries de l'intestin pourraient jouer un rôle dans le déclenchement de la maladie (réactivité croisée avec des peptides dérivés du microbiote, hypothèse considérée avec prudence par l'immunologie Ashutosh Mangalam (Université de l'Iowa) qui note que certaines des bactéries synthétisant cette enzyme sont plus rares chez les malades de SEP que chez les personnes en bonne santé[42]). Si l'hypothèse est confirmée, elle pourrait aboutir à de nouveaux traitements[42] ; par exemple l'équivalent d'un traitement de désensibilisation à la guanosine diphosphate-L-fucose synthase pourrait soulager les patients (notamment des engourdissements et des problèmes de faiblesse musculaire qu'ils connaissent) ; ce type de traitement pourrait être testé dès 2019[42].
La sclérose en plaques est donc une maladie auto-immune (liée à l'activité anormale de certains anticorps dirigés contre la gaine de myéline des fibres nerveuses), qui pourrait avoir plusieurs déclencheurs (après un évènement probablement viral ou bactérien, chez un sujet génétiquement prédisposé à la maladie[33]).
En janvier 2022, une étude américaine publiée dans la revue Science suggère que le virus d'Epstein-Barr (EBV) serait quasi-systématiquement à l'origine de la maladie[44],[45],[46].
Facteurs de risque
La SEP est une maladie polyfactorielle. Elle trouve un terrain favorable chez une catégorie d'individus (gènes de susceptibilités). Mais, pour déclencher la maladie, il faut aussi inclure des facteurs d'environnement.
Les formes familiales ne sont pas rares avec un risque relatif de 9 si l'un des membres de la fratrie est atteint[1]. Depuis les années 1970, des gènes associés dans la survenue de la maladie ont été peu à peu découverts, en particulier au niveau du groupe HLA[47]. En juillet 2007, deux variants de gènes ont été identifiés, IL2RA et IL7RA, tous deux codant des récepteurs aux interleukines intervenant dans l'immunité et dont la présence augmenterait (faiblement) le risque de développer la maladie[48].
La SEP est plus répandue chez les femmes que chez les hommes (3 pour 1).
3 facteurs d'environnement principaux susceptibles de provoquer la maladie sont mis en avant: l'action d'une bactérie intestinale, l'alimentation moderne, le stress.
Le tabagisme est un facteur de risque indépendant qui augmente le risque de développer une sclérose en plaques[2].
L' alcoolisme.[réf. nécessaire]
L'obésité au moment de l'adolescence et le type HLA sont mis en cause[49].
L'hypothèse est à l'étude, sur la base d'observations épidémiologiques aux îles Féroé, d'une exposition concomitante au virus EBV et à des viandes conservées par des nitrites ou des nitrates[50].
Une étude épidémiologique conduite dans 27 pays (29 populations réparties de par le monde) a conclu à une corrélation « très significative » entre le fait de consommer du lait et la prévalence de la sclérose en plaques (p<0,001)[51],[52]. Une corrélation a aussi été retrouvée, mais moindre entre cette prévalence et la consommation de certains produits laitiers crus tels que le beurre ou la crème (p≤0,01), mais non avec le fromage[51]. Comme presque tout le lait (plus de 95 %) consommé dans le monde provient de vaches, les auteurs posent l'hypothèse que le lait de vache pourrait être en cause ou l'une des causes, soit parce qu'il contiendrait un produit chimique favorisant la SEP (ex. : butyrate ?)[51], soit parce qu'il contiendrait un agent de type rétrovirus[51] (« peut être celui isolé par Perron »[51]). En Australie la densité de vaches par hectare est fortement corrélée au risque de SEP. Ceci peut aussi faire évoquer un agent pathogène[51].
Le vaccin contre l'hépatite B n'a aucune responsabilité démontrée dans l'apparition de SEP[53]. Il était accusé de provoquer le déclenchement de la maladie de la part de certains malades eux-mêmes, mais aucun lien n'a jamais pu être établi.
Lésions anatomiques
Ce sont des plaques plus ou moins étendues de démyélinisation au sein de la substance blanche du système nerveux central (constituée de fibres nerveuses, c’est-à-dire de prolongements neuronaux : les axones). Ces fibres nerveuses sont normalement entourées d'une gaine de myéline constituée par les oligodendrocytes au niveau de l'axone proche du neurone et constituée de plus, au niveau du nerf, par les cellules de Schwann (celles-ci recouvrent la gaine de myéline qui est une couche lipidique formée par l'enroulement de la membrane plasmique de la cellule de Schwann), qui assument ce rôle dans le système nerveux périphérique (qui lui n'est pas touché par la SEP). La gaine de myéline est détruite lors d'une poussée de la maladie : la gaine est détruite, mais l'axone est intact. Cette démyélinisation entraîne une altération de la conduction électrique dans l'axone (les informations transitent moins vite, voire pas du tout), ce qui aboutit à des signes cliniques variés, qui apparaissent en quelques jours.
La particularité de cette maladie est son évolution, marquée par des phases de poussées (lors de la constitution d'une nouvelle zone de démyélinisation) et de rémission (lorsque la plaque cicatrise, avec remyélinisation partielle) avec amélioration parfois spectaculaire des symptômes. Malheureusement, avec le temps, les nouvelles poussées cicatrisent moins bien, les axones finissent par être altérés également. Les altérations neurologiques finissent par ne plus régresser, constituant des lésions définitives. Le rythme des phases de poussées/rémissions est très variable d'un individu à l'autre, ce qui fait que pour certains la maladie reste très longtemps sans impact majeur en dehors des poussées, alors que chez d'autres une détérioration rapide de la qualité de vie survient en rapport avec des poussées fréquentes et peu résolutives. Il existe aussi la forme évolutive qui consiste en une poussée permanente.
L'insuffisance veineuse cérébrospinale chronique (IVCC), une anomalie du drainage sanguin entre le cerveau et la moelle épinière, pourrait contribuer aux dommages du système nerveux observés dans la sclérose en plaques (SEP)[54]. Cette hypothèse a été étudiée[55] mais les résultats ont été mis en doute[56],[57],[58]. Le traitement proposé, l'angioplastie des veines à destinée cérébrale, est considéré par la FDA américaine comme dénué de toute preuve d'efficacité[59].
Sclérose en plaques et grossesse
La maladie de la sclérose en plaques se déclare dans la plupart des cas entre 20 et 35 ans chez les femmes, elle touche donc typiquement des femmes en âge de procréer et ayant l'envie d'avoir un enfant. Ainsi, il est important d'aborder la notion de grossesse avec les femmes atteintes de la maladie. Si avant les années 1950 la grossesse était considérée comme une mise en danger de la patiente, aujourd'hui les médecins sont rassurants quant à la prise en charge d'une patiente enceinte et atteinte de la maladie. La sclérose en plaques ne semble pas intervenir sur le degré de fertilité, sur l'accouchement ou l'avortement volontaire, et n'a pas d'incidence sur la prématurité de l'enfant ou l'existence de la toxémie gravidique. De même, les pourcentages du périmètre crânien, du poids de naissance, de la mortalité infantile ou encore des malformations congénitales ne sont pas plus élevés chez un enfant dont la mère est atteinte de sclérose en plaques.
La grossesse peut avoir des effets positifs sur la maladie, puisque le score de poussée des plaques diminue jusqu'à 70 % lors du dernier trimestre de grossesse. Néanmoins, il faut surveiller l'avancée de la maladie après l'accouchement, puisqu'on repère une augmentation des poussées dans les trois premiers mois post-partum. Après le premier trimestre post-partum la fréquence des scores de poussées revient au même stade que celui avant la grossesse.
L'allaitement est possible pour les patientes atteintes de SEP, sauf lorsqu'elles prennent un traitement contre-indiqué. L'anesthésie péridurale est également possible et ne comporte pas plus de risque que pour les femmes non atteintes de SEP. La grossesse et la sclérose en plaques ne sont donc pas incompatibles.
La découverte du recul des poussées lors de la grossesse ouvre de nouvelles possibilités de recherche. Notamment le rôle des hormones sexuelles lors de la grossesse chez les femmes atteintes de SEP, en effet ces hormones peuvent constituer un traitement de fond de la maladie[60].
Évolution

- Pas de données
- Moins de 15
- 15-18
- 18-21
- 21-24
- 24-27
- 27-30
- 30-33
- 33-36
- 36-39
- 39-42
- 42-45
- Plus de 45
L'évolution est très variable entre les individus, elle est généralement lente, sur plusieurs décennies. Elle se fait typiquement par poussées régressives. La seconde poussée survient dans la moitié des cas moins de deux ans après la première manifestation de la maladie[1]. Avec le temps, les rémissions sont moins complètes, aboutissant à des séquelles fonctionnelles, la perte de la marche survient en moyenne 20 ans après le début de la maladie[61].
L'espérance de vie des personnes atteintes de sclérose en plaques (SEP) est d'environ 7 ans de moins (74,7 ans) comparé à celle des sujets sains (81,8 ans) et un taux de mortalité presque 3 fois plus élevé ; la sclérose en plaques est liée à plus de la moitié des morts (56,4%), souvent dues à une infection causée par les problèmes qu'engendre la maladie, les autres décès sont dus à un problème vasculaire ou cardiovasculaire (14,8%), ou un cancer (14,1%)[62],[63].
L'espérance de vie des patients atteints de SEP récurrente-rémittente (SEP-RR) et de SEP progressive primaire (SEP-PP) était respectivement de 77,8 ans et de 71,4 ans[63].
Les SEP récurrente-progressive (SEP-PR, c'est-à-dire n'évoluant pas par poussées régressives) sont, en règle générale, réfractaires à tout traitement[1].
Traitement
La prise en charge de la sclérose en plaques a fait l'objet de la publication de recommandations. Celles, européennes, datent de 2018[64].
De la poussée
Les poussées évoluent naturellement vers la rémission spontanée. Si elles sont invalidantes, elles peuvent recevoir un traitement par corticostéroïdes, qui permettraient de raccourcir leur évolution, de hâter la guérison, mais pas de prévenir une autre poussée[65]. L'hospitalisation en service de neurologie n'est pas indispensable : les perfusions de corticoïdes sont de plus en plus souvent réalisées à domicile, avec l'aide de protocoles établis par les réseaux de santé spécialisés Sclérose en plaques. Toutefois, l'hospitalisation est souvent conseillée pour réévaluer l'état neurologique, ce qui peut, entre autres, amener à rediscuter le traitement de fond. La corticothérapie se fait à dose élevée (1 000 mg·j-1 par voie intraveineuse), pendant 3 à 5 jours.
Des corticostéroïdes sont parfois prescrits en relais par voie orale pour environ 3 semaines, associés à des mesures de prévention des effets secondaires des corticostéroïdes (régime désodé, supplémentation en calcium, en potassium, en vitamine D, surveillance du poids, de la pression artérielle, de l'humeur, de l'état cutané). Selon l'atteinte, des séances de kinésithérapie sont proposées. Les échanges plasmatiques ont également une certaine efficacité sur la poussée aigüe principalement en cas de récupération insuffisante après les perfusions de corticoïdes mais pas sur la survenue des récidives[66].
D'un point de vue non médicamenteux, il est conseillé de prendre du repos (arrêt de travail systématique) et d'éviter les situations de chaleur. En effet, la chaleur, interne en cas de fièvre, ou externe en cas de temps chaud, peut favoriser une poussée ou une résurgence d'un ancien symptôme (phénomène d'Uhthoff). C'est pourquoi il y a plusieurs années un des traitements de la poussée consistait en un bain froid.
Dans les formes résistantes, une plasmaphérèse peut être proposée[67], avec un taux de réponse dépassant 70%[68].
Médicamenteux
Les traitements médicamenteux ne sont pas parfaits. Ils agiraient pour la plupart en modulant ou en déprimant le système immunitaire. Il est nécessaire de s'assurer pour chaque patient que leur balance bénéfice-risque est positive.
L'interféron bêta[69] a fait la preuve de son efficacité à 2 ans dans la sclérose en plaques (poussées moins nombreuses et moins sévères, amélioration des lésions visibles en IRM, parfois moindre évolutivité du handicap).
Il existe l'interféron bêta-1b (administré par injections sous-cutanées), et l'interféron bêta-1a (administré par injections sous-cutanées ou intra-musculaires par une infirmière puis, la plupart du temps, par le patient lui-même tous les jours ou trois fois par semaine). Les indications du traitement par interféron sont les SEP rémittentes avec au moins deux poussées sur les deux ou trois années précédentes, ou les SEP secondairement progressives avec persistance de poussées (aggravation continue et progressive, sans rémission entre les phases aigües). Les indications s'étendent actuellement pour un début précoce du traitement dès la première poussée sous certaines conditions car il pourrait alors diminuer les séquelles fonctionnelles[70]. L'interféron est contrindiqué au cours de la grossesse et l'allaitement, chez les épileptiques non stabilisés, et au cours des dépressions sévères. Il peut entraîner un symptôme pseudo-grippal, une lymphopénie, une hépatite médicamenteuse. Parfois, les injections répétées laissent des lésions sur la peau. L'efficacité à long terme reste cependant discutée[71].
L'acétate de glatiramère (Copaxone), quant à lui, est un copolymère constitué de plusieurs acides aminés. Il semble espacer les poussées chez les patients ambulatoires (pouvant encore marcher seuls) atteints de sclérose en plaques évoluant par poussée de type récurrente/rémittente caractérisée par au moins deux poussées au cours des deux années précédentes, de manière aussi efficace que l'interféron[72]. Il agirait en provoquant une tolérance des lymphocytes vis-à-vis de la myéline[73]. Il n'est pas démontré qu'il soit plus efficace que l'interféron ß pour limiter l'évolution en cas de suspicion de sclérose en plaques. L'injection quotidienne sous-cutanée est faite par le patient lui-même.
Le natalizumab, un anticorps monoclonal dirigé contre la chaîne alpha de l'intégrine des leucocytes, est utilisé avec un certain succès[74],[75]. Il peut être proposé dans les SEP rémittentes, soit en première intention dans les cas sévères (deux poussées en un an avec séquelles), soit après échec des interférons (une poussée en un an malgré le traitement). Il nécessite une injection régulière intra-veineuse en milieu hospitalier.
Dans les formes sévères, il peut être proposé d'utiliser des immunosupresseurs, parmi lesquels la mitoxantrone, plus efficaces que les corticoïdes[76], mais qui comportent beaucoup plus d'effets secondaires. La prise en charge sociale et psychologique est nécessaire, par intégration à des groupes de malades, maintien d'un emploi et au besoin adaptation du poste de travail, psychothérapie, traitement d'une dépression ou d'un état anxieux. Il nécessite une injection régulière intra-veineuse en milieu hospitalier.
Le fingolimod [77], le diméthyl-furamate [78]et le tériflunomide [79] ont l'AMM en France pour le traitement de la sclérose en plaques de forme rémittente. Ils ont chacun leurs effets secondaires et leurs risques potentiels (avec un recul bien moindre que les interférons et le glatiramer). Leur efficacité n'est pas assurément supérieure aux interférons, mais ils ont l’avantage d'être pris oralement au domicile.
Dans le registre des traitements immunomodulateurs, la greffe de cellules souches hématopoïétiques peut constituer un traitement dans les formes réfractaires de la maladie[80], permettant d'en freiner l'évolution[81].
L'acide orotique, ex-vitamine B13, est utilisé en complément alimentaire aux États-Unis pour traiter la sclérose en plaques.
Même si elle n'a pas aujourd'hui la valeur d'un traitement de la sclérose en plaques, il est habituel de vérifier l'absence de carence en vitamine D chez un (e) patient(e) présentant une SEP. En effet, il semble de plus en plus que la carence en vitamine D soit un facteur d'apparition ou de mauvaise évolution de la maladie [82].
La vitamine B1 ou thiamine a montré une efficacité lors d'une étude française récente mais à des doses nécessitant une préparation spécifique en pharmacie hospitalière. Cet espoir de traitement, le premier dans la SEP de forme progressive, est en cours de confirmation[réf. nécessaire].
Non médicamenteux
Un traitement par exposition de la glande pinéale à un champ magnétique a aussi été testé [83].
La luminothérapie pourrait dans certains cas apporter des améliorations[40].
La psychothérapie et des pratiques de méditation semblent pouvoir améliorer le bien-être du patient. Une thèse récente () sur l'effet de la méditation et du « mouvement authentique » a conclu qu'une meilleure relation du patient avec lui-même peut l'aider à cultiver l'intéroception et l'imagination active, deux outils de réflexion pouvant améliorer le bien-être psychologique du patient. On observerait : « un sens de soi plus fort et un locus de contrôle interne qui peut avoir été perdu au cours de l'évolution de la maladie »[84].
Association de patients
En France, de nombreuses associations participent à la lutte contre la sclérose en plaques. La Fondation pour la recherche sur la sclérose en plaques (Fondation ARSEP) issue le l'Association ARSEP[85], la Ligue française contre la sclérose en plaques[86] et l'Association Française des Sclérosés en Plaques[87] sont notamment présentes au niveau national. APF France handicap[88] dispose également de très nombreuses délégations qui viennent en aide quotidiennement aux patients atteints de SEP et leurs proches. Cette action est par ailleurs renforcée, au niveau local, par l'engagement d'associations régionales proposant un soutien de proximité à toutes les personnes concernées par la sclérose en plaques. L'Association Notre Sclérose avec son site internet permet aux patients et proches de s'exprimer mais également de rejoindre une communauté d'entraide entre patients. L' association SEP'Avenir[89], permet aux patients nouveaux diagnostiqués, ou, anciens, de profiter bénévolement d'un parrainage avec un membre de l'association, pour échanger, être écouter, par quelqu'un qui a déjà cette pathologie.
Certaines associations se sont regroupées au sein de l'UNISEP.
En Belgique, une association de patients et de médecins a mis sur pied un programme de soutien sportif, baptisé Besep pour accompagner les personnes atteintes de sclérose en plaques (et d'autres pathologies chroniques altérant la mobilité, telles : la maladie de Parkinson, la fibromyalgie) dans des salles de fitness ou dans des programmes de jogging[90]. Ce programme est officiellement soutenu par différentes institutions hospitalières de Belgique dont le Centre hospitalier universitaire de Liège.
Au Canada, la société canadienne de la sclérose en plaques (SCSP) lutte contre la maladie[91].
Traitements symptomatiques
Ils ont pour but de traiter les complications de la maladie, ce qui améliore la qualité de vie des malades. Ils représentent donc un complément essentiel des traitements précédents. Ils sembleraient avoir une certaine efficacité[92]. Une prise en charge multidisciplinaire (kinésithérapie, rééducation fonctionnelle, soutien psychologique, ergothérapie, soins infirmiers, aide sociale, etc.) permet d'améliorer le quotidien des malades en limitant le retentissement de leur maladie.
La prise en charge kinésithérapique est primordiale pour entretenir l'autonomie du patient[93] :
- travail de l'équilibre sur plateau de proprioception (travail proprioceptif) ou sur plateau de Freeman (travail vestibulaire) ;
- renforcement musculaire par un travail actif manuel ou instrumental ;
- lutte contre la spasticité (hypertonie pyramidale) ;
- amélioration du périmètre et de la qualité de la marche ;
- rééducation vésico-sphinctérienne ;
- prévention des chutes par rééducation de l'équilibre, même si l'efficacité de ces techniques n'est pas probante[94].
L'activité physique est recommandée, permettant une conservation de l'autonomie[95] et une amélioration de la qualité de vie[96]. Il pourrait même jouer sur les troubles cognitifs[97].
Le traitement par la psychothérapie cognitivo-comportementale [réf. nécessaire] peut donner de bons résultats dans certains cas surtout en cas de trouble psychique associé.
La spasticité peut être combattue par des antispastiques (baclofène[98] ou dantrolène [99]), à prescrire d'abord à faible dose pour éviter d'aggraver l'état moteur du malade par une hypotonie. Dans les spasticités sévères, les injections locales de toxine botulinique ou l'implantation de pompe intrarachidienne de baclofène peuvent être indiquées. La kinésithérapie permet de lutter contre l'hypertonie et les déformations.
Les troubles urinaires doivent être surveillés et traités pour éviter une atteinte du haut appareil urinaire. En plus de l'approche clinique, un bilan urodynamique et radiologique est souvent nécessaire. S'il existe une hyperactivité vésicale se traduisant par des urgences mictionnelles, les anticholinergiques sont utilisés. En cas de dysurie, les alphabloquants peuvent être prescrits. En cas de résidu post-mictionnel, la pratique d'autosondages intermittents quotidiens doit être proposée aux malades, éventuellement associés dans un second temps à une injection intravésicale de toxine botulinique. Les infections urinaires seront traitées pour éviter les pyélonéphrites. Elles constituent de plus des épines irritatives pouvant aggraver la spasticité.
Les troubles sexuels, en particulier de l'érection, peuvent être améliorés par une prise en charge médicamenteuse et par un suivi sexologique ou psychothérapique.
Les douleurs peuvent être soulagées par des antalgiques classiques, des tricycliques, certains antiépileptiques ou encore la cryothérapie corps entier[100].
La fatigue est difficile à combattre. Les médicaments antiasthéniques sont peu efficaces.
Une prise en charge psychothérapique est souvent nécessaire, car il existe fréquemment un syndrome dépressif associé ; des antidépresseurs sont souvent prescrits.
Les troubles de la marche peuvent-être améliorés par la fampridine (commercialisé sous le nom de Fampyra)[101],[102]. Il nécessite des tests de marche avant et après 15 jours de traitement. Pour les 40 % de personnes pour lesquelles le traitement est efficace, il faut faire un suivi des fonctions rénales.
Recherche
Elle porte sur une meilleure évaluation de l'état de santé et de la qualité de vie des patients[103], sur une meilleure compréhension du profil épidémiologique, clinique et évolutif de la maladie, des effets des traitements ou de pratiques sportives (chez les patients enfants ou adolescents[104]).
Médicaments
Le traitement des poussées repose sur des corticoïdes à haute dose alors que les traitements de fond des formes récurrentes rémittentes sont en première intention des immunomodulateurs (Interférons) puis des immunosuppresseurs (Mitoxantrone, Natalizumab..). Les anticorps monoclonaux ciblent spécifiquement un antigène[105].
Le rituximab, un anticorps monoclonal permettant de faire baisser le nombre de lymphocytes B, aurait également une certaine efficacité sur l'évolution de la sclérose en plaques[106], ce qui est également un autre argument sur le caractère autoimmun de cette maladie.
Le naltrexone, une molécule antagoniste compétitive des opiacés (endo et exogènes), à la posologie de 50 mg/j, est approuvée par la FDA (Food and Drug Admninistration, États-Unis) dans cette indication. Elle a été initialement synthétisée pour le sevrage des toxicomanies aux opiacés. Bien qu'elle soit prescrite hors AMM faute de son approbation par la FDA, elle est utilisée par certains médecins dans la SEP[107]. Un essai clinique pilote multicentrique de phase II sur la sclérose en plaques progressive primaire a été publié[108]. Une étude croisée monocentrique en double aveugle contre placebo a procédé à l’évaluation de l’efficacité d’un traitement de 8 semaines avec 4,5 mg/j de naltrexone pris le soir (LDN, Low Dose Naltrexone therapy) sur la qualité de vie[109].
Le laquinimod[110].
L'alemtuzumab[111],[112] est en cours d'essais avec des résultats prometteurs. Le , le comité des médicaments à usage humain (CHMP) de l'Agence européenne des médicaments (EMA) a rendu un avis positif pour l'anticorps monoclonal alemtuzumab commercialisé sous le nom de Lemtrada dans la sclérose en plaques récurrente-rémittente (SEP-R) de l'adulte[113].
La vitamine D3[31] et N-acétylglucosamine. Ces substances auraient pour effet d'améliorer la glycosylation des protéines, qui est impliquée dans la reconnaissance du soi et du non soi par le système immunitaire. Dans une étude de 2011, Mkhikian et al.[114] observent chez des souris mutantes qui ont une moins bonne glysosylation des protéines, une hyperactivation des cellules T et une perte du récepteur CTLA-4 responsable de l'auto-immunité. De plus, des symptômes de SEP (démyélinisation inflammatoire et neurodégénérescence) apparaissent chez ces mutants. À la suite de l'apport de vitamine D et de N-acétylglucosamine qui modulent cette glycosylation, ils observent une rétrogradation de ces symptômes. D'après ces chercheurs et à la suite de nombreuses analyses de sang, les malades souffrant de la SEP auraient plus fréquemment des facteurs génétiques qui alternent cette glycosylation. Ces résultats sont très prometteurs (aspect curatif ou préventif) et des essais cliniques sur l'homme avec apport de ces deux molécules vont être conduits prochainement.
La simvastatine à fortes doses diminuerait l'atrophie cérébrale des formes évolutives[115].
Dans les formes évolutives, la Biotine est actuellement en cours d'étude avec des résultats positifs dans les analyses intermédiaires.
Vers intestinaux
La présence de vers intestinaux montre une certaine amélioration des paramètres biologiques et d'imagerie : elle permettrait soit de détourner l'action auto-immune des globules blancs contre les parasites plutôt que contre le propre système nerveux du patient, soit de faire bénéficier indirectement l'organisme du patient des substances produites par les parasites pour se faire oublier de son système immunitaire[116].
Oméga-3
Même si des recherches supplémentaires sont nécessaires, il semble que les acides gras oméga-3 jouent un rôle protecteur contre certaines infections et permettent de traiter une multitude d'affections, et notamment la sclérose en plaques. De ce fait, une consommation riche en acides gras oméga-3 peut apporter un certain soulagement dans le cadre de la sclérose en plaques. Ils peuvent permettre un maintien des fonctions cognitives et un arrêt de la dégradation du système immunitaire, pénalisant grandement les personnes souffrant de cette affection[117]. Plusieurs recherches ont été menées sur le lien entre oméga-3 et maladies neurodégénératives[118],
Épidémiologie, prévalence

- 0-0
- 1-1
- 2-2
- 3-5
- 6-12
- 13-25
La prévalence de la maladie augmente avec la latitude (la maladie est rare à l'équateur pour atteindre 0,1 % de la population en Europe circumpolaire, en Finlande[122]) selon Hafleur en 2004 [123]
En France elle touche plus de 90 000 personnes [124] (prévalence), et environ 5 000 personnes de plus par an[61] (incidence). Soixante-dix pour cent des nouveaux patients sont de jeunes adultes entre 20 et 40 ans, dont près de deux tiers de femmes. Il s'agit de la première cause non traumatique de handicap sévère acquis du sujet jeune[61].
La survenue des crises semble être plus rare chez les femmes enceintes et plus fréquente au cours des trois premiers mois après l'accouchement[125]. De même, elle semble favorisée par certaines infections virales[126],[127]. Elle semble rare en Afrique noire ce qui pourrait être lié à un mauvais repérage des cas ou à des facteurs géoclimatiques (exposition aux UV et de production de mélatonine), mais les données épidémiologiques montrent qu'elle est également rare dans les populations noires des USA, de Grande-Bretagne, des Caraïbes et d'Afrique du Sud, plaidant pour de moindres prédispositions génétiques dans les populations à peau noire. Les études de migration de populations entre zones de prévalence inégale montrent aussi l' « existence d'un facteur de risque âge dépendant orientant vers l'existence d'un facteur environnemental » (éventuellement protecteur)[128],[129].
Conséquences sociales
Les personnes atteintes par cette maladie ne peuvent pas faire de dons de sang, de plasma ou d'organes. Le vaccin de la fièvre jaune est fortement déconseillé. Un certificat d'aptitude à la conduite ou un permis à validité réduite seront nécessaires dans certains pays afin de rester protégé par son assurance.
Histoire et société
Historique
La sclérose en plaques a été diagnostiquée pour la première fois en 1868 par le docteur Jean-Martin Charcot[130],[131], et la lésion anatomique de la moelle a été décrite dès 1838 par Robert Carswell[132]. En 1885, Joseph Babinski lui consacre un traité.
Personnalités
- Catherine Langeais (1923-1998)[133].
- Marie Dubois (1937-2014)[134].
- Richard Pryor (1940-2005)[135].
- Captain Beefheart (1941-2010)[136].
- Teri Garr (1944-)[137].
- Jacqueline du Pré (1945-1987)[138].
- Arlette Cousture (1948-)[139].
- Michael Kamen (1948-2003)[140].
- Ann Romney (1949-)[141].
- Clive Burr (1957-2013)[142].
- Carol Cooke (1961-)[143].
- Dominique Farrugia (1962-)[144].
- Elizabeth Rodrigues Gomes (1965-)[145].
- Mattt Konture (1965-)[146].
- Aaron Solowoniuk (1974-)[147].
- Janine Watson (1981-)[148].
- Jack Osbourne (1985-)[149].
Notes et références
- (en) Compston A, Coles A. « Multiple sclerosis » Lancet 2008;372:1502-1517
- (en) Ascherio A, Munger KL, « Environmental risk factors for multiple sclerosis. Part II: Noninfectious factors », Ann Neurol, vol. 61, no 6, , p. 504-13. (PMID 17492755, DOI 10.1002/ana.21141)
- Depression and Psychosis in Neurological Practice, , 892 p. (ISBN 978-1-4377-0434-1 et 1-4377-0434-4)
- F. D. Lublin et S. C. Reingold, « Defining the clinical course of multiple sclerosis: results of an international survey. National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis », Neurology, vol. 46, , p. 907-911 (ISSN 0028-3878, PMID 8780061, lire en ligne, consulté le )
- Jin Nakahara, Michiko Maeda, Sadakazu Aiso et Norihiro Suzuki, « Current concepts in multiple sclerosis: autoimmunity versus oligodendrogliopathy », Clinical Reviews in Allergy & Immunology, vol. 42, , p. 26-34 (ISSN 1559-0267, PMID 22189514, DOI 10.1007/s12016-011-8287-6, lire en ligne, consulté le )
- Kerstin Berer et Gurumoorthy Krishnamoorthy, « Microbial view of central nervous system autoimmunity », FEBS letters, vol. 588, , p. 4207-4213 (ISSN 1873-3468, PMID 24746689, DOI 10.1016/j.febslet.2014.04.007, lire en ligne, consulté le )
- Atlas : Multiple Sclerosis Resources in the World 2008, , 51 p. (ISBN 978-92-4-156375-8 et 92-4-156375-3)
- « Espérance de vie dans la Sclérose en Plaques | Ligue française contre la sclérose en plaques », sur www.ligue-sclerose.fr (consulté le )
- « Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990-2013: a systematic analysis for the Global Burden of Disease Study 2013 », Lancet (London, England), vol. 385, , p. 117-171 (ISSN 1474-547X, PMID 25530442, PMCID 4340604, DOI 10.1016/S0140-6736(14)61682-2, lire en ligne, consulté le )
- Ron Milo et Esther Kahana, « Multiple sclerosis: geoepidemiology, genetics and the environment », Autoimmunity Reviews, vol. 9, , A387-394 (ISSN 1873-0183, PMID 19932200, DOI 10.1016/j.autrev.2009.11.010, lire en ligne, consulté le )
- M. Clanet, « Jean-Martin Charcot. 1825 to 1893 », International MS journal / MS Forum, vol. 15, , p. 59-61 (ISSN 1352-8963, PMID 18782501, lire en ligne, consulté le )
- « La sclérose en plaques : Maladie, espoirs et réalités ».
- (en) Anne-Marie Landtblom, « The first case history of multiple sclerosis : Augustus d’Esté (1794–1848) », Neurological Sciences, (lire en ligne).
- P. Kerschen, « La sclérose en plaques : aperçu historique », La Lettre du Neurologue, (lire en ligne).
- (en) Grossmann S, Maeder I et Dollfus P, « Treatise on the Spinal Marrow and its Diseases' (Anatomy, functions and general considerations on its diseases) by Ollivier d'Angers CP (1796-1845) », Spinal Cord, vol. 44, , p. 700-707 (lire en ligne)
- (en) Lisa I. Iezzoni, Multiple Sclerosis (lire en ligne)
- (en) Dr. T. Jock Murray, MS, Multiple Sclerosis : The History of a Disease (lire en ligne)
- « Historique de la maladie », sur arsep.
- Patrick Hautecœur, « L’histoire de la sclérose en plaques », Brochure ARSEP, (lire en ligne).
- [PDF] Conférence de consensus - La sclérose en plaques (juin 2001) par l'agence nationale d'accréditation et d'évaluation en santé (ANAES) et la fédération française de neurologie, page 6
- F. Blanc, F. Berna, M. Fleury, L. Lita, E. Ruppert, D. Ferriby, P. Vermersch, P. Vidailhet, J. de Seze, « Évènements psychotiques inauguraux de sclérose en plaques ? », Revue Neurologique, vol. 166, no 1, , p. 39-48 (ISSN 0035-3787, DOI 10.1016/j.neurol.2009.04.014, lire en ligne, consulté le )
- (de) Oestmann A, Achtnichts L, Kappos L, Gass A, Naegelin Y., « “Numb chin Syndrom” als Erstsymptom einer Multiplen Sklerose? [“Numb chin syndrome”: first presenting syndrome of multiple sclerosis?] », Dtsch Med Wochenschr., vol. 133, no 3, , p. 76-8. (PMID 18186008, DOI 10.1055/s-2008-1017477)
- Mylène Bapst, Évaluation et prise en charge d’un cas de sclérose en plaques (Maîtrises universitaires d'études avancées en neuropsychologie clinique), University of Geneva, (lire en ligne)
- Weber H, Pfadenhauer K, Stöhr M, Rösler A. Central hyperacusis with phonophobia in multiple sclerosis. Mult Scler. 2002 Dec;8(6):505-9. PubMed .
- Revue Prescrire, 287, septembre 2007
- (en) McDonald WI, Compston A, Edan G et al. « Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis » Ann Neurol. 2001;50:121-127
- (en) Polman CH, Reingold SC, Edan G et al. « Diagnostic criteria for multiple sclerosis: 2005 revisions to the “McDonald Criteria” » Ann Neurol. 2005;58:840-846
- (en-US) « Types of MS | Multiple Sclerosis », MS International Federation, (lire en ligne, consulté le )
- M. Trojano, D. Paolicelli, A. Bellacosa et S. Cataldo, « The transition from relapsing-remitting MS to irreversible disability: clinical evaluation », Neurological Sciences: Official Journal of the Italian Neurological Society and of the Italian Society of Clinical Neurophysiology, vol. 24 Suppl 5, , S268–270 (ISSN 1590-1874, PMID 14652786, DOI 10.1007/s10072-003-0171-6, lire en ligne, consulté le )
- (en) Fontaine B. « Borderline forms of multiple sclerosis » Rev. Neurol. (Paris) (Paris) 2001
- « Quels liens entre sclérose en plaques et vitamine D ? » - Allôdocteurs.fr
- Luz Tavera-Mendoza et John White, « La vitamine du soleil », Pour la Science, no 365, (résumé)« http://myrmek.free.fr/pfefr/Pls_D.pdf »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- Jussi Oskari Virtanen et Steve Jacobson, « Viruses and Multiple Sclerosis », CNS & neurological disorders drug targets, vol. 11, no 5, , p. 528–544 (ISSN 1871-5273, PMID 22583435, PMCID PMC4758194, lire en ligne, consulté le )
- Hauser S & Oksenbe J (2006) The Neurobiology of Multiple Sclerosis: Genes, Inflammation, and Neurodegeneration ; Neuron 52(1):61-76; Nov. 2006 DOI: 10.1016/j.neuron.2006.09.011
- (en) Levin LI, Munger KL, Rubertone MV et al. « Multiple sclerosis and Epstein-Barr virus » JAMA 2003;289:1533-1536
- Butler E.J (1952). Chronic neurological disease as a possible form of lead poisoning. Journal of Neurology, Neurosurgery & Psychiatry, 15(2), 119-128.
- Sandyk R & Awerbuch G.I (1992) Nocturnal plasma melatonin and alpha-melanocyte stimulating hormone levels during exacerbation of multiple sclerosis. International Journal of Neuroscience, 67(1-4), 173-186 (résumé).
- O'callaghan F. J. K, Clarke A.A, Hancock E, Hunt A & Osborne J.P (1999). Use of melatonin to treat sleep disorders in tuberous sclerosis. Developmental Medicine & Child Neurology, 41(2), 123-126.
- Akpınar, Z., Tokgöz, S., Gökbel, H., Okudan, N., Uğuz, F., & Yılmaz, G. (2008). The association of nocturnal serum melatonin levels with major depression in patients with acute multiple sclerosis. Psychiatry research, 161(2), 253-257.
- Sandyk R & Awerbuch G.I (1993) Nocturnal melatonin secretion in multiple sclerosis patients with affective disorders. International Journal of Neuroscience, 68(3-4), 227-240. (résumé)
- Natarajan, R., Einarsdottir, E., Riutta, A., Hagman, S., Raunio, M., Mononen, N., ... & Elovaara, I. (2012). Melatonin pathway genes are associated with progressive subtypes and disability status in multiple sclerosis among Finnish patients. Journal of neuroimmunology, 250(1), 106-110 (résumé)
- Leslie M (2018) An elusive molecule that sparks multiple sclerosis may have been found | Oct. 10, 2018 | Posted in: BiologyHealth doi:10.1126/science.aav6914
- Planas, R., Santos, R., Tomas-Ojer, P., Cruciani, C., Lutterotti, A., Faigle, W., ... & Martin, R. (2018). GDP-l-fucose synthase is a CD4+ T cell–specific autoantigen in DRB3* 02: 02 patients with multiple sclerosis. Science translational medicine, 10(462), eaat4301 ([ethttp://stm.sciencemag.org/content/10/462/eaat4301.abstract résumé]).
- Claire Manière, « Sclérose en plaques : le virus d’Epstein-Barr en serait la cause principale », sur Trust my science, (consulté le ).
- « Des chercheurs identifient le virus à l'origine de la sclérose en plaques », sur Franceinfo, (consulté le )
- (en) William H. Robinson et Lawrence Steinman, « Epstein-Barr virus and multiple sclerosis », Science, (DOI 10.1126/science.abm7930, lire en ligne
 , consulté le ).
, consulté le ). - (en) Terasaki PI, Park MS, Opelz G, Ting A. « Multiple sclerosis and high incidence of a B lymphocyte antigen » Science 1976;193:1245-1247
- (en) The International Multiple Sclerosis Genetics Consortium, « Risk alleles for multiple sclerosis identified by a genomewide study » N Eng J Med. 2007;357:851-862
- (en) Hedström AK, Lima Bomfim I, Barcellos L, Gianfrancesco M, Schaefer C, Kockum I, Olsson T, Alfredsson L, « Interaction between adolescent obesity and HLA risk genes in the etiology of multiple sclerosis », Neurology, vol. 82, no 10, , p. 865-72. (PMID 24500647, PMCID PMC3959752, DOI 10.1212/WNL.0000000000000203, lire en ligne [html])
- (en) Lauer K, « Notes on the epidemiology of multiple sclerosis, with special reference to dietary habits », Int J Mol Sci, vol. 15, no 3, , p. 3533-45. (PMID 24577315, PMCID PMC3975352, DOI 10.3390/ijms15033533, lire en ligne [html])
- Dominique Malosse et JM Seigneurin (dir.), Corrélation entre la consommation de lait et produits laitiers et la prévalence de la sclérose en plaques. La SEP anthropozoonose multifactorielle ? [Correlation between milk and dairy product consumption and multiple sclerosis prevalence. MS, multifactorial anthropozoonose?] (Thèse nouveau doctorat (médecine)), Université de Grenoble 1, Saint-Martin-d'Hères, France, , 303 p. (OCLC 490314817, présentation en ligne)
- (en) Malosse D, Perron H, Sasco A, Seigneurin JM, « Correlation between milk and dairy product consumption and multiple sclerosis prevalence: a worldwide study », Neuroepidemiology, vol. 11, nos 4-6, , p. 304-12. (PMID 1291895)
- Prescrire, rédaction. « Vaccination et sclérose en plaques : pas de risque démontré » Prescrire septembre 2004 tome 24 no 253 pages 594-595
- (en) Zamboni P, Galeotti R, Menegatti E, Malagoni AM, Gianesini S, Bartolomei I, Mascoli F, Salvi F. « A prospective open-label study of endovascular treatment of chronic cerebrospinal venous insufficiency » J Vasc Surg. 2009 Dec;50(6):1348-58.e1-3. Erratum in: J Vasc Surg. 2010 Apr;51(4):1079.
- (en) First Blinded Study of Venous Insufficiency Prevalence in MS Shows Promising Results. News release. 10 février 2010. University at Buffalo.
- « Sclérose en plaques : bémol aux travaux du Dr Zamboni », sur cyberpresse.ca
- (en) Awad AM, Marder E, Milo R, Stüve O. « Multiple sclerosis and chronic cerebrospinal venous insufficiency: a critical review » Ther Adv Neurol Disord. 2011;4:231-5
- « Sclérose en plaques : une étude québécoise contredit l'hypothèse du Dr Zamboni », sur radio-canada.ca,
- (en) Kuehn BM. « FDA warns about the risks of unproven surgical therapy for multiple sclerosis » JAMA 2012;307:2575-2576
- Thibault Moreau, « Grossesse et sclérose en plaques », sur arsep.org, (consulté le )
- [PDF] http://www.has-sante.fr/portail/upload/docs/application/pdf/sclerose3.pdf
- (en-US) « Sclérose en plaques et espérance de vie - Santé sur le net », Santé sur le net, (lire en ligne, consulté le )
- (en) Hanne-Marie Bøe Lunde, Jørg Assmus, Myhr Kjell-Morten et Lars Bø, « Survival and cause of death in multiple sclerosis: a 60-year longitudinal population study », J Neurol Neurosurg Psychiatry, , jnnp–2016–315238 (ISSN 0022-3050 et 1468-330X, PMID 28365589, DOI 10.1136/jnnp-2016-315238, lire en ligne, consulté le )
- Montalban X, Gold R, Thompson AJ et al. ECTRIMS/EAN Guideline on the pharmacological treatment of people with multiple sclerosis, Multiple Sclerosis Journal, 2018;
- (en) Miller DM, Weinstock-Guttman B, Bethoux F et al. « A meta-analysis of methylprednisolone in recovery from multiple sclerosis exacerbations » Mult Scler. 2000;6:267-273
- (en) Weinshenker BG, O'Brien PC, Petterson TM et al. « A randomized trial of plasma exchange in acute central nervous system inflammatory demyelinating disease » Ann Neurol. 1999;46:878-886
- Trebst C, Reising A, Kielstein JT, Hafer C, Stangel M, Plasma exchange therapy in steroid-unresponsive relapses in patients with multiple sclerosis, Blood Purif, 2009;28:108–115
- Ehler J, Koball S, Sauer M et al. Response to therapeutic plasma exchange as a rescue treatment in clinically isolated syndromes and acute worsening of multiple sclerosis: a retrospective analysis of 90 patients, PLoS One, 2015;10:e0134583
- (en) Ebers Gcprisms (Prevention of Relapses and Disability by Interferon beta-1a Subcutaneously in Multiple Sclerosis) Study Group. « Randomised double-blind placebo-controlled study of interferon beta-1a in relapsing/remitting multiple sclerosis » Lancet 1998;352:1498-1504
- (en) Kappos L, Freedman MS, Polman CH. et al. for the Benefit Study Group. « Effect of early versus delayed interferon beta-1b treatment on disability after a first clinical event suggestive of multiple sclerosis: a 3-year follow-up analysis of the Benefit study » Lancet 2007;370:389-397
- (en) Filippini G, Munari L, Incorvaia B. et al. « Interferons in relapsing remitting multiple sclerosis: a systematic review » Lancet 2003;361:545-552
- (en) Mikol DD, Barkhof F, Chang P. et al. « Comparison of subcutaneous interferon beta-1a with glatiramer acetate in patients with relapsing multiple sclerosis (the REbif vs Glatiramer Acetate in Relapsing MS Disease [REGARD] study): a multicentre, randomised, parallel, open-label trial » Lancet Neurol. 2008;7:903-914
- (en) Schmied M, Duda PW, Krieger JI, Trollmo C, Hafler DA. « In vitro evidence that subcutaneous administration of glatiramer acetate induces hyporesponsive T cells in patients with multiple sclerosis » Clin Immunol. 2003;106:163-174
- (en) Rudick RA, Stuart WH, Calabresi PA. et al. « Natalizumab plus interferon Beta-1a for relapsing multiple sclerosis » New Eng J Med. 2006:354:911-923
- (en) Polman CH, O'Connor PW, Havrdova E. « A Randomized, placebo-controlled trial of Natalizumab for relapsing multiple sclerosis » New Eng J Med. 2006:354:899-910
- (en) Edan G, Miller D, Clanet M. et al. « Therapeutic effect of mitoxantrone combined with methylprednisolone in multiple sclerosis: a randomised multicentre study of active disease using MRI and clinical criteria » J Neurol Neurosurg Psychiatry 1997;62:112-118
- « Haute Autorité de Santé - AUBAGIO (tériflunomide), immunomodulateur », sur www.has-sante.fr (consulté le )
- « VIDAL - Diméthyle fumarate », sur www.vidal.fr (consulté le )
- « VIDAL - AUBAGIO 14 mg cp pellic - Synthèse », sur www.vidal.fr (consulté le )
- Sharrack B, Saccardi R, Alexander T et al. Autologous haematopoietic stem cell transplantation and other cellular therapy in multiple sclerosis and immune-mediated neurological diseases: updated guidelines and recommendations from the EBMT Autoimmune Diseases Working Party (ADWP) and the Joint Accreditation Committee of EBMT and ISCT (JACIE), Bone Marrow Transplant, 2020;55:283-306
- Sormani MP, Muraro PA, Schiavetti I et al. Autologous hematopoietic stem cell transplantation in multiple sclerosis: A meta-analysis, Neurology, 2017;88:2115-22
- Masaaki Niino, Toshiyuki Fukazawa, Seiji Kikuchi et Hidenao Sasaki, « Therapeutic potential of vitamin D for multiple sclerosis », Current Medicinal Chemistry, vol. 15, no 5, , p. 499–505 (ISSN 0929-8673, PMID 18289005, lire en ligne, consulté le )
- Sandyk, R. (1992). Successful treatment of multiple sclerosis with magnetic fields. The International journal of neuroscience, 66(3-4), 237-250 (résumé)
- (en) Elyn Selu, « Authentic Movement as a Movement Meditation Practice: Support for Immune Mediated Inflammatory Disease », International Body Psychotherapy Journal, vol. 19, no 1, printemps-été 2020, p. 55-63 (ISSN 2169-4745, e-ISSN 2168-1279, lire en ligne).
- « Fondation ARSEP », sur www.arsep.org (consulté le )
- http://www.ligue-sclerose.fr
- « La sclérose en plaques - AFSEP - Association Française des Sclérosés en Plaques », sur Association Française des Sclérosés en Plaques (consulté le ).
- « APF France handicap », sur APF France handicap (consulté le ).
- « Le parrainage », sur Association SEP'Avenir (consulté le )
- « http://www.besep.org »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ) Besep "Be your Sporting hEalth Partner - le programme de soutien sportif pour les personnes atteintes de SEP et de pathologies chroniques altérant la mobilité
- « Société canadienne de la sclérose en plaques »
- (en) K.S. Malcomson, « Psychosocial interventions in people with multiple sclerosis », Journal of Neurology, vol. 254, no 1, , p. 1-13 (ISSN 0340-5354, DOI 10.1007/s00415-006-0349-y, lire en ligne, consulté le )
- Elsevier Masson, « Sclérose en plaques et kinésithérapie », sur EM-Consulte (consulté le )
- Gunn H, Markevics S, Haas B, Marsden J, Freeman J, Systematic review: the effectiveness of interventions to reduce falls and improve balance in adults with multiple sclerosis, Arch Phys Med Rehabil, 2015;96:1898–1912
- Dalgas U, Stenager E, Jakobsen J et al. Resistance training improves muscle strength and functional capacity in multiple sclerosis, Neurology, 2009;73:1478–1484
- Motl RW, Sandroff BM, Kwakkel G et al. Exercise in patients with multiple sclerosis, Lancet Neurol, 2017;16:848–856
- Briken S, Gold SM, Patra S et al. Effects of exercise on fitness and cognition in progressive MS: a randomized, controlled pilot trial, Mult Scler, 2014;20: 382–390
- « VIDAL - Baclofène », sur www.vidal.fr (consulté le )
- « VIDAL - Dantrolène », sur www.vidal.fr (consulté le )
- Bertrand D., « La cryothérapie corps entier : une nouvelle approche thérapeutique. », Kinésithérapie, la Revue, , p. 45-55 (ISSN 1779-0123)
- Goodman, A. D., Brown, T. R., Krupp, L. B., Schapiro, R. T., Schwid, S. R., Cohen, R., ... & Fampridine MS-F203 Investigators. (2009). Sustained-release oral fampridine in multiple sclerosis : a randomised, double-blind, controlled trial. The Lancet, 373(9665), 732-738.
- Goodman, A. D., Brown, T. R., Cohen, J. A., Krupp, L. B., Schapiro, R., Schwid, S. R., ... & Fampridine MS-F202 Study Group. (2008). Dose comparison trial of sustained-release fampridine in multiple sclerosis. Neurology, 71(15), 1134-1141 (résumé).
- Midafi N (2005) Évaluation de la qualité de vie des patients atteints de sclérose en plaques : Echelle SEP 59.
- Bouée J.B (2014) Évaluation des pratiques rééducatives et sportives chez les patients atteints d'une sclérose en plaques (EPRéSSEP). (résumé)
- El Asraoui N. (2013) La sclérose en plaques concepts fondamentaux et traitements (Doctoral dissertation). (résumé)
- (en) Hauser SL, Waubant E, Arnold DL. et al. « B-Cell Depletion with Rituximab in Relapsing–Remitting Multiple Sclerosis » New Eng J Med. 2008;358:676-88.
- http://www.lowdosenaltrexone.org Communiqué de presse sur le Naltrexone
- (en) Gironi M, Martinelli-Boneschi F, Sacerdote P, Solaro C, Martino G. et al., « A pilot trial of low-dose naltrexone in primary progressive multiple sclerosis », Mult Scler., vol. 14, no 8, , p. 1076-83. (PMID 18728058, DOI 10.1177/1352458508095828), résumé traduit en français.
- (en) Cree BA, Kornyeyeva E, Goodin DS., « Pilot trial of low-dose naltrexone and quality of life in multiple sclerosis », Ann Neurol., vol. 68, no 2, , p. 145-50. (PMID 20695007, DOI 10.1002/ana.22006), résumé « Copie archivée » (version du 4 octobre 2013 sur l'Internet Archive) traduit en français.
- (en) Comi G, Pulizzi A, Rovaris M. et al. for the LAQ/5062 Study Group. « Effect of laquinimod on MRI-monitored disease activity in patients with relapsing-remitting multiple sclerosis: a multicentre, randomised, double-blind, placebo-controlled phase IIb study » Lancet 2008;371:2085-2092
- (en) The CAMMS223 Trial Investigators. « Alemtuzumab vs. Interferon Beta-1a in early multiple sclerosis » New Eng J Med. 2008;359:1786-1801
- (en) O'Connor P, Wolinsky JS, Confavreux C et al. for the Temso Trial Group. « Randomized trial of oral teriflunomide for relapsing multiple sclerosis » N Engl J Med. 2011;365:1293-1303
- « Genzyme Receives Positive CHMP Opinion for LEMTRADA™ (alemtuzumab) in Europe | Genzyme/Sanofi News », sur news.genzyme.com, Genzyme Corporation Online, (consulté le )
- (en)«Genetics and the environment converge to dysregulate N-glycosylation in multiple sclerosis » Nature Comm. 2011;2:334.
- Chataway J, Schuerer N, Alsanousi A, Effect of high-dose simvastatin on brain atrophy and disability in secondary progressive multiple sclerosis (MS-STAT): a randomised, placebo-controlled, phase 2 trial, Lancet, 2014;383:2213-2221
- (en) Jorge Correale, Mauricio Farez « Association between parasite infection and immune responses in multiple sclerosis » Annals of Neurology 2007;61(2):97-108. Consulté le 8 février 2008
- L. Shinto, G. Marracci, S. Baldauf-Wagner et A. Strehlow, « Omega-3 fatty acid supplementation decreases matrix metalloproteinase-9 production in relapsing-remitting multiple sclerosis », Prostaglandins, Leukotrienes, and Essential Fatty Acids, vol. 80, nos 2-3, , p. 131–136 (ISSN 0952-3278, PMID 19171471, PMCID PMC2692605, DOI 10.1016/j.plefa.2008.12.001, lire en ligne, consulté le )
- J.-M. Alessandri, P. Guesnet, S.Vancassel, I. Denis, B. Langelier, M. Lavialle, « Fonctions biologiques des acides gras polyinsaturés dans les membranes nerveuses : une évolution des concepts » Cahiers de Nutrition et de Diététique 2004;39(4):270–279.
- Samar S. Ayache, Moussa A. Chalah, Ulrich Palm et Alain Créange, « L’effet de la stimulation transcrânienne à Courant Continu (tDCS) sur la douleur, l’attention, et l’humeur dans la sclérose en plaques », Neurophysiologie Clinique/Clinical Neurophysiology, vol. 46, no 3, , p. 221 (DOI 10.1016/j.neucli.2016.06.010, lire en ligne, consulté le )
- Benjamin Bardel, Moussa A. Chalah, Alain Créange et Jean-Pascal Lefaucheur, « La fatigue dans la sclérose en plaques : la place de la Stimulation transcrânienne à courant continu (tDCS) », Revue Neurologique, journées de Neurologie de langue française 2017, vol. 173, no Supplement 2, , S129–S130 (DOI 10.1016/j.neurol.2017.01.229, lire en ligne, consulté le )
- Samar S. Ayache, Ulrich Palm, Jean-Pascal Lefaucheur et Moussa A. Chalah, « Les effets de la stimulation transcrânienne par bruit aléatoire (tRNS) dans la sclérose en plaques », Neurophysiologie Clinique/Clinical Neurophysiology, vol. 47, no 3, , p. 195 (DOI 10.1016/j.neucli.2017.05.026, lire en ligne, consulté le )
- Marja-Liisa Sumelahti & al. (2001) Increasing prevalence of multiple sclerosis in Finland ; Acta Neurologica Scandinavica 103(3):153-8 ; Avril 2001 ; DOI: 10.1034/j.1600-0404.2001.103003153.x (résumé)
- Hafleur DA (2004) Multiple Sclerosis ; Journal of Clinical Investigation 113(6):788-94 ; April 2004 DOI: 10.1172/JCI21357
- http://www.ofsep.org/fr/
- (en) Vukusic S, Hutchinson M, Hours M. et al. « The Pregnancy In Multiple Sclerosis Group. Pregnancy and multiple sclerosis (the PRIMS study): clinical predictors of post-partum relapse » Brain 2004;127:1353-1360
- (en) Buljevac D, Flach HZ, Hop WC. et al. « Prospective study on the relationship between infections and multiple sclerosis exacerbations » Brain 2002;125:952-960
- (en) Andersen O, Lygner PE, Bergstrom T, Andersson M, Vahlne A, « Viral infections trigger multiple sclerosis relapses: a prospective seroepidemiological study » J Neurol. 1993;240:417-422
- Eric G, Ak A & Akouavi L (2001) La Sclérose en Plaques en Afrique Noire ; Pan African Association of Neurological Sciences ; publié le 1er janvier 2001.
- Grunitzky E.G, Balogou A A & Kowou A.L (2001), La Sclerose en Plaques en Afrique Noire. African Journal of Neurological Sciences, Af J Neuro Sci: 2001 20(1).
- Charcot, J. (1868). Comptes rendus des séances et mémoires lus à la société de Biologie
- Charcot, J. (1868). Histologie de la sclérose en plaques. Gazette des Hôpitaux. 41:554–566
- (en) Carswell R. Pathological anatomy: illustrations of the elementary forms of disease, London: Longman, Orme, Brown, Green and Longman, 1838
- « Catherine Langeais s'est éteinte », sur L'Humanité, (consulté le )
- « Marie Dubois, la combattante aux yeux clairs », La Croix, (ISSN 0242-6056, lire en ligne, consulté le )
- (en) « Richard Pryor », Richard Pryor (consulté le )
- (en-US) Maura Johnston, « Remembering Experimental Rocker Captain Beefheart », sur Rolling Stone, (consulté le )
- « CNN.com - Teri Garr reveals she has multiple sclerosis - Oct. 7, 2002 », sur web.archive.org, (consulté le )
- Luis Octavio Tierradentro-García, Juan Sebastián Botero-Meneses et Claudia Talero-Gutiérrez, « The Sound of Jacqueline du Pré: Revisiting her Medical and Musical History », Multiple Sclerosis Journal - Experimental, Translational and Clinical, vol. 4, no 2, , p. 2055217318775756 (ISSN 2055-2173, PMID 29780612, PMCID 5952293, DOI 10.1177/2055217318775756, lire en ligne, consulté le )
- « Entretien inédit – Arlette Cousture – Ordre national du Québec », sur www.ordre-national.gouv.qc.ca (consulté le )
- (en-US) The Associated Press, « Michael Kamen, 55, Award-Winning Composer », The New York Times, (ISSN 0362-4331, lire en ligne, consulté le )
- (en) « Salt Lake leader's wife rejuvenated », USA Today,
- Daily, « Original Iron Maiden drummer Clive Burr dies aged 56 after lifelong battle with MS », sur Mail Online, (consulté le )
- « Triple quest for Northcote paralympian | Melbourne Times Weekly », sur archive.md, (consulté le )
- « Dominique Farrugia : «C’est quand je n’y pense plus que la maladie se rappelle à moi» », sur leparisien.fr, (consulté le )
- (en) « Para Athletics (formerly IPC Athletics) News & Events », sur International Paralympic Committee (consulté le )
- (en-US) « Sclérose en plaques », sur L’Association (consulté le )
- « Billy Talent News », sur web.archive.org, (consulté le )
- (en) W. H. Staff, « Meet The Taekwando Champion Giving MS The Middle Finger », sur Women's Health, (consulté le )
- « Jack Osbourne a une sclérose en plaques », La Dépêche.fr, (lire en ligne)
- « La sclérose en plaques », sur Ministère des Solidarités et de la Santé, (consulté le )
Voir aussi
Bibliographie
Études générales sur la maladie
- Couturier, N. (2009). Génétique et épigénétique de la sclérose en plaques : susceptibilité et réponse au traitement Thèse de Doctorat ; Université Toulouse III-Paul Sabatier.
Études réalisées montrant des progrès des soins contre la sclérose en plaques :
- (en) Ruth McCullag, Anthony P. Fitzgerald, Raymond P. Murphy, Grace Cooke « Long terms benefits on exersizing on quality of live and fatigue in multiple sclerosis patients with mild disability : a pilot study » Clin Rehabil. 2008; 22 ; 206
- (en) MA Newman, H Dawes, M van den Berg, BT Wade, J Burridge and H Izady « Can aerobic training treadmill reduce the effort of walking and fatigue in people with multiple sclerosis : a pilot study » Mult Scler. 2007;13;113
- (en) U Dalgas, E Stenager, T Ingemann-Hansen « Multiple sclerosis and physical exercise : recommandation for the application of resistance, endurance, and combined training » Mult Scler. OnlineFirst Sept 19, 2007
- (en) Dodd KJ, Taylor NF, Denisenko S, Prasad D. « A qualitative analysis of a progressive resistance exercise programme for people with multiple sclerosis » Disabil Rehabil. 2006, 28:1127-34.
- (en) Taylor NF, Dodd KJ, Prasad D, Denisenko S. « Progressive resistance exercise for people with multiple sclerosis » Disabil Rehabil. 2006, 28:1119-26.
- (en) Van den Berg M, Dawes H, Wade DT, Newman M, Burridge J, Izadi H, Sackley CM. « Treadmill training for individuals with multiple sclerosis: a pilot randomised trial » J Neurol Neurosurg Psychiatry 2006, 77:531-3.
- (en) Heesen C, Romberg A, Gold S, Schulz KH. « Physical exercise in multiple sclerosis: supportive care or a putativedisease-modifying treatment » Expert Rev Neurother. 2006, 6:347-55.
- (en) Romberg A, Virtanen A, Ruutiainen J. « Long-term exercise improves functional impairment but not quality of life in multiple sclerosis » J Neurol. 2005, 252:839-45.
- (en) Kileff J, Ashburn A. « A pilot study of the effect of aerobic » Clin Rehabil. 2005;19:165-9.
- (en) Rietberg MB, Brooks D, Uitdehaag BM, Kwakkel G. « Exercise therapy for multiple sclerosis » Cochrane Database Syst Rev. 2005;(1):CD003980.
- (en) Romberg A, Virtanen A, Ruutiainen J, Aunola S, Karppi SL, Vaara M, Surakka J, Pohjolainen T, Seppanen A. « Effects of a 6-month exercise » Neurology 2004;63:2034-8.
- (en) Surakka J, Romberg A, Ruutiainen J, Aunola S, Virtanen A, Karppi SL, Maentaka K. « Effects of aerobic and strength exercise on motor fatigue in men and women with multiple sclerosis: a randomized controlled trial » Clin Rehabil. 2004;18:737-46.
- (en) Dalgas U, Stenager E, Jakobsen J. et al. « Resistance training improves muscle strength and functional capacity in multiple sclerosis » Neurology 2009;73:1478-84.
Articles connexes
Liens externes
- Ressources relatives à la santé :
- GeneReviews
- (en) Classification internationale des soins primaires
- (en) Diseases Ontology
- (en) DiseasesDB
- (en + es) Genetic and Rare Diseases Information Center
- (en) Héritage mendélien chez l'humain
- (en) Héritage mendélien chez l'humain
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) NCI Thesaurus
- (no + nn + nb) Store medisinske leksikon
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Association SEP'Avenir - Des patients pour des patients
- Société canadienne de la sclérose en plaques
- Groupe septentrional d'études et de recherche sur la sclérose en plaques
- Association française des sclérosés en plaques
- Ligue Française contre la Sclérose en plaques
- Association pour la recherche sur la sclérose en plaques
- Association Notre Sclérose
- Union pour la lutte contre la sclérose en plaques
- Association tunisienne des malades de la sclérose en plaques
- Ligue Belge de la Sclérose en plaques
- Institut du cerveau : recherche sur la sclérose en plaques
- Portail de la médecine
- Portail des neurosciences
- Portail du handicap