Chlorure d'hydrogène
Le chlorure d’hydrogène, de symbole chimique HCl, est un corps composé de chlore et d'hydrogène, incolore, toxique et hautement corrosif. Dans les conditions ambiantes de température et de pression, c'est un gaz qui forme des fumées blanches au contact de l'humidité. Ces fumées sont constituées d'acide chlorhydrique, solution ionique de chlorure d'hydrogène dans l'eau.
« HCl » redirige ici. Pour les autres significations, voir HCL.
Cet article concerne le corps pur. Pour le chlorure d'hydrogène en solution, voir Acide chlorhydrique.
| Chlorure d'hydrogène | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | acide chlorhydrique chlorure d'hydrogène |
|
| No CAS | ||
| No ECHA | 100.028.723 | |
| No CE | 231-595-7 | |
| Apparence | gaz, incolore, d'odeur acre[1]. | |
| Propriétés chimiques | ||
| Formule | HCl [Isomères] |
|
| Masse molaire[2] | 36,461 ± 0,002 g/mol H 2,76 %, Cl 97,23 %, |
|
| pKa | -4 | |
| Moment dipolaire | 1,108 6 ± 0,000 3 D | |
| Propriétés physiques | ||
| T° fusion | −114 °C[1] | |
| T° ébullition | à 101,3 kPa : −85 °C[1] | |
| Solubilité | dans l'eau à 20 °C : 720 g·l-1[1] | |
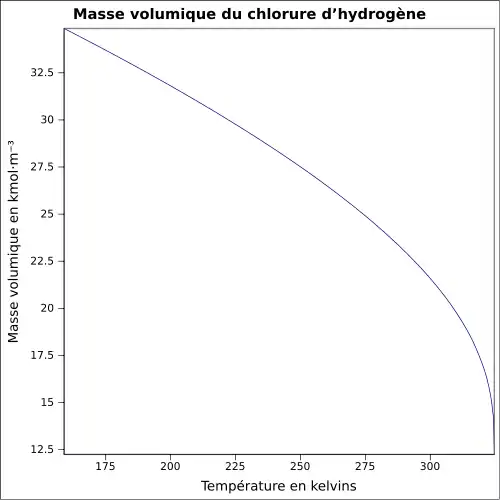
| Masse volumique | 1,000 45 g·l-1 (gaz)[1]
|
|
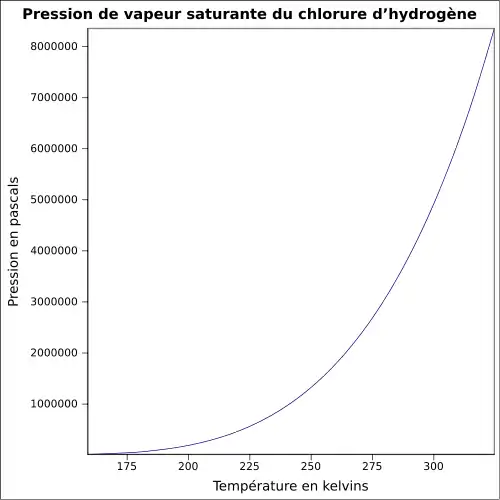
| Pression de vapeur saturante | ||
| Point critique | 51,35 °C, 8,26 MPa [5] | |
| Point triple | 160 K (−114 °C), 13,8 kPa | |
| Vitesse du son | 296 m·s-1 (0 °C,1 atm)[6] | |
| Thermochimie | ||
| S0gaz, 1 bar | 186,90 J·K-1·mol-1 | |
| ΔfH0gaz | −92,31 kJ·mol-1 | |
| ΔvapH° | 16,15 kJ·mol-1 (1 atm, −85 °C); 9,08 kJ·mol-1 (1 atm, 25 °C)[7] |
|
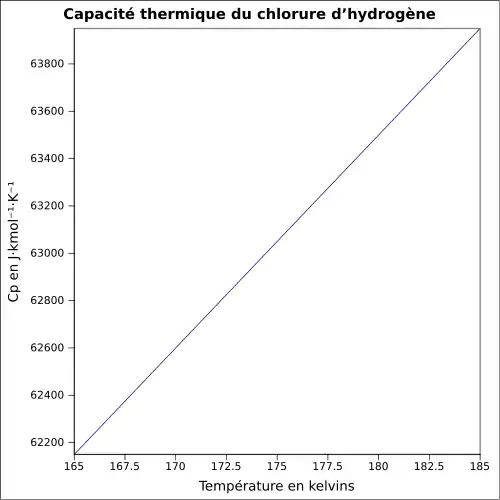
| Cp | 29,14 J/mol·K (25 °C)
|
|
| Précautions | ||
| SGH[8] | ||
   Danger |
||
| SIMDUT[9] | ||
   A, D1A, E, |
||
| NFPA 704 | ||
| Transport | ||
| Inhalation | amener à l'air frais, éventuellement réanimation cardiopulmonaire | |
| Peau | enlever les vêtements souillés, laver à grande eau, montrer à un médecin | |
| Yeux | laver à grande eau en maintenant les paupières ouvertes, montrer à un ophtalmologiste | |
| Ingestion | ne pas faire boire, ne pas faire vomir, contacter un médecin. | |
| Écotoxicologie | ||
| Seuil de l’odorat | bas : 0,25 ppm haut : 10,06 ppm[10] |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Le chlorure d'hydrogène, à l’instar de l'acide chlorhydrique, est un produit chimique important en chimie, dans l’industrie ou dans la science. Le nom HCl se réfère parfois de manière impropre à l'acide chlorhydrique au lieu du chlorure d'hydrogène pur. Les chimistes parlent parfois d'acide chlorhydrique gazeux ou anhydre pour se référer au chlorure d'hydrogène.
Histoire
Le chlorure d’hydrogène est connu depuis le Moyen Âge, où les alchimistes savaient que l’acide chlorhydrique (connu alors sous le nom d’esprit de sel ou acidum salis) était dans certaines circonstances lié à des vapeurs appelées gaz acide marin.
Au XVIIe siècle, Johann Rudolf Glauber utilisa du sel (chlorure de sodium) et de l’acide sulfurique pour fabriquer du sulfate de sodium, avec pour produit secondaire de réaction du chlorure d’hydrogène :
- 2 NaCl + H2SO4 → 2 HCl + Na2SO4.
Cette découverte est parfois attribuée à Carl Wilhelm Scheele, qui mit également en œuvre cette réaction en 1772. Joseph Priestley obtint du chlorure d’hydrogène pur en 1772, et en 1818, Humphry Davy démontra que ce gaz est composé d’hydrogène et de chlore.
Au cours de la révolution industrielle, la demande pour des substances alcalines, et notamment de carbonate de sodium devint de plus en plus importante. Nicolas Leblanc développa un nouveau procédé industriel de production de carbonate de sodium. Dans le procédé Leblanc, du sel (chlorure de sodium) est converti en carbonate de sodium en utilisant de l’acide sulfurique, de la craie et du charbon, avec une production secondaire de chlorure d’hydrogène. Jusqu’à la promulgation au Royaume-Uni de l’Alkali Act en 1863, ce dernier était libéré dans l'air. Les producteurs de carbonate de sodium durent alors le dissoudre dans l’eau, ce qui permit de produire de l’acide chlorhydrique à l’échelle industrielle. Plus tard, le procédé Hargreaves fut développé, similaire au procédé Leblanc à ceci près que l’acide sulfurique est remplacé par du dioxyde de soufre, de l’eau et l’air. Au début du XXe siècle, le procédé Leblanc fut remplacé par le procédé Solvay qui ne produit pas de chlorure d’hydrogène. Cependant, le chlorure d’hydrogène constitue toujours une étape dans la production de l’acide chlorhydrique.
Chimie

La molécule de chlorure d’hydrogène HCl est une molécule diatomique constituée d’un atome d’hydrogène H et d'un atome de chlore Cl, liés par une liaison simple. Le chlore étant nettement plus électronégatif que l’hydrogène, la liaison est polarisée. En conséquence, la molécule porte un moment dipolaire important, avec une charge partielle négative δ− portée par l’atome de chlore et une charge partielle positive δ+ portée par l’atome d’hydrogène. Le chlorure d’hydrogène est donc une molécule polaire. Elle est très soluble dans l’eau et dans les solvants polaires. 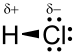
Au contact de l’eau, le chlorure d’hydrogène s’ionise pour former des anions chlorures Cl− et des cations hydronium H3O+ (H+ solvaté) :
- HCl + H2O → H3O+ + Cl−
La solution résultant de la réaction est appelée acide chlorhydrique. C’est un acide fort ce qui signifie que la constante d’acidité Ka (qui est liée au taux de dissociation de la molécule d’HCl) est très élevée : le chlorure d’hydrogène se dissocie presque totalement dans l’eau.
Même en l’absence d’eau, le chlorure d’hydrogène agit tout de même comme un acide. Par exemple, HCl peut se dissoudre dans d’autres solvants comme le méthanol et protoner des ions ou des molécules, agissant comme acide catalyseur pour certaines réactions chimiques pour lesquelles des conditions anhydres (absence totale d'eau) sont nécessaires :
- HCl + CH3OH → CH3O+H2 + Cl− (protonation par HCl d'une molécule de méthanol CH3OH)
Du fait de sa nature acide, le chlorure d'hydrogène est un gaz corrosif, tout particulièrement en présence d’humidité (2–5 ppm d'eau suffisent).
Production
La majeure partie du chlorure d’hydrogène produit dans l’industrie est utilisée pour la production d’acide chlorhydrique.
Une méthode courante de production de chlorure d’hydrogène dans l’industrie est le « four HCl », dans lequel du dihydrogène et du dichlore gazeux réagissent au cours d'une réaction exothermique pour former du chlorure d’hydrogène :
Cette réaction est utilisée pour fabriquer un produit très pur, destiné notamment à l’industrie alimentaire.
Le chlorure d’hydrogène peut également être produit à partir du dichlore et de composés contenant de l’hydrogène par exemple les hydrocarbures. La chloration des composés organiques peut donner lieu à la production de chlorure d’hydrogène :
La réaction de produits chlorés avec du fluorure d’hydrogène pour former des composés fluorés permet également de produire du chlorure d’hydrogène :
Lorsque ces réactions ont lieu en milieu anhydre (absence d’eau), il se forme du HCl gazeux.
Le chlorure d’hydrogène peut également être produit à l’échelle industrielle à partir de chlorure de sodium (NaCl) et d’acide sulfurique[11] :
2 NaCl + H2SO4 → 2 HCl + Na2SO4.
Synthèse du chlorure d'hydrogène
Le chlorure d’hydrogène peut être synthétisé en ajoutant lentement de l’eau (ou un acide) à certains réactifs chlorés en excès, tels que des chlorures de phosphore, le chlorure de thionyle (SOCl2) ou des chlorures d'acyle. Un ajout trop important d’eau peut conduire à la dissolution du chlorure d’hydrogène formé et à la formation d’acide chlorhydrique. Par exemple, l’ajout lent d’eau froide au pentachlorure de phosphore conduit à la formation d’HCl suivant :
Un ajout d’eau chaude permet d’obtenir plus de HCl en hydrolysant PCl5 en acide phosphorique. La réaction chimique entre l’eau et le trichlorure de phosphore PCl3 produit également du HCl.
La réaction du chlorure de thionyle avec l’eau produit du HCl ainsi que du dioxyde de soufre SO2. Pour les réactions du chlorure de thionyle ou des chlorures d’acyle avec l’eau, voir chlorure de thionyle et chlorure d'acyle.
Générateur d’HCl
Il est possible de préparer de petites quantités d’HCl pour une utilisation en laboratoire en utilisant un générateur d’HCl suivant différentes méthodes :
- libération à partir d’acide chlorhydrique concentré en utilisant de l’acide sulfurique concentré.
- libération à partir d’acide chlorhydrique concentré en utilisant du chlorure de calcium anhydre.
- en faisant réagir de l’acide sulfurique et du chlorure de sodium suivant : NaCl + H2SO4 → NaHSO4 + HCl↑
Généralement, l’acide chlorhydrique ou l’acide sulfurique est ajouté goutte à goutte au réactif dans un ballon. L’HCl peut être séché en le faisant buller au travers d’acide sulfurique concentré.
Utilisations
Les utilisations historiques du chlorure d’hydrogène au cours du XXe siècle incluent notamment l’hydrochloration des alcynes pour la production des monomères chlorés chloroprène et chlorure de vinyle, qui sont ensuite polymérisés pour fabriquer du polychloroprène (néoprène) et polychlorure de vinyle (PVC). Pour la production de chlorure de vinyle, l’acétylène (C2H2) subit une addition de HCl sur la triple liaison pour former du chlorure de vinyle.
Le « procédé acétylène », utilisé depuis les années 1960 pour produire le chloroprène, commence par la réaction de deux molécules d’acétylène. L’intermédiaire obtenu subit une addition de HCl sur la triple liaison ce qui conduit au chloroprène :
Le procédé acétylène a été remplacé par un procédé au cours duquel Cl2 s’additionne à l’une des doubles liaisons du 1,3-butadiène, étape suivie par une élimination qui produit du chloroprène et du HCl.
À l’heure actuelle, les principales applications du chlorure d'hydrogène concernent :
- pour la plus grande part la production d’acide chlorhydrique
- l’hydro-chloration du caoutchouc
- la production de chlorure de vinyle et de chlorure d’alkyle
- le traitement du coton
- l’industrie des semi-conducteurs.
Effets sur la santé

Le chlorure d’hydrogène forme de l’acide chlorhydrique au contact des tissus du corps. Son inhalation peut causer de la toux, la suffocation, l’inflammation des parois nasales, de la gorge et du système respiratoire. Dans les cas les plus graves, elle peut entraîner un œdème pulmonaire, une défaillance du système cardiovasculaire et la mort. Le chlorure d’hydrogène peut causer de graves brûlures des yeux et des dommages oculaires irréversibles. Il ne doit être utilisé que dans une pièce bien ventilée et avec un masque.
Notes et références
- CHLORURE D'HYDROGENE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 9-50
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) Klotz, Irving M. / Rosenberg, Robert M., Chemical Thermodynamics, Basic Concepts and Methods, Wiley-VCH Verlag GmbH & Co. KGaA, , 564 p. (ISBN 978-0-471-78015-1 et 0-471-78015-4), p. 98
- (en) W. M Haynes, Handbook of chemistry and physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 978-1-4398-2077-3), p. 14-40
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Chlorure d'hydrogène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Hydrogen chloride », sur hazmap.nlm.nih.gov (consulté le )
- « Chlorure d'hydrogène », sur Société chimique de France, (consulté le )
- Portail de la chimie