Histoire du procédé Haber-Bosch
L'histoire du procédé Haber-Bosch débute avec l'invention du procédé de chimie homonyme à l'aube du XXe siècle. Le procédé Haber-Bosch permet de fixer, de façon économique, le diazote atmosphérique sous forme d'ammoniac, lequel permet à son tour la synthèse de différents explosifs et engrais azotés. À ce double titre, du point de vue démographique, c'est probablement le plus important procédé industriel jamais mis au point durant le XXe siècle[1],[2].

Bien avant le début de la révolution industrielle, les agriculteurs qui « engraissent la terre » de différentes façons, savent les bénéfices d'un apport de nutriments essentiels à la croissance des plantes[3]. Les travaux de Justus von Liebig permettent, dans les années 1840, d'identifier l'importance de l'apport en azote à cette fin[4]. Par ailleurs, ce même composé chimique pouvait déjà être transformé en acide nitrique, précurseur des poudres pyroxylées et de puissants explosifs tel que le TNT et la nitroglycérine[5]. Cependant, s'il est alors connu que l'azote constitue une part dominante de l'atmosphère terrestre[7], la chimie minérale n'a pas encore établi de procédé pour le fixer.
Ainsi, lorsqu'en 1909 le chimiste allemand Fritz Haber parvient à fixer l'azote atmosphérique en laboratoire[8],[9], sa découverte présente à la fois un intérêt militaire, économique et agricole. Aussi n'est-il pas surprenant qu'en 1913, à peine cinq ans plus tard, une équipe de recherche de la société BASF dirigée par Carl Bosch mette au point la première application industrielle des travaux d'Haber : le procédé Haber-Bosch[10],[11]. Ce procédé servira de modèle, à la fois théorique et pratique, à tout un pan de la chimie industrielle moderne, la chimie à haute pression[12],[13].
La production industrielle d'ammoniac prolonge la Première Guerre mondiale en fournissant à l'Allemagne le précurseur des poudres modernes sans fumée et d'explosifs nécessaires à son effort de guerre, alors même qu'elle n'a plus accès aux ressources azotées traditionnelles, principalement exploitées en Amérique du Sud[14]. Durant l'entre-deux-guerres, la synthèse, à moindre coût[15],[16], d'ammoniac à partir du réservoir quasiment inépuisable que constitue l'azote atmosphérique[17] contribue au développement de l'agriculture intensive et soutient la croissance démographique mondiale. Lors de la Seconde Guerre mondiale, les efforts d'industrialisation du procédé Haber profitent largement au procédé Bergius, lequel permet à la société IG Farben de réaliser la synthèse de carburant pour le compte de l'Allemagne nazie, réduisant d'autant ses importations pétrolières.
Au début du XXIe siècle, l'efficacité du procédé Haber-Bosch (et ses analogues) s'est améliorée au point qu'il répond à plus de 99 % de la demande mondiale d'ammoniac synthétique, laquelle s'élève alors à plus de 100 millions de tonnes par an. Les engrais azotés synthétiques qui en sont dérivés, tels l'urée et le nitrate d'ammonium, sont l'un des piliers de l'agriculture industrielle et sont devenus essentiels à l'alimentation d'au moins deux milliards de personnes[15],[18]. Les installations industrielles mettant en œuvre ce procédé ont un impact écologique important. De plus les engrais azotés synthétiques sont consommés à grande échelle et la moitié de l'azote ainsi apporté n'est pas assimilé par les plantes. Ils se retrouvent alors dans les cours d'eau ainsi que dans l'atmosphère terrestre sous la forme de composés chimiques instables[12],[13].
Eldorados

Les agriculteurs savent depuis plusieurs siècles que certains nutriments sont essentiels à la croissance des plantes. Dans différentes régions du monde, ils développèrent des techniques pour engraisser la terre[note 1]. En Chine, les déchets produits par les humains étaient répandus dans les rizières. Au XIXe siècle, des bandes anglaises parcouraient le continent européen dans le but de déterrer des squelettes, lesquels étaient moulus pour en faire de l'engrais. Justus von Liebig, chimiste allemand et fondateur de l'agriculture industrielle, affirma que l'Angleterre avait « volé » 3 millions et demi de squelettes un peu partout en Europe. À Paris, jusqu'à un million de tonnes de crottin de cheval était recueilli annuellement pour engraisser les jardins de la ville. Toujours au XIXe siècle, les os des bisons tués dans l'Ouest américain étaient amenés aux usines de la côte Est[3].

Des années 1820 aux années 1860, les îles Chincha, au Pérou, furent exploitées pour leur guano, engrais de première qualité à l'époque. Il fut principalement exporté vers les États-Unis, la France et le Royaume-Uni. Le Pérou vit, pour quelques décennies, son activité économique augmenter considérablement[21]. Lorsque les gisements furent épuisés, environ 12,5 millions de tonnes en avaient été extraits[22],[diff 1].

Des recherches furent entamées pour trouver d'autres sources d'engrais. Le désert d'Atacama, sur le territoire péruvien à cette époque, recelait d'importantes quantités de « salpêtre du Chili » (du nitrate de sodium). Au moment de cette découverte, ce produit avait une utilité agricole limitée. En revanche, un chimiste parvint à développer un procédé chimique le transformant en salpêtre de qualité, produit servant à fabriquer de la poudre à canon. Ce salpêtre pouvait, à son tour, être transformé en acide nitrique, précurseur d'explosifs puissants, telles la nitroglycérine et la dynamite. Avec l'augmentation des exportations, les tensions entre le Pérou et les pays voisins s'accrurent[23].
En 1879, la Bolivie, le Chili et le Pérou entrèrent en guerre pour la possession du désert d'Atacama : ce fut la « guerre du nitrate ». Les forces boliviennes furent rapidement vaincues par les Chiliens. En 1881, le Chili avait également vaincu les forces péruviennes et prit le contrôle de l'exploitation des nitrates du désert d'Atacama. La consommation du salpêtre du Chili à des fins agricoles devint de plus en plus élevée. Les Chiliens virent, à leur tour, leur niveau de vie augmenter de façon notable[23].
Les développements technologiques en Europe mirent fin à ces eldorados. Au XXIe siècle, les minéraux en provenance de cette région constituent une « portion minime » de l'approvisionnement mondial d'azote[24],[25].
Un besoin pressant

À la fin du XIXe siècle, des chimistes, dont William Crookes, président de la British Association for the Advancement of Science en 1898[28],[29], avaient prédit que la demande pour les composés azotés, que ce soit sous forme d'engrais ou d'explosifs, dépasserait l'offre dans un avenir rapproché[30].
À la suite des travaux de Claude-Louis Berthollet publiés en 1784, les chimistes savent que l'ammoniac est composé d'azote[31]. Les premières tentatives de synthèse de l'ammoniac furent effectuées en 1795 par Georg Friedrich Hildebrandt. Plusieurs autres seront effectuées au cours du XIXe siècle[32].
Dans les années 1870, l'ammoniac était un sous-produit dont l'industrie du gaz ne savait quoi faire. Son importance apparut plus tard, au point que, dans les années 1900, l'industrie modifia ses installations pour le produire à partir du coke. Cependant, cette production ne pouvait suffire à la demande[33]. Par exemple, en 1910, la production d'azote fixé par les fours à coke atteignit environ 230 000 tonnes, alors que le Chili en exportait environ 370 000 tonnes[34].
En 1900, le Chili, grâce à ses dépôts de salpêtres, produisait les deux tiers de tous les engrais consommés sur la planète[35]. Cependant, ces dépôts viendraient à s'épuiser, leur exploitation était dominée par un oligopole et le coût du salpêtre augmentait sans cesse. Pour assurer la sécurité alimentaire de la population européenne grandissante, il était essentiel de trouver une méthode de production économique et fiable[36].
La question de la sécurité alimentaire était particulièrement aiguë pour l'Allemagne[37]. Son sol était peu fertile et son empire était incapable de lui apporter les richesses dont elle avait besoin. Grande consommatrice des salpêtres du Chili, elle en importa 350 000 tonnes en 1900. Douze ans plus tard, c'était 900 000 tonnes. La même année, les États-Unis en consommèrent moitié moins[38] alors que l'Allemagne comptait environ 20 millions d'habitants de plus[39],[40].
Dans les années 1890 et 1900, la chimie ayant progressé sur plusieurs fronts, des scientifiques tentèrent de fixer l'azote atmosphérique. En 1895 en Allemagne, les chimistes Adolph Frank et Nikodem Caro parvinrent à faire réagir du carbure de calcium avec du diazote pour obtenir du cyanamide calcique, un composé chimique pouvant servir d'engrais. L'exploitation industrielle du procédé Frank-Caro débuta en 1905. En 1918, 35 sites de synthèse fixèrent environ 325 000 tonnes d'azote[41]. De nos jours, le cyanamide sert surtout comme herbicide[42].

Wilhelm Ostwald, considéré comme l'un des meilleurs chimistes allemands au début du XXe siècle, tenta la synthèse de l'ammoniac vers 1900 à partir d'un appareil de son invention. Il intéressa BASF, qui demanda à Carl Bosch, chimiste récemment engagé, de valider l'appareil. Après plusieurs tests, Bosch affirma que l'ammoniac provenait de l'appareil même, et non de l'atmosphère. Ostwald contesta la conclusion de Bosch, mais ce dernier démontra avec certitude son affirmation et Ostwald dut s'incliner[43],[44].
En 1901, Henry Le Chatelier, se basant sur son principe, parvint à synthétiser de l'ammoniac à partir de l'air. Après avoir obtenu un brevet, il affirma qu'il était possible d'obtenir un meilleur rendement en élevant la pression. Lorsque l'un de ses assistants fut tué à la suite de l'explosion accidentelle d'un appareil, il mit un terme à ses recherches[45].
Aux États-Unis, Bradley et Lovejoy, spécialistes de l'électrochimie, conçurent une méthode basée sur la production d'arcs électriques. La fabrication industrielle d'acide nitrique basée sur leur méthode débuta en 1902[46]. Leur entreprise ferma ses portes en 1904, car la consommation d'électricité rendait les coûts de production trop élevés[47].
En 1905, le physicien norvégien Kristian Birkeland, avec le soutien financier de l'ingénieur et industriel Samuel Eyde, mit au point le procédé Birkeland-Eyde qui permet de fixer l'azote atmosphérique sous la forme d'oxydes d'azote[48],[note 3]. Ce procédé doit être exploité aux endroits où le coût de l'électricité est peu élevé : la Norvège comportait plusieurs sites capables de répondre à cette exigence. Norsk Hydro fut fondée le pour l'exploiter commercialement[49]. En 1913, l'ensemble de ses installations fixèrent 12 000 tonnes d'azote, soit environ 5 % du volume fixé par les fours à coke industriels en activité à ce moment[50].
Plusieurs procédés semblables furent développés à cette époque. Schönherr, à l'emploi de la société BASF, travailla sur un procédé en 1905[51],[44]. En 1919, le procédé Badische[note 4] était en usage dans les installations de Norsk Hydro[52]. La même année, le procédé Pauling était en usage en Allemagne et aux États-Unis[52].
Ils furent supplantés par le procédé Haber-Bosch, moins coûteux par tonne d'ammoniac synthétisé.
Une nouvelle approche
En 1905, le chimiste allemand Fritz Haber publia Thermodynamik technischer Gasreaktionen (La Thermodynamique des réactions de gaz techniques), un ouvrage s'intéressant plus à l'application industrielle de la chimie qu'à son étude théorique. Haber y inséra les résultats de ses études de cette équation chimique à l'équilibre :
- N2(g) + 3 H2(g) ⇌ 2 NH3(g) + ΔH
À 1 000 °C en présence d'un catalyseur de fer, des « petites » quantités d'ammoniac étaient produites à partir de diazote et de dihydrogène gazeux[54]. Ces résultats le découragèrent de poursuivre plus avant dans cette voie[55],[44]. Cependant, en 1907, conséquence d'une rivalité scientifique entre lui et Walther Nernst, la fixation de l'azote redevint pour Haber une priorité[56],[44].

Quelques années plus tard, profitant de résultats publiés par Nernst sur l'équilibre chimique de l'ammoniac[57] et s'étant familiarisé à la fois avec des procédés chimiques exigeant de hautes pressions et un procédé de liquéfaction de l'air[54],[58], Haber parvint à développer un nouveau procédé. Il n'avait aucune information précise sur les valeurs à imposer au système[59] mais, au terme de sa recherche, il put établir qu'un système efficace de production d'ammoniac doit[60],[61],[note 6] :
- fonctionner à haute pression (de l'ordre de 20 MPa[note 7]) ;
- mettre en œuvre un ou plusieurs catalyseurs[note 8] pour accélérer la synthèse de l'ammoniac ;
- fonctionner à une température élevée (entre 500 °C et 600 °C) pour obtenir le meilleur rendement en présence du catalyseur ;
- puisque environ 5 % des molécules de N2(g) et de H2(g) réagissent à chaque passage dans le réacteur chimique :
- séparer l'ammoniac des autres molécules par liquéfaction,
- soutirer en continu l'ammoniac,
- injecter à nouveau dans le réacteur chimique les molécules de N2(g) et de H2(g) qui n'ont pas réagi ;
- recycler la chaleur produite.
Pour maîtriser les problèmes liés aux hautes pressions, Haber fit appel aux talents de Robert le Rossignol, lequel conçut les appareils nécessaires à la réussite du procédé[62]. Au début de 1909, Haber découvrit que l'osmium pouvait servir de catalyseur. Plus tard, il établit que l'uranium pouvait aussi agir comme catalyseur[63]. De plus, Haber obtint de bons résultats avec le fer, le nickel, le manganèse et le calcium[64]. Dans l'équation chimique précédente, la réaction directe est exothermique. Cette chaleur peut servir à réchauffer les réactifs avant qu'ils n'entrent dans le réacteur chimique[note 9]. Des collaborateurs d'Haber mirent au point un système recyclant la chaleur ainsi produite[65].
En , Haber démontra à ses collègues de laboratoire qu'il avait enfin trouvé un procédé capable de fixer le diazote atmosphérique en quantité suffisante pour envisager son industrialisation[66].

Le , Haber informa BASF de son succès mais August Bernthsen, directeur de la recherche, ne pouvait croire que BASF voulut s'engager dans un tel projet. En effet, malgré de faibles chances de succès, la société avait acquis les droits sur le procédé Haber en 1908[68],[69]. Selon Bernthsen, aucun appareil industriel n'était capable de supporter, pendant une longue période, une pression et une température aussi élevées. De plus, le pouvoir catalytique de l'osmium risquait de disparaître à l'usage, ce qui demandait de le remplacer régulièrement, alors que ce métal est peu abondant sur Terre[70].
Cependant, Carl Engler, chimiste et professeur universitaire, écrivit au président de BASF, Heinrich von Brunck, pour le convaincre de discuter avec Haber. Von Brunck, en compagnie de Bernthsen et de Carl Bosch, se rendit au laboratoire de Haber pour déterminer si BASF devait s'engager dans l'industrialisation du procédé. Lorsque Bernthsen apprit qu'il fallait des appareils capables de supporter au moins 100 atm (environ 10 MPa), il s'exclama : « Cent atmosphères ! Pas plus tard qu'hier, un autoclave à sept atmosphères nous a explosé dans la figure ![trad 1],[71] ». Avant de se décider, Von Brunck demanda l'avis de Bosch[70].
Ce dernier avait déjà travaillé en métallurgie et son père avait installé un atelier mécanique à la maison, où le jeune Carl avait appris à manier différents outils. Il travaillait depuis plusieurs années sur la fixation de l'azote, sans avoir obtenu de résultats significatifs[72]. Il savait que les procédés qui avaient recours aux fours à arcs électriques, tel que le procédé Birkeland-Eyde, exigeaient d'énormes quantités d'électricité, les rendant économiquement peu viables en dehors de la Norvège. Pour continuer à croître, BASF devait trouver une méthode de fixation plus économique[73]. Bosch déclara : « Je crois que cela peut fonctionner. Je sais exactement ce que peut faire l'industrie de l'acier. Nous devrions tenter notre chance[trad 2],[74]. »
En , des employés de BASF vinrent sur place pour vérifier à nouveau le succès de Haber : les appareils de laboratoire fixèrent le diazote de l'air, sous forme d'ammoniac liquide, au rythme d'environ 250 millilitres aux deux heures[75],[44],[note 11]. La société BASF décida d'industrialiser le procédé, bien qu'elle soit associée à Norsk Hydro pour exploiter le procédé Schönherr[76]. Carl Bosch, futur responsable de l'industrialisation du procédé, rapporta que le facteur-clé qui incita BASF à s'engager sur cette voie fut l'amélioration du rendement apportée par l'usage de catalyseur[77].
| Fritz Haber, un chimiste controversé |
|---|
| Autant Fritz Haber fut louangé pour ses travaux sur la fixation de l'azote, autant il fut vilipendé pour ses travaux sur les armes chimiques[78].
Les conditions très difficiles dans lesquelles Haber devait travailler (à cette époque, il n'existait pas d'appareils de laboratoire conçus pour supporter cette haute pression et cette haute température, tout comme il n'existait pratiquement pas de résultats publiés sur ces conditions extrêmes) ne sauraient être trop soulignées[79]. Il reçut en 1920 le prix Nobel de chimie de l'année 1918[note 12] pour le développement d'une méthode de « fixation de l'azote atmosphérique[trad 3],[81] ». En revanche, pendant la Première Guerre mondiale, il participa à la mise au point de différentes armes chimiques[82]. Plus tard, pour cette raison, il fut catalogué comme criminel de guerre[83],[84]. |
Un nouveau champ de connaissance
À cette époque, la chimie à haute pression était un nouveau champ de connaissance, son industrialisation en était donc d'autant plus ardue. Toutefois, BASF avait développé un procédé industriel permettant de synthétiser la teinture d'indigo. L'effort avait pris 15 ans, mais se révéla payant : ce procédé fit de BASF un géant industriel[85].
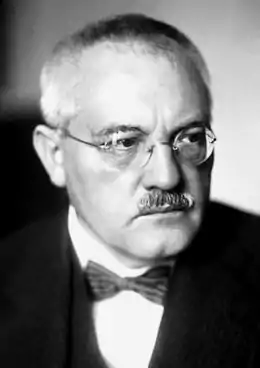
Dans son allocution précédant son acceptation du prix Nobel de chimie de 1931, Carl Bosch indiqua que, avant de synthétiser industriellement l'ammoniac, il fallait surmonter trois obstacles majeurs[87] :
- obtenir le dihydrogène et le diazote gazeux à un prix plus bas que celui couramment pratiqué à l'époque ;
- fabriquer des catalyseurs efficaces et stables ;
- construire les appareils.
Un mélange gazeux satisfaisant
À l'époque où Bosch entama le développement du procédé industriel, en 1909, il était possible d'obtenir un mélange gazeux, suffisamment pur, de dihydrogène et de diazote dans les bonnes proportions. Cependant, il n'y avait pas de source capable d'alimenter un site industriel à un coût suffisamment bas. Il était essentiel de développer une source économique car, selon Bosch, la majeure partie du coût de production de l'ammoniac, en 1908 ou 20 ans plus tard, dépendait du coût de l'hydrogène[note 13]. Lui et ses collaborateurs parvinrent à développer un procédé chimique catalytique capable d'alimenter en hydrogène les installations de BASF[87], trouvant ainsi un substitut au procédé chlore-alcali[88]. Au XXIe siècle, le gros du dihydrogène requis est produit à partir du méthane présent dans le gaz naturel, par catalyse hétérogène : cette extraction exige notablement moins d'énergie que d'autres méthodes[89].
Un catalyseur stable et peu coûteux

Lorsque le projet d'industrialisation fut lancé, Bosch rejeta l'osmium comme catalyseur, car cet élément chimique est très peu répandu. Il rejeta également l'uranium, car il réagit facilement avec l'oxygène et l'eau, tous deux présents dans l'air[90].
Bosch affecta Alwin Mittasch à la recherche d'un catalyseur stable et peu coûteux : lui et ses collègues étudièrent pratiquement tous les éléments chimiques du tableau périodique pour trouver un meilleur catalyseur. En , ils découvrirent un composé à base de fer qui présentait des propriétés intéressantes. Les impuretés dans le composé provoquaient un effet catalytique, mais Mittasch ignorait l'arrangement exact. Après deux années d'efforts, il découvrit un catalyseur, toujours à base de fer, nettement moins coûteux et plus stable que l'osmium[91]. Quand il cessa de rechercher un catalyseur idéal, en 1920, Mittasch estima qu'il avait testé environ 20 000 composés[92],[44]. Ses efforts ouvrirent une nouvelle ère en chimie : les chimistes reconnurent l'importance des promoteurs, c'est-à-dire des impuretés qui décuplent l'effet catalytique[93].
Selon Bosch, tous les catalyseurs à base de fer en usage en 1931 servaient à la synthèse de l'ammoniac. Il mentionna également que le molybdène avait d'excellentes propriétés catalytiques[87].
De nouveaux appareils
L'équipe de Bosch devait aussi concevoir des appareils industriels capables de fonctionner dans des conditions nouvelles à l'époque : une pression de l'ordre de 20 MPa et une température de l'ordre de 600 °C. Selon Bosch, il n'y avait aucun équivalent dans l'industrie (le procédé de liquéfaction de Linde, de nature physique, était ce qu'il y avait de plus proche). Pour répondre à leurs besoins, ils durent monter un atelier de fabrication de toutes pièces[94]. Bosch et ses collaborateurs répliquèrent le prototype de Haber pour mener leurs expériences. Cet appareil ne pouvait fonctionner de façon industrielle : ils conçurent de nouveaux appareils et 24 de ceux-ci furent mis en service jour et nuit pendant des années[94].

Lorsque Bosch crut que son équipe avait acquis suffisamment d'expérience avec les appareils de table, il fit construire deux réacteurs chimiques de plus grande taille. Chacun mesurait 2,44 mètres de haut et avait une paroi dépassant 2,5 centimètres d'épaisseur. Ces cylindres furent construits par le meilleur fabricant allemand de canons de l'époque : Krupp[96].
Pendant leurs expériences, ils découvrirent que les alliages réputés solides perdaient leur élasticité dans ces conditions d'opération. Spontanément, Bosch crut qu'une corrosion chimique, provoquée par l'azote, était responsable de ce phénomène. Pour confirmer ses soupçons, il fit appel à une nouveauté à l'époque en milieu industriel : l'analyse métallographique. Elle révéla que l'hydrogène à haute pression et à haute température était le coupable : il pénétrait les parois du réacteur, en acier, et les fragilisait en formant un nouvel alliage[97].
Ils tentèrent de résoudre ce problème en diminuant la température du réacteur[note 14], mais le catalyseur ne fonctionnait qu'à des températures supérieures à 400 °C. Ils recouvrirent les parois intérieures d'isolants thermiques, mais l'hydrogène diffuse facilement dans ces matériaux et, à haute pression, il est un excellent conducteur thermique. Ils essayèrent également divers aciers commercialement disponibles à l'époque, sans succès[98].
Le programme était menacé, car six mois après l'apparition du problème, il n'y avait toujours aucune solution viable et permanente. C'est finalement Bosch qui en trouva une, originale : celle de séparer deux fonctions offertes par l'enveloppe du réacteur. En effet, l'enveloppe sert (1) à maintenir la pression intérieure, très élevée, et (2) à prévenir la diffusion du mélange gazeux en dehors du réacteur. Un réacteur muni de deux parois, emboîtées à la manière de poupées russes, permet justement de séparer ces deux fonctions. L'hydrogène diffuse à travers la paroi intérieure et voit sa pression fortement réduite de l'autre côté, où il est nettement moins susceptible de corroder la paroi extérieure. Pour faciliter l'écoulement de l'hydrogène, les parois extérieures furent gravées de petites gouttières sur leurs faces intérieures. En revanche, il était possible que de l'hydrogène s'accumule entre les deux parois. Bosch se demanda comment prévenir les risques d'explosions provoquées par de telles poches. La solution lui apparut lorsqu'il se rendit compte que de petites quantités d'hydrogène pouvaient s'échapper à travers la paroi extérieure, sans diminuer notablement la pression du réacteur chimique. Il fit forer de petits trous dans la paroi extérieure[99]. Bosch affirma que cette solution était toujours en usage en 1931[100]. Il est aussi possible de réduire la corrosion en faisant circuler de l'azote gazeux entre les deux parois[101],[44].
Plusieurs membres de l'équipe de Bosch étaient des vétérans de l'époque où BASF avait mis au point différents procédés de synthèse de teinture, dont celle d'indigo. Ils savaient que la mise au point d'un procédé industriel pouvait prendre des années. C'est pourquoi ils n'étaient pas particulièrement déçus lorsqu'un problème apparaissait. Cependant, le programme avançait régulièrement, ce qui maintenait le moral des employés[102].
À l'époque, il n'existait pas de pompe industrielle capable de fournir une pression de l'ordre de 20 MPa. Le procédé de liquéfaction de Linde, par exemple, utilisait des pompes à air, mais de taille trop modeste. De plus, des fuites d'air étaient tolérées. Dans le procédé Haber-Bosch, les fuites d'hydrogène étaient intolérables à cause des risques d'explosion. De plus, toute fuite augmentait le coût de production de l'ammoniac. Après plusieurs années de travail, des employés sous les ordres de Bosch parvinrent à mettre en service des pompes étanches d'environ 2 240 kilowatts pouvant fonctionner en continu pendant 6 mois avant de subir un entretien, ce qui n'avait pas encore été réalisé[103].
Alors que Bosch et son équipe expérimentaient pour créer de nouveaux appareils, certains explosaient sous l'effet de la pression. Ils procédaient alors à une « autopsie » des débris pour déterminer ce qui avait provoqué la rupture. Cela leur permit de concevoir des appareils plus solides, plus fiables[93]. Pour maintenir l'intégrité physique des appareils de production, il fallait que le système de production soit rapidement arrêté en cas de bris : ils mirent au point un ensemble d'instruments destinés à surveiller l'évolution en continu des réactions chimiques, une autre nouveauté à l'époque[104]. Selon Bosch, le site de production devait fonctionner en continu de façon souple : tout arrêt à n'importe quel point du site provoquait son arrêt complet et cela prenait plusieurs heures avant qu'il ne puisse redémarrer, ce qui rendait la production moins payante[104].
En 2009, le siège de BASF se situe à Ludwigshafen en Allemagne. Oppau est l'un des districts de Ludwigshafen. |
C'est finalement le à Oppau en Allemagne que fut officiellement entamée la construction du premier site de synthèse industrielle de BASF. Bosch supervisait le projet, veillant à son bon déroulement. Sur place, les ouvriers montèrent des compresseurs de la « taille d'une locomotive », des réacteurs chimiques quatre fois plus gros que ce qui se faisait couramment ailleurs dans l'industrie chimique, une « mini-usine » pour extraire le diazote de l'air et le purifier avant de l'injecter dans les réacteurs, des kilomètres de tubulures, un système électrique complet comprenant ses générateurs, un système d'expédition portuaire rattaché à une gare de triage, un laboratoire opéré par 180 chercheurs aidés d'un millier d'assistants, ainsi que des logements pouvant accueillir plus de 10 000 travailleurs[105].

La société fut à même de fabriquer industriellement l'ammoniac à partir de 1913. Le site d'Oppau démarra sa production le . La même année, il put produire jusqu'à 30 tonnes d'ammoniac par jour[63]. En 1914, l'usine fabriqua 8 700 tonnes d’ammoniac, qui servit à alimenter une unité voisine, laquelle produisit 36 000 tonnes de sulfate d'ammonium[106].
Le site d'Oppau n'était pas seulement une source de revenus de plus en plus importante pour BASF, car sa production en croissance régulière était complètement écoulée, il servait également de laboratoire. Le site offrait l'occasion de développer la technologie, en devenir, de la chimie à haute pression. Bosch et ses collaborateurs devaient affronter des problèmes jamais vus auparavant, mais pouvaient explorer différentes approches sans se soucier outre mesure des coûts liés à leur développement[107].
| L'apport essentiel de Carl Bosch |
|---|
| L'apport de Carl Bosch à la première industrialisation du procédé Haber ne saurait être surestimé[108]. En effet, ce fut son opinion qui décida la direction de BASF de s'engager sur cette voie[109]. De 1909 à 1913, il supervisa plusieurs équipes de chercheurs de BASF, dont celle d'Alwin Mittasch qui découvrit un catalyseur stable et peu coûteux[110]. C'est Bosch qui trouva une solution à un problème qui durait depuis six mois, menaçant le programme[111]. Il supervisa également la construction des installations d'Oppau, site industriel d'une grande complexité[69].
W. J. Landis, directeur d’American Cyanamid Company[note 15], affirma en 1915 que « trop d'honneurs ne sauraient être signifiés aux courageux chimistes qui ont réussi à faire du procédé [Haber] une réalité commerciale[trad 4],[112] ». En plus de recevoir différentes distinctions (notamment cinq doctorats honoris causa), Carl Bosch reçut conjointement le prix Nobel de chimie de 1931 « pour [ses] contributions à l'invention et au développement de méthodes en chimie à haute pression[trad 5],[69] ». |
Première Guerre mondiale
Au début de la Première Guerre mondiale, en 1914, les dépôts de salpêtre du Chili étaient essentiels aux efforts de guerre allemand et allié. L'Allemagne dépêcha sur place quelques navires menés par le contre-amiral Maximilian von Spee. Le , au large des côtes du Chili, son escadre dut affronter des navires britanniques lors de la bataille de Coronel. Plus moderne, l'escadre de Von Spee coula deux navires britanniques et prit le contrôle de cette région. Toutefois, Von Spee savait qu'il ne pouvait maintenir sa position : il retourna donc en Allemagne, mais son escadre dut affronter des navires britanniques mieux armés et fut détruite le lors de la bataille des Falklands. À ce moment, les alliés reprirent le contrôle des dépôts de nitrates du Chili[113]. L'Allemagne, incapable d'importer les nitrates en provenance du Chili, devait trouver d'autres sources d'azote pour la production d'explosifs[114].
À partir de 1914, des hommes d'affaires allemands, faisant valoir le succès de différents sites de production de cyanamide[115], commencèrent à solliciter le gouvernement allemand pour qu'il finance la construction d'autres sites. Aux yeux de l'Allemagne en guerre, le principal défaut du procédé Haber-Bosch, moins coûteux, était qu'il ne pouvait produire de l'acide nitrique, précurseur d'explosifs. En pratique, il est difficile de convertir directement l'ammoniac en acide nitrique, mais Bosch se rendit compte que l'ammoniac pouvait être converti en salpêtre du Chili qui, à son tour, pouvait l'être en acide nitrique[116]. La deuxième transformation était industriellement maîtrisée en Allemagne, mais pas la première[117],[118],[diff 2].
En , Bosch fit une promesse hardie. Le site d'Oppau fabriquerait 5 000 tonnes de salpêtre par mois à partir de , puis augmenterait sa production jusqu'à 7 500 tonnes par mois. Ce salpêtre serait converti en acide nitrique, précurseur d'explosifs. En contrepartie, le gouvernement allemand devait financer la construction des installations au coût de six millions de marks. Lorsque la « Promesse du salpêtre » fut signée, le lobby du cyanamide devint moins influent[116]. BASF parvint presque à respecter la promesse faite par Bosch. En effet, le , ce dernier annonça aux officiels du ministère de la Guerre que le site d'Oppau pouvait fabriquer de l'acide nitrique[119].
L'armée allemande consommait toute la production d'Oppau et, pourtant, elle ne parvenait pas à maintenir son stock d'explosifs. De plus, Oppau dut subir des bombardements aériens, une autre nouveauté à l'époque. Le gouvernement allemand ne pouvait risquer de perdre sa seule source importante d'azote fixé : il demanda à BASF de construire un autre site de production[120].
Carte sommaire montrant la position de Leuna, près de la ville de Mersebourg en Allemagne. |
BASF, malgré sa taille et l'assurance que sa production d'ammoniac serait complètement écoulée, ne voulait pas assumer à elle seule le coût de construction. La société craignait notamment que le cours de l'ammoniac ne s'effondre après la guerre. En effet, le site serait à terme capable de produire deux fois plus que celui d'Oppau. Après des négociations s'étalant sur plusieurs mois, le gouvernement allemand, pris dans une guerre de tranchées qu'il n'avait pas anticipée, offrit à BASF un contrat avantageux : il lui prêta 30 millions de marks[diff 3] et y ajouta différents avantages. En contrepartie, le prix de l'ammoniac devait rester inchangé et le prêt serait remboursé une fois que BASF ferait des bénéfices[121],[122].
Dès que l'entente fut conclue, Bosch et ses collaborateurs entamèrent le processus de construction du deuxième site. Ils avaient choisi la ville de Leuna près de Mersebourg, située plus à l'intérieur de l'Allemagne, car Oppau, près de la frontière française, était régulièrement bombardé par les forces alliées[123]. L'énergie nécessaire au fonctionnement des compresseurs proviendrait de machines à vapeur : le site était près d'une rivière, la Saale, dans une région riche en dépôts de lignites, la vallée de la Saxe[122].
Comme à Oppau, il fallait tout construire à neuf : des unités de purification de dihydrogène, des nouveaux réacteurs chimiques, des échangeurs de chaleur, des unités de conversion de l'ammoniac en nitrates, des systèmes ferroviaires pour le transport des différentes substances, des bâtiments et des logements pour les employés. Malgré la taille et la complexité des appareils, les travaux furent terminés en 12 mois sous la supervision de Carl Krauch, chimiste et futur industriel. Bosch, adepte de l'efficacité, fut étonné que le site soit construit si rapidement. Des réacteurs chimiques furent démarrés le . Le lendemain, des wagons étaient remplis d'ammoniac[124].

La taille du site de Leuna, complexe industriel fortement intégré, était de 3,2 km par 1,6 km[125]. Le site produisit 36 000 tonnes d'ammoniac en 1917, l'année d'après, c'était 160 000 tonnes. La presque totalité de sa production était destinée à l'armée allemande[126]. La technologie des fours à arcs électriques de Norsk Hydro, plus coûteuse en énergie et capable de fixer au mieux quelques dizaines de milliers de tonnes d'azote par année[127], et celle du cyanamide, plus coûteuse en énergie également, étaient à toute fin pratique dépassées[14].
Selon Smil[128], les deux ententes passées entre le gouvernement allemand et BASF furent à l'origine de la montée en puissance des complexes militaro-industriels modernes. Pour Hager[129], BASF, en signant la Promesse du salpêtre, devint partie du complexe militaro-industriel allemand. Selon Jeffreys[119], le « programme de synthèse de nitrates[trad 6] » et le développement d'un programme d'armes chimiques amenèrent les industries chimiques allemandes et le gouvernement allemand à dépendre les uns des autres.
La Première Guerre mondiale cessa officiellement le . Vaincue, l'Allemagne était néanmoins en bien meilleur état que la France, qui exigeait réparations. Plusieurs responsables allemands en vinrent à la conclusion que tout ce qui avait de la valeur en Allemagne serait probablement pillé, y compris les installations de BASF. De plus, un fait n'avait pas échappé aux dirigeants des pays alliés[130] : l'Allemagne avait prolongé la guerre d'au moins une année grâce aux sites d'Oppau et de Leuna[14],[122],[diff 4].
Des secrets industriels convoités
La guerre terminée, les alliés s'emparèrent des secrets industriels de l'industrie chimique allemande : leur industrie avait en effet un important retard technologique sur les sociétés allemandes. Cette mainmise passait par la confiscation des brevets et par la dissection des installations, qui recèlent maints détails techniques indispensables mais qui ne sont pas dans les brevets. Si les appareils servant à la synthèse de l'ammoniac étaient disséqués, le savoir-faire de BASF deviendrait public[131], alors que les forces françaises occuperaient Ludwigshafen et Oppau à partir du .
À cette époque, les experts militaires de tous les pays savaient que le procédé Haber-Bosch avait permis à l'Allemagne de prolonger son effort de guerre[diff 4]. Pendant la Première Guerre mondiale, le Congrès des États-Unis avait voté un budget de plusieurs millions de dollars américains pour construire un site de synthèse d'ammoniac sur le territoire américain, mais le projet avait échoué. Les Britanniques avaient également tenté de faire de même, sans succès. La maîtrise du procédé passait nécessairement par le démontage et l'étude des installations d'Oppau[130].

L'occupation française ne dépassant pas le Rhin, BASF organisa le transport de différents biens de l'autre côté du fleuve. Malgré les efforts de la société, les forces françaises mirent la main sur des lots de teintures synthétiques et les expédièrent en France. À Oppau, Bosch fit éteindre les installations de synthèse d'ammoniac, prétextant une pénurie de charbon, ce qui était en partie vrai. Lorsque les Français exigèrent de voir les installations en marche, Bosch et les avocats de BASF s'y opposèrent en affirmant que les Français étaient à la recherche de secrets industriels. Les ententes entre les pays européens stipulaient que les vainqueurs avaient le droit de poser des questions, et d'obtenir des réponses, sur les matériaux industriels, mais pas sur les procédés. En d'autres termes, l'Allemagne avait le droit de préserver sa technologie[132].
Les Britanniques dépêchèrent également des équipes d'« inspection » sur le site d'Oppau. Pour eux, c'était une usine à munitions. Bosch affirmait que le site avait une vocation civile puisqu'il produisait des engrais. Les Français et les Britanniques souhaitaient démonter les installations puisque le site avait servi à l'effort de guerre, mais Bosch s'y opposait en affirmant le droit à la propriété en temps de paix[133].
Pour affirmer leur supériorité, les Français installèrent une force d'occupation à Oppau. Ils exigèrent des comptes sur les stocks de marchandises. Les employés du site furent photographiés comme s'ils étaient des prisonniers de guerre. Parmi les militaires présents sur place, des chimistes et des ingénieurs étaient rémunérés par des sociétés françaises : ils mesurèrent les différents appareils à Oppau et à Ludwigshafen, et notèrent leurs observations[133].
Lorsque des « inspecteurs » français approchaient, les employés cessaient toute activité et arrêtaient les appareils (la fabrication des teintures synthétiques était maintenue). Des échelles furent escamotées et les cadrans de jauges importantes furent obscurcis. Si les Français ne pouvaient voir les appareils en marche, ils ne pourraient déterminer comment ils fonctionnaient[134].
Bosch et ses collaborateurs savaient que la technologie était trop complexe à comprendre en quelques mois, encore moins en quelques semaines. Bosch utilisait tous les moyens légaux à sa disposition pour freiner le travail des « inspecteurs » français. Lorsqu'ils se plaignaient de l'attitude des employés de BASF, celle-ci répliquait que les soldats français abusaient des filles du village, fumaient dans les installations, créant un risque d'explosion, ou jouaient au football sur les terrains des fermes expérimentales[note 16]. Bosch menait une partie difficile : d'un côté, il voulait limiter les chances que les Français maîtrisent la technologie de synthèse de l'ammoniac, mais d'un autre côté, les installations de BASF ne rapportaient rien et la société perdait des millions de marks à maintenir en poste des employés désœuvrés. Bosch voulait aussi limiter l'influence des chantres du bolchevisme auprès des employés. Il lança un grand chantier de rénovations, de réparations et de constructions. Quand les Français partiraient, dans un an au mieux, dans une décennie au pire, les installations d'Oppau seraient prêtes à fonctionner à pleine capacité[134].
Au printemps 1919, décidée à maîtriser le procédé, la société britannique Brunner Mond dépêcha à Oppau des « inspecteurs ». Comme pour les Français, les employés de BASF s'opposèrent aux demandes des Britanniques : il n'était pas question de démarrer le site de synthèse d'ammoniac, ni de démonter des appareils. Quand les Britanniques demandèrent la coopération des forces françaises, la société BASF menaça de complètement arrêter le site, mettant à la porte des milliers d'employés. Les Français auraient à s'occuper des conséquences[130].

En , les négociations en vue du traité de Versailles furent entamées. Lorsque Bosch arriva à Versailles en tant que délégué allemand, il fut mis en détention préventive : dans les faits, c'était une prison luxueuse. Aux tables de négociations, les délégués allemands constatèrent que l'Allemagne se verrait imposer un traité de paix. Au contraire de la France et de la Belgique, l'Allemagne avait subi peu de destructions pendant la guerre. Elle était donc, en théorie, capable de payer pour la reconstruction dans les pays touchés. Les Français voulaient « mettre à genoux leur ennemi de longue date[trad 7],[136] » : les montants en jeu étaient « énormes » et tout ce qui pouvait payer pour la reconstruction serait mis à contribution[note 17]. Il faudrait plusieurs décennies avant que l'Allemagne ne se relève économiquement[137].
Les Français voulaient également détruire l'industrie allemande de l'armement, y compris les sites d'Oppau et de Leuna. Bosch plaida que les alliés avaient besoin d'une industrie allemande en forme. En effet, si la population allemande était privée de travail, de nourriture et d'autres biens, elle sèmerait le désordre. Par ailleurs, une population allemande occupée serait moins attirée par le bolchevisme. Finalement, si ces usines étaient fermées, comment l'Allemagne pourrait-elle payer les montants dus ? Tous ces arguments furent poliment ignorés[136].
Une nuit, Bosch se faufila discrètement hors de l'hôtel, passant à travers des barbelés. Il se rendit à un rendez-vous secret avec un haut responsable de l'industrie chimique française[note 18]. Le gouvernement français exigeait une licence commerciale exclusive sur le procédé Haber-Bosch pour tout le territoire français. Il exigeait un site capable de synthétiser 100 tonnes d'ammoniac par jour[diff 5]. Toutes les améliorations apportées au procédé par la société BASF seraient mises à la disposition des sites français pendant les quinze prochaines années. En échange, Bosch demanda que les installations d'Oppau et de Leuna soient épargnées. De plus, BASF recevrait 5 millions de francs et une redevance sur chaque tonne d'ammoniac produite. Les contrats furent signés le jour anniversaire de l'Armistice. Quelques semaines plus tard, les forces françaises se retirèrent d'Oppau. Bosch avait sauvé les sites d'Oppau et de Leuna[139],[diff 6].
En reconnaissance de ses efforts à Versailles, Bosch fut nommé directeur de BASF. Il aspirait à ce poste, car il ne vivait que pour BASF, mais répugnait à l'occuper, car il détestait les rencontres, lesquelles seraient nombreuses[140].
Les teintures synthétiques, qui avaient fait la fortune des sociétés chimiques allemandes, étaient maintenant fabriquées en France, en Grande-Bretagne et aux États-Unis. Pour survivre et croître, BASF devait développer de nouveaux marchés. Bosch fit augmenter la production d'ammoniac et se mit à la recherche d'un produit plus important[141].
En 1919, BASF, Bayerische Stickstoffwerke AG et d'autres sociétés allemandes formèrent un « syndicat de l'azote[trad 8] ». Contrôlant 98 % du marché allemand, il établissait le prix de vente de l'azote, tout comme les quotas à l'exportation. Dans ses premières années d'existence, le syndicat fut soutenu par le gouvernement allemand au nom de l'« intérêt national ». À l'exception de BASF, tous ses membres pouvaient produire autant qu'ils le désiraient[note 19]. Malgré sa composition hétéroclite, il put durer jusqu'en 1945[142].
En 1920, Bosch et Wilhelm Meiser mirent au point le procédé Bosch-Meiser qui permet de synthétiser l'urée à partir de l'ammoniac[143],[note 20]. Comparée à d'autres engrais azotés, l'urée (1) présente une concentration plus élevée d'azote[145], (2) vient sous forme cristallisée (par exemple, des granules), la rendant plus facile à transporter[145], (3) est soluble dans l'eau[146], (4) lorsque épandue, se décompose en ammoniac et en dioxyde de carbone[146], (5) est sans odeur[146],[note 21], (6) ne s'enflamme pas[146], (7) est non détonante[148],[note 22] et (8) s'évapore de façon « négligeable » à une température de 20 °C[148]. Étant sous forme solide, elle ne réclame pas d'installation pressurisée pour son transport et pour sa conservation. En revanche, sa fabrication à partir de l'ammoniac demande un surplus d'énergie (environ 35 % de celle de l'ammoniac)[150]. À cause de ces avantages, l'urée est l'engrais azoté le plus utilisé de par le monde au début du XXIe siècle[146]. Depuis 1997, la plupart des sites de synthèse d'ammoniac viennent avec une unité intégrée de fabrication d'urée[151].
Au printemps de 1921, des employés de BASF, influencés entre autres par le discours communiste, prirent le contrôle du site de Leuna. La société fit intervenir la police pour mettre un terme à leurs agissements : plusieurs grévistes furent tués. Les policiers firent des perquisitions dans les logements et arrêtèrent des centaines de travailleurs. Tous les employés, sans exception, furent renvoyés. BASF embaucha à nouveau les anciens employés en excluant ceux à risque. En ces moments de grands troubles économiques, les gens cherchaient désespérément du travail. La production du site revint à sa pleine capacité[152].
Peu après, BASF mura le site et fit appel à une force de sécurité : chacun des 30 000 employés qui entrait ou sortait du site devait présenter une carte d'identité. À tous les jours, des employés choisis au hasard étaient fouillés. Pour en savoir plus, un journaliste allemand décida de se rendre à l'intérieur du site en se déguisant en employé. Selon lui, Leuna était un enfer. C'était un labyrinthe de métal lui rappelant un « énorme ver de fer[trad 9] ». Les employés étaient payés à la tâche, plusieurs prenant des congés de maladie de temps à autre pour se reposer. Carl Bosch voyait Leuna différemment : c'était un summum de perfection technique. Les employés travaillaient dur, mais ils démontraient de quoi étaient capables les humains[153].

Pendant la Première Guerre mondiale, le site d'Oppau avait été modifié pour produire du nitrate d'ammonium, précurseur d'explosifs. Ce produit était stocké près d'autres composés chimiques, dont du sulfate d'ammonium (qui peut servir d'engrais). En 1921, une importante explosion se produisit dans un silo contenant environ 4 000 tonnes de sulfate d'ammonium nitraté[154]. L'explosion d'Oppau causa le décès de centaines de personnes et dévasta la ville[155].
Carl Bosch, abattu, se retira dans sa villa d'Heidelberg pendant plusieurs mois, laissant ses lieutenants s'occuper des affaires courantes de BASF. Au coût d'environ 500 millions de Papiermarks, le site d'Oppau fut remis en fonction en trois mois sous la supervision de Carl Krauch[156].
En 1924, les deux tiers des revenus de BASF provenaient de la production d'ammoniac aux sites d'Oppau et de Leuna. La société investissait en recherche et développement pour améliorer la production, rendant les sites plus productifs, plus stables et plus profitables[157]. Ces améliorations permirent à BASF de concurrencer les sites de synthèse français, mais d'autres compétiteurs commençaient à entrer dans la course[158].
La société britannique Brunner Mond, qui avait tenté de négocier une licence pour le procédé Haber-Bosch, préféra acquérir illégalement la technologie. Deux ingénieurs alsaciens livrèrent les plans des deux sites pour la somme de 12 500 000 francs. À Noël 1923, Brunner Mond exploitait deux sites de synthèse d'ammoniac, et n'avait rien versé à BASF. La société américaine DuPont décida de débaucher des techniciens seniors de BASF. Quelques mois plus tard, elle aussi synthétisait de l'ammoniac sans avoir versé un seul sou à BASF[158].

D'autres compétiteurs de moindre taille firent aussi leur apparition. Un peu avant 1920, l'Italien Giacomo Fauser développa un procédé permettant de synthétiser l'ammoniac au rythme de 100 kg par jour[160]. Ses travaux furent industrialisés et menèrent au procédé Fauser-Montecatini[161], abandonné à la suite de la disparition du groupe Montecatini dans les années 1960. En 1921, l'Italien Luigi Casale fonda la société suisse Ammonia Casale SA à Lucerne dans le but de commercialiser son procédé de synthèse. En 2009, la société affirmait avoir installé plus de 200 sites de synthèse de par le monde[162]. Vers 1920, Georges Claude, fondateur d'Air liquide, développa un procédé pour la synthèse de l'ammoniac qui exige une pression se situant entre 70 et 100 MPa environ[163],[161],[note 23]. L'Allemand Friedrich Uhde développa de son côté le procédé Mont Cenis-Uhde, un procédé à basse pression conçu pour profiter des gaz produits par les fours à coke en service au mont Cenis à Herne en Allemagne[167]. La société américaine U.S. Nitrogen Engineering Company mit au point elle aussi un procédé semblable dans les années 1920[168]. Dans les années 1960, la plupart de ces procédés étaient encore commercialement disponibles[161]. D'autres procédés furent développés durant les années 1980 et 1990[169].
En 1939, sur les 110 sites de synthèse en fonction, environ 90 % utilisaient ces procédés concurrents, mais la moitié de la production d'ammoniac synthétique provenait du procédé Haber-Bosch. Après la Seconde Guerre mondiale, le procédé Haber-Bosch et ses analogues prirent de plus en plus d'importance au point d'éclipser les autres procédés[168].
Naissance d'un géant
En 1924, des employés de BASF mirent au point le procédé Mittasch-Pier-Winkler qui permet de synthétiser le méthanol à partir d'un gaz de synthèse[170],[171],[172]. Le site de Leuna fut modifié pour en produire, BASF ajoutant ainsi une source de revenus supplémentaires. Comme pour le procédé Haber-Bosch, il exige une haute pression[173]. Dans les années 1920, sur l'initiative de Bosch, des chercheurs de BASF parvinrent à développer un procédé industriel qui permet de convertir le méthane (CH4) en dihydrogène (H2) : c'est le vaporeformage, lequel permit d'abaisser notablement le coût de production de l'ammoniac. Il est toujours utilisé au XXIe siècle[174].

Pendant les années 1920, les sociétés chimiques allemandes virent leur importance économique diminuer. Dans le but de faire contrepoids aux entreprises britanniques et américaines (principalement Imperial Chemical Industries en Grande-Bretagne et Allied Chemical and Dye Corporation aux États-Unis), les dirigeants de BASF, de Bayer et de Hoechst décidèrent de se rencontrer pour finaliser une proposition qui était en germe depuis un moment : celle de fusionner leurs activités[note 24]. Lors d'une série de négociations en , cette proposition fut modulée en un Interessengemeinschaft (« groupement d'intérêt économique »), ce qui donna naissance, à l'automne de 1925, à un géant mondial : IG Farben. Les sociétés membres demeurèrent libres de commercialiser leurs produits sous leurs marques, mais partagèrent leurs laboratoires de recherche et leurs structures administratives[176],[177].
En 1926, IG Farben avait une capitalisation boursière de 1,4 milliard de Reichsmarks et employait environ 100 000 personnes[178]. 65 % de ses « énormes profits » provenaient de la synthèse de l'ammoniac, mais les coûts de recherche et développement de BASF furent « énormes ». Heinz Beike, en 1960, estima que le développement des sites de synthèse avaient coûté environ 820 millions de Papiermarks de [note 25], la moitié empruntée au gouvernement allemand[180].
Carl Bosch, nommé directeur d'IG Farben à sa fondation, put entreprendre un projet aussi important, sinon plus, que l'industrialisation du procédé Haber : la synthèse de l'essence. Il avait en effet accès à d'énormes capitaux de recherche, pouvait profiter de toutes les technologies mises au point par les différentes sociétés chimiques d'IG Farben, dont la maîtrise industrielle des procédés Haber-Bosch et Mittasch-Pier-Winkler[181], et avait accès à des laboratoires de recherche imposants. Après avoir acquis les brevets de Friedrich Bergius sur l'hydrogénation, IG Farben mit en branle un vaste programme de recherche sur ce procédé[182].

Vers la fin des années 1920, un gisement pétrolifère fut découvert en Oklahoma aux États-Unis. Au début, les prospecteurs croyaient qu'il s'agissait d'un petit gisement, mais l’East Texas était plutôt une « mer de pétrole[trad 13] ». En 1930, le Texas et la Louisiane virent leur territoire se couvrir de stations de pompage. Le prix de l'essence passa à neuf cents américains pour 3,785 litres[note 26]. L'essence synthétique d'IG Farben, la Leunabenzin (littéralement, « essence de Leuna »), ne pouvait rivaliser[183].
La crise économique de 1929 vint bouleverser l'ensemble des activités d'IG Farben. La demande pour tous ses produits diminua. Celle pour l'ammoniac synthétique diminua d'un tiers en 1930. Trois ans plus tard, en 1933, les revenus d'IG Farben étaient divisés par deux[184].

Heinrich Brüning fut nommé chancelier fédéral d'Allemagne en 1930. Lui et Bosch s'entendant bien, IG Farben obtint des avantages du gouvernement allemand, ce qui permit au groupe d'écouler sa production de Leunabenzin en Allemagne[183]. De plus, le cabinet de Brüning décréta un embargo sur l'importation des engrais azotés, ce qui permit à IG Farben d'augmenter le prix de ses engrais synthétiques en Allemagne[185].
Malgré la compétition à l'étranger, IG Farben écoulait toute sa production d'ammoniac synthétique. De plus, elle installa quelques sites de synthèse aux États-Unis, en France et en Norvège. Son expertise en chimie à haute pression lui permit d'envisager la production de différents produits, tels le caoutchouc synthétique (Buna) et des plastiques[186]. Jusqu'en 1930, IG Farben était le plus grand producteur mondial d'ammoniac synthétique. En 1927, elle en fabriqua environ 500 000 tonnes. De 1929 à 1932, ce fut environ un million de tonnes par année[187].
Paul von Hindenburg, président du Reich de la République de Weimar, obtint la démission de Heinrich Brüning en . Après plusieurs bouleversements politiques, Adolf Hitler devint chancelier le [188]. Selon Bosch, l'Allemagne avait besoin de tous ses scientifiques, même juifs. Lors d'une rencontre en tête-à-tête, Hitler réagit avec violence à la proposition de Bosch et ce dernier ne fut plus le bienvenu dans l'entourage du Führer, ni parmi les dignitaires allemands[189].
Le directoire d'IG Farben, désireux d'augmenter les ventes de la société, entreprit d'améliorer ses relations avec le régime nazi. En 1935, Bosch fut relégué à un poste honorifique[190]. Ensuite, IG Farben se mit entièrement au service du régime, lui fournissant essence, caoutchouc et nitrate, tous synthétiques[191],[192],[193]. Comme BASF lors de la Première Guerre mondiale, IG Farben devint partie du complexe militaro-industriel allemand[194],[195].
En 1936, Hermann Göring fit publiquement part du Plan de quatre ans : le Troisième Reich devait mettre en place une industrie capable de soutenir l'effort de guerre à venir. Et, selon les lignes du plan, les sociétés chimiques étaient celles qui avaient le plus besoin des fonds du gouvernement allemand. En effet, elles seules pouvaient produire les substituts synthétiques aux matériaux importés, tels qu'essence, caoutchouc et produits azotés précurseurs d'explosifs. Pendant les six premiers mois du programme, IG Farben reçut environ 70 % du milliard de Reichsmarks dépensés[196]. Durant la période 1936-1939, 40 % de l'augmentation des ventes d'IG Farben provenait directement des subventions versées par le gouvernement allemand dans le cadre du plan[197].
Entre 1936 et 1939, des chercheurs d'IG Farben développèrent une nouvelle méthode d'oxydation partielle. Elle permet de transformer n'importe quel hydrocarbure (ou presque) en source d'hydrogène suffisamment pur pour les besoins du procédé Haber-Bosch. Leur ratio H:C étant plus faible que celui du gaz naturel, le traitement de ces hydrocarbures réclame des installations plus importantes. Dans la pratique industrielle, les fiouls lourds sont préférés à cause de leur coût plus bas[198].
Seconde Guerre mondiale
Les États-Unis entrèrent officiellement en guerre après l'attaque de Pearl Harbor du [199]. Cependant, le gouvernement fédéral américain, conscient des besoins militaires à venir alors que la guerre faisait rage en Europe, avait déjà mis en branle un important programme de construction de sites de synthèse. Le premier fut complété en 1941. Dix autres furent construits, ajoutant 880 kilotonnes d'ammoniac à la production annuelle des États-Unis[200].

Pendant la Seconde Guerre mondiale, le site de Leuna produisit de la Leunabenzin pour le compte de l'armée allemande. D'autres sites furent également construits, car Leuna répondait au quart de la demande allemande. En 1939, l'Allemagne importait plus des deux tiers de son carburant. Au début de 1944, malgré quatre ans de guerre et d'embargo sur ses importations, elle avait autant de carburant en réserve. Le site synthétisait également des composés azotés, précurseurs des engrais et des explosifs[201].
En 1944, la taille du site de Leuna était d'environ 7,77 km2 et le site employait environ 35 000 personnes, dont le quart était des prisonniers ou des esclaves[202],[201]. À ce moment, c'était probablement l'endroit le plus important d'Europe du point de vue stratégique. Fortement protégé, il était entouré de murs anti-souffle et de batteries de canons antiaériens. Ailleurs en Allemagne, les batteries antiaériennes étaient constituées de 6 à 12 canons. À Leuna, chaque batterie était constituée de 32 canons dirigés par un radar, une Grossbatterie. Des leurres de fumée masquaient partiellement le site et il était entouré d'avions de combat prêts à s'envoler pour le défendre. Les cadres d'IG Farben formèrent 5 000 personnes comme pompiers volontaires et 20 000 autres furent entraînées à manœuvrer les canons antiaériens[201].
Le site fut bombardé pour la première fois le [203] : c'était le début de la bataille de Leuna qui dura presque un an[204] et qui s'inscrivait dans le cadre d'une campagne militaire destinée à réduire les réserves de produits pétroliers allemands[205],[206]. Après l'attaque du , le site fut remis en fonction en trois jours et des mesures furent prises pour renforcer sa protection. Plus tard au mois de mai, des généraux allemands affectèrent 350 000 travailleurs, dont 7 000 ingénieurs de l'armée, à la maintenance et à la réparation du site. Les bris causés par les bombardiers étaient rapidement réparés. Les forces américaines maintinrent leurs attaques aériennes malgré les pertes encourues. En effet, beaucoup de bombardiers furent détruits ou endommagés pendant ces attaques[208]. Cependant, en , ils rencontrèrent peu de résistance pendant trois semaines de suite. Quelques jours plus tard, les avions allemands détruisirent plusieurs bombardiers américains lors d'une « attaque massive ». Mais c'était insuffisant pour arrêter les attaques : vers la fin de la guerre, le site de Leuna ne produisait plus qu'à 15 % de sa capacité nominale[209]. Pendant la bataille de Leuna, les forces américaines avaient lancé 22 « attaques aériennes massives », envoyé plus de 6 000 bombardiers, lesquels avaient largué 18 000 tonnes de bombes. Après la guerre, l'Allemand Albert Speer, ministre de l'Armement et des Munitions, déclara que si les forces alliées avaient détruit tous les sites de production d'essence synthétique, la guerre se serait terminée en huit semaines[210].
La diffusion des différentes technologies de synthèse de l'ammoniac fut freinée par la guerre, mais la capacité des sites déjà construits fut augmentée[211],[212].
De 1927 à 1933, alors qu'il travaillait chez IG Farben, Leonid Andrussow développa le procédé Andrussow servant à synthétiser l'acide cyanhydrique à partir de méthane et d'ammoniac[213],[214]. La mise au point du procédé, qui se déroule en partie à haute température[215], fut possible grâce à l'expertise de BASF. Ce procédé permit la production industrielle du Zyklon B, pesticide notamment utilisé pour tuer les prisonniers dans les camps de concentration allemands lors de la Seconde Guerre mondiale[216].
Pour leur participation active à la Shoah, plusieurs hauts dirigeants d'IG Farben furent jugés en 1947 lors du procès IG Farben. La société fut démantelée à partir d' et BASF redevint une société à part entière. Au début du XXIe siècle, BASF était la plus grande société chimique au monde par le chiffre d'affaires[217].
Productions décuplées
Une période difficile
Au sortir de la Seconde Guerre mondiale, les infrastructures de l'Europe et du Japon étaient en ruines. En Asie, plusieurs pays avaient subi d'importantes destructions. Les États-Unis, épargnés par les destructions, étaient économiquement mieux[218].
Le président des États-Unis Harry S. Truman, craignant des menées soviétiques un peu partout sur la planète, officialisa le ce qui sera appelé la doctrine Truman[219]. Ce fut l'un des facteurs qui menèrent à la guerre froide[220].
Le , environ trois ans après la fin de la guerre, le plan Marshall fut officiellement lancé pour aider à la reconstruction en Europe. Il facilita le miracle économique français et le miracle économique allemand. À cette époque, la population américaine, se souvenant de l'Attaque de Pearl Harbor, éprouvait peu de sympathie pour le Japon, qui ne pouvait donc espérer d'aide économique des États-Unis. Cependant, pendant la guerre de Corée, les industries japonaises devinrent un important fournisseur militaire, ce qui permit au pays de se relever économiquement[221]. C'était le début du miracle économique japonais.
Une technologie qui se mondialise
Au lendemain de la Seconde Guerre mondiale, en 1945, la production mondiale d'ammoniac synthétique était au niveau atteint à la fin des années 1920[222]. C'est à partir des années 1950 qu'elle recommença à augmenter de façon notable. Plusieurs raisons majeures expliquent ce changement : (1) fin du rationnement alimentaire en Europe, (2) augmentation moyenne du pouvoir d'achat en Occident, (3) augmentation de la consommation de produits carnés en Occident et (4) diffusion aux États-Unis d'une variété de maïs hybride forte consommatrice d'engrais azotés[note 28],[222].
C'est également à partir des années 1950 que la construction de sites de synthèse d'ammoniac devint l'affaire de quelques sociétés de génie qui détenaient à la fois l'expertise et les brevets. Elles offraient leurs services de conception, de construction et de démarrage des sites partout sur la planète. Les tendances qui se dessinèrent sur le territoire américain devinrent par la suite caractéristiques des nouveaux sites : (1) le gaz naturel est leur source primaire d'hydrogène, (2) ils sont construits à la fois près d'un puits ou d'un pipeline de gaz naturel et d'un cours d'eau navigable et (3), en plus de l'ammoniac, ils fabriquent différents engrais liquides et solides[222].
Dans les années 1960, les procédés de synthèse de l'ammoniac, et des produits dérivés, commencèrent à se répandre hors des pays dits développés[note 29]. Des installations furent construites dans les régions riches en gaz naturel (Caraïbes et Moyen-Orient), tout comme dans des pays populeux dits sous-développés (Chine, Inde, Pakistan et Indonésie)[223]. Mao Zedong lança son Grand Bond en avant en 1958. À cette époque, la population chinoise augmentait à un rythme élevé. Ce programme politique obligea les Chinois à former des communes agricoles, punissant ceux qui voulaient entretenir un jardin familial. Il provoqua la famine en Chine, tuant au moins 15 millions de Chinois de 1958 à 1962[224]. Les autorités chinoises permirent à nouveau la culture selon des méthodes traditionnelles[225].
En 1963, les autorités chinoises lancèrent un important programme de construction de sites de synthèse d'ammoniac. L'hydrogène provenait de l'oxydation partielle du charbon[note 30]. Leur rendement énergétique était de 120 GJ par tonne d'ammoniac[226], alors que dans les années 1950, les sites au charbon les plus efficaces consommaient 85 GJ par tonne et, dans les années 1960, les sites au gaz naturel consommaient environ 45 GJ par tonne[227]. Malgré ce faible rendement, les sites chinois au charbon furent maintenus en service (en 1997 par exemple, ils synthétisèrent 18,75 Mt d'ammoniac)[226].
Ces améliorations ne suffirent pas, la Chine était encore soumise au rationnement alimentaire au début des années 1970. Trente-cinq ans plus tard, soit en 2008, la Chine s'est attaquée à un fléau moderne : l'obésité[225]. Après la visite de Richard Nixon du 21 au [228], les relations se détendirent avec l'Occident. Les autorités chinoises passèrent commande de 13 complexes de synthèse d'ammoniac[note 31]. Elles voulaient la technologie la plus efficace et les plus grands complexes disponibles. En quelques années, la quantité d'engrais azotés doubla en Chine. Les autorités chinoises commandèrent d'autres complexes[230]. En 2008, la Chine était à la fois le plus grand producteur et le plus grand consommateur d'ammoniac synthétique. La population y était plus nombreuse qu'au temps de Mao et, pourtant, les Chinois avaient accès à plus de nourriture que la génération précédente[230].
Au début des années 1960, l'Inde était « au bord de la catastrophe » : la population ne cessait de croître et les paysans, qui cultivaient comme au Moyen Âge, étaient incapables de répondre à la demande. Une famine récurrente s'installa dans le pays. Le Premier ministre de l'époque, Jawaharlal Nehru, lança alors un vaste programme de modernisation agraire. Monkombu Swaminathan, généticien et agronome, fut chargé de coordonner le projet. Sur les conseils de l'agronome américain Norman Borlaug, « père » de la révolution verte[231], le pays importa massivement des engrais et des semences à haut rendement, et les agriculteurs indiens appliquèrent les techniques de culture intensive utilisées en Europe et en Amérique du Nord. En quelques mois, la production de céréales doubla : c'était le début de la « révolution verte indienne ». Contre toute attente, les Indiens purent recommencer à manger à leur faim dès 1968. Quarante ans plus tard, soit en 2004, l'Inde était le premier producteur mondial de lait et de thé et était deuxième pour le riz et le blé. C'était le troisième exportateur de coton[232].
Dans les années 1960, la production mondiale d'ammoniac synthétique fut multipliée par 2,3, atteignant environ 42 Mt/an. Dans les années 1970, elle augmenta presque d'autant. Cette demande était soutenue par des pays d'Asie et d'Amérique du Sud qui cultivaient massivement de nouveaux cultivars de riz, de blé et de maïs. Elle fut facilitée par la découverte, et l'exploitation, d'importants gisements de gaz naturel en Asie centrale et en Sibérie[222]. Pendant les années 1980 et 1990, la croissance fut moins importante, mais continua. Signe de cette croissance soutenue, la capacité mondiale de production d'ammoniac en 1990 était de 120 Mt, alors qu'en 1999, elle était de 160 Mt[233].

Des gains d'énergie remarquables
Jusqu'au début des années 1950, la préparation du gaz de synthèse, mélange de H2 et de N2, se faisait dans des appareils travaillant sous une pression de l'ordre de 1 MPa. Par la suite, de nouveaux alliages et des techniques de construction plus précises permirent d'augmenter la pression jusqu'à 4 MPa. Du coup, (1) la taille des équipements fut réduite, (2) la quantité de catalyseur nécessaire fut réduite, (3) la quantité d'énergie nécessaire à la compression fut aussi réduite et (4) le taux de récupération de la chaleur résiduelle fut augmentée. Ces améliorations permirent de réduire le coût de préparation du gaz de synthèse de façon significative[235]. La société M. W. Kellogg Company (MWK) fut la première, en 1953, à appliquer cette technologie[236].
Texaco, en 1954, et Shell, en 1956, commercialisèrent de nouveaux procédés permettant d'extraire l'hydrogène d'hydrocarbures liquides. Cette technologie est intéressante dans les régions où le gaz naturel n'est pas abondant[236].
La mise au point des moteurs à réaction, indépendamment par le Britannique Frank Whittle et par l'Allemand Hans von Ohain dans les années 1930 et 1940[237],[238], amena elle aussi son lot d'innovations, comme la création de la turbine à gaz et du compresseur centrifuge. Les premiers procédés industriels de synthèse d'ammoniac, obtenus sous licence d'IG Farben ou développés après la Première Guerre mondiale, appliquaient les principes exposés par Haber. En conséquence, la technologie des compresseurs alternatifs, initialement créée par des collaborateurs de Carl Bosch, était la seule utilisée dans les sites de synthèse jusqu'à la fin de la Seconde Guerre mondiale. La mise au point de compresseurs centrifuges multi-étages permit des gains importants en termes d'énergie consommée. En effet, un seul compresseur de ce type peut remplacer plusieurs compresseurs alternatifs[236]. Les compresseurs alternatifs sont capables d'atteindre une pression de l'ordre de 100 MPa et ont un taux de rendement élevé (jusqu'à 87 %), mais sont à la fois coûteux à installer et à exploiter. Les compresseurs centrifuges sont capables de traiter de plus grands volumes d'air, mais doivent fonctionner à 70 % ou plus de leur capacité pour alimenter efficacement un site de synthèse[239].
Dans le jargon de l'industrie, une unité servant à produire de l'ammoniac est appelée un « train » : il est composé (1) de l'unité de préparation du gaz de synthèse, (2) du réacteur chimique où se déroule la synthèse, (3) de l'unité de stockage et (4) de la tuyauterie servant à la circulation des fluides (gaz et liquides caloporteurs, entre autres). Par exemple, le site de Leuna au moment de sa fermeture en 1990 comportait 18 trains. Il y avait donc 18 compresseurs alternatifs en fonction[240].
Au début des années 1960, la capacité maximale d'un train était de 300 tonnes d'ammoniac par jour. Avant l'introduction des compresseurs centrifuges, les sites de synthèse arrêtaient autant de trains que nécessaire pour répondre à une baisse de la demande, car il existait peu de moyens économiques d'entreposer l'ammoniac liquide. La commercialisation de réfrigérateurs industriels pour liquides, ainsi que la mise en place de pipelines et de navires frigorifiés, permirent d'envisager une amélioration du procédé[239].
Dans les années 1960, s'appuyant sur différentes innovations, les ingénieurs de la MWK décidèrent de recourir à la vapeur pour transporter l'énergie vers les différents appareils d'un site « d'une conception radicalement nouvelle[trad 14] ». Ils mettaient ainsi à profit l'énergie dégagée lors de la synthèse de l'ammoniac. Tous les besoins de compression du site sont fournis par un seul compresseur centrifuge, lequel est entraîné par une turbine à vapeur. Ils minimisèrent également les pertes de chaleur dans différents appareils. Tous ces efforts permirent de créer un site capable de s'auto-suffire en énergie. Également, la surface active des catalyseurs fut améliorée[229] et l'introduction du méthanateur amena la création d'un gaz de synthèse plus pur[241]. Tous ces changements permirent de concevoir des sites de synthèse exigeant une pression moins élevée. Avant 1963, elle était habituellement de l'ordre de 30 à 35 MPa. Par la suite, elle fut diminuée à 15 MPa ou moins. Cette diminution agit défavorablement sur la réaction directe de N2(g) + 3 H2(g) ⇌ 2 NH3(g), mais autorise des installations moins coûteuses. En conséquence, le coût de production de l'ammoniac synthétique en est d'autant plus bas[242].
La technologie mise au point par les ingénieurs de la MWK fut nommée « single-train ammonia plant », que l'on peut traduire par « site de synthèse d'ammoniac à un seul train ». La société installa un premier site à Texas City en . Quelques mois plus tard, elle en installa un deuxième à Luling, Louisiane, puis un troisième à Yazoo City, Mississippi. Ce fut le premier site capable de produire 1 000 tonnes courtes (environ 900 tonnes) d'ammoniac par jour. À la fin des années 1960, MWK avait installé 28 sites de ce type aux États-Unis, lesquels contribuaient pour moitié à la production américaine. Ce fut cette technologie qui fut implantée dans les 13 complexes commandés par la Chine en 1973[242].
D'autres firmes d'ingénieurs firent aussi d'importants efforts de recherche et développement dans ce domaine, dont la Britannique Imperial Chemical Industries, la Danoise Haldor Topsoe, l'Allemande Kruppe Uhde, la Japonaise Chiyoda Corporation et l'Indienne Kinetics Technology India. Pourtant, KBR, fusion de quelques sociétés américaines dont MWK, demeure au début du XXIe siècle la firme la plus importante dans ce domaine. En 1999, plus de 150 sites « MWK » étaient exploités dans 30 pays et contribuèrent pour plus de la moitié à l'augmentation de la capacité mondiale depuis le milieu des années 1960[243]. Par exemple, Esso Chemie, filiale d'Exxon, exploita de 1969 à 1973 (et probablement pendant les années subséquentes) un site de synthèse à Europoort aux Pays-Bas. Sur une seule chaîne de production, le site pouvait produire jusqu'à 1 350 tonnes par jour d'ammoniac liquide. L'hydrogène provenait des champs pétrolifères de la mer du Nord. Le site, hautement automatisé, pouvait fournir de l'acide nitrique, de l'urée et du nitrate d'ammonium[244].
L'adoption de la technologie MWK permit d'augmenter de façon notable la capacité des sites de synthèse. Par exemple, la taille modale des nouveaux sites mis en fonction passa de 200-400 tonnes d'ammoniac par jour au début des années 1960 à 800-1 000 tonnes par jour au début des années 1970, puis à 1 200-1 400 tonnes par jour dans les années 1980. En 2001, il existait plusieurs sites capables de fixer plus d'un million de tonnes d'ammoniac par année[245] :
- un complexe à Togliatti, Russie, pouvait fixer 2,46 Mt ;
- un autre à Veracruz, Mexique, 1,7 Mt ;
- un troisième à Donaldsonville, Louisiane, 1,55 Mt ;
- un autre à Point Lisas, Trinité-et-Tobago, 1,4 Mt.
Dans les années 1970, la société BASF, profitant des recherches sur le traitement des gaz par les amines, qui avaient commencé dans les années 1930, recourut à des amines pour réduire encore plus la présence de dioxyde de carbone dans le gaz de synthèse. Par la suite, elle améliora la technologie en profitant des caractéristiques de la N-Méthyldiéthanolamine activée (aMDEA). Dans les années 1990, elle adaptera sa technologie, avec succès, pour traiter le gaz naturel liquéfié[246]. Pendant les mêmes années, la société KBR développa une nouvelle technologie pour la synthèse de l'ammoniac. Elle fait appel à un nouveau catalyseur, du ruthénium sur un lit de graphite, ce qui permet d'exploiter les appareils à une pression d'environ 9 MPa[247]. Comparée aux procédés industriels équivalents en fonction, elle exigerait des contraintes mécaniques moindres et diminuerait le coût de production de l'ammoniac, tout en augmentant la production de 40 %[248],[249]. Cette technologie fut notamment mise en application à Point Lisas, Trinité-et-Tobago, en 1998[250].
Toutes les innovations apportées au procédé Haber-Bosch original permirent de réduire l'énergie nécessaire à la synthèse de l'ammoniac. En 2000, elle était au mieux de 26 GJ par tonne, alors qu'elle est théoriquement de 20,9 GJ. En 1962, elle était au mieux de 45 GJ par tonne et, pendant les premières années du site d'Oppau, elle était d'environ 100 GJ par tonne[251].
Même avec ces importants gains d'énergie, la synthèse des engrais azotés est plus coûteuse en énergie que la production des engrais phosphatés et des engrais potassiques. Par exemple, au milieu des années 1990, la synthèse de tous les engrais azotés exigeait environ 9 fois plus d'énergie que les deux autres ensemble. Malgré cette différence, elle n'est pas à risque, car la planète contient, par exemple, suffisamment de charbon pour répondre à la demande énergétique mondiale pendant plusieurs décennies, sinon plusieurs siècles (le coût de ces engrais serait plus élevé). Également, de meilleures techniques d'épandage et le remplacement des sites plus gourmands en énergie diminueraient ce coût énergétique[252].

Au XXIe siècle, toujours d'actualité
Pendant la guerre froide, le site de synthèse de Leuna fut remis en fonction par des Allemands de l'Est. Même s'il fut éteint en 1990[235], la ville de Leuna reste un important site chimique industriel au XXIe siècle[217],[254].

Toujours dans le même siècle, le catalyseur mis au point par Alwin Mittasch, à quelques modifications mineures près, est toujours en usage. Les réacteurs chimiques sont plus gros : du vivant de Carl Bosch, ils avaient une hauteur d'environ 9 mètres, au début du XXIe siècle ils ont atteint environ 30 mètres de haut. Dans certaines régions, la quantité d'engrais synthétisée est tellement élevée que le train ne suffit plus à le transporter, il a été remplacé par des pipelines[255].
En 1938, il fallait en moyenne 1 600 travailleurs pour fabriquer 1 000 tonnes d'ammoniac par jour. En 2001, il en fallait 55. La quantité d'énergie nécessaire pour produire une tonne d'engrais azoté a été divisée par quatre[255].
Pendant les années 1990, la synthèse de l'ammoniac était la deuxième plus importante par la masse, dépassée par celle de l'acide sulfurique. En 1998, 129 Mt de chaque composé furent synthétisés[256]. La quantité d'ammoniac synthétique continua d'augmenter depuis. Par exemple, elle fut de 133,5 Mt en 2003 et de 159 Mt en 2007[234]. La production mondiale en 2018 était de 175 millions de tonnes. La Chine produisit 28,5 % de cette quantité, suivie par la Russie avec 10,3 %, les États-Unis avec 9,1 % et l'Inde avec 6,7 %[257]. Dans les années 2010, de 3 à 5 % du gaz naturel produit annuellement dans le monde sert à la fabrication d'engrais azotés synthétiques[258].
En 2005, conséquence des attentats du 11 septembre 2001, les normes de sécurité touchant le nitrate d'ammonium furent resserrées aux États-Unis, car il peut servir à fabriquer des explosifs (l'ANFO, notamment). Ce changement incita plusieurs sociétés à délaisser cette production[149].
Gerhard Ertl reçut le prix Nobel de chimie de 2007 pour ses travaux sur la chimie des surfaces. Grâce à l'utilisation du microscope électronique, il parvint à « expliciter le mécanisme de synthèse de l'ammoniac à la surface d'un catalyseur à base de fer »[259].
Cette même année 2007, la production mondiale d'ammoniac synthétique atteignit 131 millions de tonnes (les années précédentes, la production était moins élevée)[234]. Comparativement à l'atmosphère terrestre, cette masse est négligeable[note 32].
En 2009, selon le PDG de BASF, sans les engrais azotés dérivés de l'ammoniac produit par le procédé Haber-Bosch, la moitié de la population mondiale mourrait de faim. Pourtant, en , la société BASF arrêta certains sites de synthèse d'ammoniac à la suite de la crise économique mondiale de 2008[260].
- Différents moyens de transport de l'ammoniac liquide
 Ce camion-citerne transporte de l'ammoniac anhydre. Photo prise le .
Ce camion-citerne transporte de l'ammoniac anhydre. Photo prise le . Wagon au Japon. Photographie prise le .
Wagon au Japon. Photographie prise le . Navire servant au transport à basse température de liquides : gaz de pétrole liquéfié, ammoniac ou chlorure de vinyle. Photographie prise le .
Navire servant au transport à basse température de liquides : gaz de pétrole liquéfié, ammoniac ou chlorure de vinyle. Photographie prise le .
L'utilisation à grande échelle des engrais azotés synthétiques provoque divers effets nocifs pour l'environnement[261]. Selon un rapport de l'ONU publié en 2007, l'application d'engrais serait l'un des facteurs qui provoque « la destruction des habitats de poissons, la pollution côtière et une prolifération néfaste d'algues »[262].
Au début du XXIe siècle, la quantité d'azote fixée de façon synthétique est équivalente à celle fixée par les bactéries nitrifiantes et les éclairs, ce qui a bouleversé le cycle de l'azote. La moitié de l'azote fixé synthétiquement n'est pas absorbé par les plantes, il se retrouve principalement dans l'eau sous forme de nitrates. Par exemple, la concentration de nitrates a quadruplé entre 1900 et 2000 dans le fleuve Mississippi aux États-Unis et a doublé dans le Rhin en Allemagne. Les impacts de cette concentration élevée sont étudiés, mais il y a peu de certitudes[263].

Les nitrates favorisent la croissance des algues et des herbes aquatiques de surface, lesquelles viennent à recouvrir, en partie ou en totalité, les eaux. Cela mène à une diminution importante de l'ensoleillement des eaux sous-marines. Ce manque de lumière provoque la mort des plantes sous-marines. Leur pourrissement diminue la quantité d'oxygène dissous, laquelle provoque à son tour la mort des êtres vivant dans le fond marin, par exemple les mollusques et les fruits de mer, qui ont besoin de cet oxygène pour vivre[264].
Dans les zones océaniques qui reçoivent les eaux provenant de différents fleuves charriant ces nitrates, le niveau d'oxygène est si bas que leur fond est tapissé de bactéries consommatrices d'oxygène, mortes. C'est le cas par exemple de la mer Baltique, de la mer Méditerranée, de la mer Noire et de la Grande Barrière de corail. Au large de la Louisiane en 2008, une telle zone morte s'étendait sur une superficie équivalente à celle du New Jersey, soit environ 22 000 km2. Le rôle exact des nitrates est inconnu, mais est important[265].
Le rôle de l'azote dispersé dans l'air est également peu connu en 2008. Il se répand sous forme de NO, de NO2 et autres NOx, lesquels participent à la pollution de l'air. Une partie de ces NOx proviennent de la combustion de combustible fossile, mais entre 15 et 50 % proviendrait des produits dérivés de l'ammoniac synthétique[266]. En , une étude publiée par le National Oceanic and Atmospheric Administration affirme que le protoxyde d'azote, qui se dégage entre autres des engrais azotés, est la première source de diminution de la couche d'ozone en 2009[267].
Selon un rapport publié par l'Organisation des Nations unies pour l'alimentation et l'agriculture en , la population mondiale sera de 9,1 milliards de personnes en 2050[268],[269],[diff 7]. Pour nourrir la population supplémentaire, il faudra par exemple augmenter la production céréalière mondiale d'environ 1 milliard de tonnes par an (en 2009, elle était d'environ 2,1 milliards de tonnes)[271]. En , un chercheur américain, s'appuyant sur une recherche publiée en 1972 (The Limits to Growth), avance que la productivité totale des plantes terrestres a atteint un plateau depuis quelques années, peu importe les efforts de l'Homme pour augmenter celle-ci[272],[273].
En 2019, la société EuroChem annonce la mise en route d'un complexe de synthèse d'ammoniac qui lui a coûté 1 milliard US$ et pouvant produire 1 million de tonnes d'ammoniac par année[274]. Elle utilise la technologie développée par la société KBR, qui déclare que le complexe est le plus grand qu'elle a jamais installé en Europe[275].
À moins d'un changement radical dans les conditions de production[note 33] ou d'une percée majeure en chimie industrielle[note 35],[note 36], il est fort probable que le procédé Haber-Bosch (et ses analogues) continuera à jouer un rôle de premier plan dans la sécurité alimentaire de la population humaine[276].
Notes et références
Citations originales
- (en) « One hundred atmospheres! Just yesterday an autoclave at seven atmospheres exploded on us! »
- (en) « I think it can work. I know exactly what the steel industry can do. We should risk it. »
- (en) « fixation of nitrogen from the air »
- (en) « too much honor cannot be shown to the courageous chemists who have succeeded in placing this process on commercial working basis »
- (en) « for their contributions to the invention and development of chemical high pressure methods »
- (en) « synthetic nitrate program »
- (en) « bringing their longtime enemy to its knees »
- (de) « Stickstoffsyndikat »
- (en) « giant iron worm »
- (en) « Council of the Gods »
- (de) « Dreibund »
- (de) « Gemeinshaft der Deutschen Teefarbenindustrie »
- (en) « sea of oil »
- (en) « radically new design »
Différences
- Selon Jeffreys 2008, p. 51, c'est plutôt 20 millions de tonnes.
- Selon Hager 2008, p. 138-139, les deux transformations étaient maîtrisées en Allemagne.
- Selon Smil 2001, p. 105, le montant du prêt était de 12 millions de marks, ce qui semble trop peu. En effet, le gouvernement allemand avait prêté six millions de marks à BASF pour qu'elle augmente la capacité de production du site d'Oppau, déjà fonctionnel. Par ailleurs, le futur site devait être rapidement construit, ce qui augmente fortement les coûts de construction. Finalement, dès sa mise en marche, il devait produire deux fois plus que celui d'Oppau.
- Selon Travis 1993, l'apport du procédé Haber-Bosch à l'effort de guerre allemand n'explique pas de façon certaine la prolongation de la guerre.
- Selon Smil 2001, p. 111, c'est plutôt 100 000 tonnes d'ammoniac par année, soit environ 270 tonnes par jour.
- Selon Jeffreys 2008, p. 101-102, Bosch négocia une fois avec Joseph Frossard et une autre fois avec des responsables français.
- Le démographe Hervé Le Bras doute cependant du modèle utilisé par l'ONU pour établir l'évolution de la population mondiale sur une aussi longue période : « or il ne faut pas oublier qu'en démographie, les arguments techniques s'insèrent inévitalement dans un champ idéologique »[270].
Notes
- En juillet 2013, des chercheurs publièrent un article où ils avancent que des humains avaient recours aux engrais d'origine animales pendant le Néolithique, voici 8 000 ans[19],[20].
- Par exemple, il reçut la médaille Davy en 1888[26] et la médaille Copley en 1904[27].
- Pour ses travaux sur la production d'azote fixé, Kristian Birkeland fut mis en nomination pour un prix Nobel de chimie à trois reprises, mais ne le reçut jamais : voir (en) Anonymes, « Three Remarkable Men », Yara, [au plus tard en mars 2009] (consulté le ).
- Il s'agit probablement du nom officiel du procédé Schönherr.
- En 2000, 0,7 % de la production mondiale n'était pas issue du procédé Haber-Bosch et de ses analogues[53].
- Dans les manuels modernes de chimie, les auteurs expliquent les choix de Haber en s'appuyant sur le principe de Le Chatelier. Cependant, au début du XXe siècle, Haber ignorait ce principe (voir par exemple Haber 1920, p. 339).
- Avec l'équipement à sa disposition, Haber pouvait obtenir au maximum 20 MPa[44].
- Dans le discours prononcé par Fritz Haber lors de la remise de son prix Nobel de chimie, le texte mentionne « catalysts », même s'il est plus probable que la synthèse s'effectuait à l'aide d'un seul catalyseur à la fois (voir Haber 1920, p. 337, pour plus de détails)
- Dans la littérature sur les procédés chimiques à haute température, le terme « fourneau » (furnace en anglais) peut remplacer le terme « réacteur chimique ».
- Haber et Le Rossignol mirent au point d'autres appareils. Une photographie apparait dans (en) (Fil de discussion), « Ammonia by the haber process--tabletop chemistry », The art and science of amateur experimentalism, (consulté le ). Une photographie en couleur apparaît dans (es) JMG, « Haber », Triplenlace, (consulté le )
- Certains auteurs inscrivent la masse d'ammoniac. Il suffit d'effectuer la conversion nécessaire. Par exemple, dans Smil 2001, p. 81, l'auteur mentionne 80 g de NH3 à l'heure, ce qui donne 160 g aux deux heures. À 0 °C et 101,3 kPa, l'ammoniac liquide a une densité de 0,638 6 g/cm3.
- Ce retard fut causé par les bouleversements provoqués par la Première Guerre mondiale, ainsi que par un décès dans la famille royale de Suède[80].
- En 2001, le coût de production de l'ammoniac dépendait toujours du prix du gaz naturel, principale source de dihydrogène du procédé : voir par exemple
- (en) John E. Sawyer, « Natural gas prices affect nitrogen fertilizer costs », Integrated Crop Management, (lire en ligne, consulté le ) et
- (en) Tim Treadgold, « Smelling Salts », Forbes, (lire en ligne, consulté le )
- Les employés de BASF qui travaillaient à développer ces appareils les appelaient « fours » (« oven » en anglais, « Ofen » en allemand) (voir Hager 2008, p. 111).
- À l'époque, la American Cyanamid Company synthétisait un produit concurrent de l'ammoniac, le cyanamide calcique.
- En 1915, BASF avait établi une station expérimentale agricole, ainsi qu'un laboratoire pour étudier les processus biologiques, notamment ceux liés à l'azote[44].
- Les autorités françaises étaient, peut-être, en partie animées par du revanchisme à l'égard de l'Allemagne de Guillaume II, roi de Prusse. Par exemple, dans les années 1870, la France avait versé cinq milliards de francs-or à la Prusse après avoir perdu la guerre franco-allemande de 1870.
- Il s'agit de Joseph Frossard[138].
- La limitation imposée à BASF découlait probablement de l'aide financière consentie par le gouvernement allemand lors de la construction des sites d'Oppau et de Leuna.
- Le procédé fut breveté en 1922 aux États-Unis[144].
- À titre de comparaison, l'ammoniac anhydre, celui directement synthétisé par le procédé Haber-Bosch, est un gaz « d'odeur acre » à la température de la pièce[147].
- Depuis 2005, cette propriété de non-détonation a rendu l'urée plus attrayante auprès des producteurs d'engrais azotés. En effet, les attentats du 11 septembre 2001 incitèrent le gouvernement fédéral américain à resserrer les normes de manipulation des engrais azotés présentant des propriétés détonantes, dont le nitrate d'ammonium, composé chimique servant notamment à fabriquer de l'ANFO[149].
- Son procédé fit l'objet d'un article paru dans Nature en 1921[164]. En 1924, Georges Claude obtint un brevet américain intitulé Synthesis of Ammonia[165]. En 1926, il obtint un brevet canadien intitulé Procédé de synthèse directe de l'ammoniaque[166].
- Ce désir de fusion trouvait probablement son origine dans l'existence de deux associations réalisées auparavant par des sociétés chimiques allemandes. En octobre 1904, BASF, Bayer et Agfa avait formé la « Triple-Alliance[trad 11] »[175]. Également, en août 1916, BASF, Bayer, Agfa, Hoechst et d'autres sociétés unirent une partie de leurs activités dans la « Groupement d'intérêt de l'industrie allemande des teintures[trad 12] »[119].
- Selon Smil 2001, p. 107, Beike a écrit 100 millions de dollars américains de 1919. Le taux de change retenu est de 1 USD pour 8,2 Papiermarks[179].
- Aux États-Unis, l'unité de mesure de l'essence est le gallon.
- Il s'agit probablement du troisième site de synthèse de caoutchouc que construisit IG Farben en 1944 (voir Smil 2001, p. 225), lequel était situé à Monowitz-Buna.
- Cette variété de maïs était le premier cultivar à haut rendement qui dépendait d'une application plus intensive d'engrais azotés[222].
- Il s'agit de pays situés en Amérique du Nord et en Europe, ainsi que le Japon.
- Ce procédé était connu depuis le début du XXe siècle (voir par exemple (en) INIST, « Syngas production from South African coal sources using Sasol-Lurgi gasifiers », CAT.INIST, (consulté le )).
- Dans les années 1960, la M. W. Kellogg Company mit au point une technologie plus performante de synthèse. Ce fut cette technologie que retinrent les autorités chinoises[229]. À quantité égale d'ammoniac synthétisé, ces appareils prennent notablement moins de place que ceux, par exemple, installés à Leuna. Il est donc possible d'installer plusieurs sites au même endroit, d'où le terme « complexe ».
- Dans une molécule d'ammoniac, l'azote représente environ 83 % de la masse totale. Donc, en 2007, la masse d'azote fixé valait 83 % de 131 millions de tonnes, soit 108,7 millions de tonnes, ou encore 108,7 × 109 kg. Par rapport à l'atmosphère, cette masse d'azote fixé représente : (108,7 × 109) ÷ (4 × 1018) ≈ 27 × 10−9, soit 27 ppb.
- Par exemple, il pourrait s'agir d'un resserrement au niveau des normes environnementales.
- MMBTU(LHV)/ST signifie (en) million BTU of low heating value fuel per short ton, que l'on peut traduire par « million de BTU de combustible à pouvoir calorifique inférieur par tonne courte ».
-
Selon Considine et Kulik 2002, p. 142-143, le but ultime de la production d'ammoniac sera la conversion du diazote atmosphérique et de l'eau selon l'équation chimique :
- 6 H2O + 2 N2 ⇌ 4 NH3 + 3 O2
- N2(g) + 3 H2(g) ⇌ 2 NH3(g)
- Lawrence 2006 spécule que les avancées en biotechnologie pourraient un jour mener à un nouveau procédé de fixation de l'azote.
Références
- (en) Richard R. Schrock, « Nitrogen Fix », Technology Review, Massachusetts Institute of Technology, (lire en ligne, consulté le )
- Smil 2001, p. xiii
- Jeffreys 2008, p. 51
- Bensaude-Vincent et Stengers 2001, p. 223-226
- Hager 2008, p. 38, 137-140 et 142-143
- (en) David R. Williams, « Earth Fact Sheet », NASA, (consulté le )
- L'atmosphère terrestre pèse 5,1 × 1018 kg et l'azote constitue 78,08 % de celle-ci par la masse[6]. Cette masse est donc de 78,08 % × 5,1 × 1018 kg, soit environ 4 × 1018 kg.
- Smil 2001, p. 61-82
- Hager 2008, p. 63-108
- Smil 2001, p. 83-107
- Bosch 1931
- Hager 2008, p. 272-277
- Smil 2001, p. 177-198
- Hager 2008, p. 168
- Smil 2001, p. xv
- Hager 2008, p. xiii-xiv
- (en) Robert C. Weast (dir.), Melvin J. Astle (dir.) et William H. Beyer (dir.), CRC Handbook of Chemistry and Physics, 64th Edition, Boca Raton, Floride, CRC Press, Inc., (ISBN 0-8493-0464-4), B-23
- Hager 2008, p. xi
- (en) Michael Balter, « Researchers Discover First Use of Fertilizer », ScienceNOW, (lire en ligne, consulté le )
- (en) Amy Bogaard, Rebecca Fraser, Tim H. E. Heaton, Michael Wallace, Petra Vaiglova, Michael Charles, Glynis Jones, Richard P. Evershed, Amy K. Styring, Niels H. Andersen, Rose-Marie Arbogast, László Bartosiewicz, Armelle Gardeisen, Marie Kanstrup et al., « Crop manuring and intensive land management by Europe’s first farmers », PNAS, (DOI 10.1073/pnas.1305918110, présentation en ligne)
- Hager 2008, p. 31-34
- Smil 2001, p. 42
- Hager 2008, p. 38-43
- (en) Deborah A. Kramer, « Nitrogen (Fixed)—Ammonia », U.S. Geologicial Survey, , p. 119 (lire en ligne, consulté le ) :
« Mineralized occurrences of sodium and potassium nitrates, found in the Atacama Desert of Chile, contribute minimally to global nitrogen supply. »
- (en) Deborah A. Kramer, « Nitrogen (Fixed)—Ammonia », U.S. Geologicial Survey, , p. 117 (lire en ligne [PDF], consulté le ) :
« Mineralized occurrences of sodium and potassium nitrates, found in the Atacama Desert of Chile, contribute minimally to global nitrogen supply. »
- (en) The Royal Society, « Davy archive winners 1899 - 1877 », The Royal Society, (consulté le )
- (en) The Royal Society, « Copley archive winners 1989 - 1900 », The Royal Society, (consulté le )
- Hager 2008, p. 3-4
- (en) Today in Science History, « Sir William Crookes Quotes - Dictionary of Science Quotations and Scientist Quotes », Today in Science History, (consulté le ) ; l'allocution de Crookes fut publiée dans Chemical News, 1898, vol. 78, no 125.
- (en) James Laylin (dir.), 1918 Nobel Laureate. Fritz Haber 1868-1934, Nobel Laureates in Chemistry, 1901-1902, États-Unis, American Chemical Society et Chemical Heritage Foundation, (ISBN 0-8412-2690-3), p. 118
- Auger et Grmek 1969, p. 434.
- Smil 2001, p. 62
- Haber 1920, p. 328-329
- Smil 2001, p. 240, Appendix F (quantités de guano et de salpêtre du Chili combinées)
- Wisniak 2002, p. 161.
- Luc Bachand, Guy Petit et Philippe Vanier, Chimie 534, Montréal, Lidec, , 444 p. (ISBN 2-7608-3587-1), p. 315Il s'agit d'un manuel destiné aux élèves effectuant leur dernière année au niveau secondaire au Québec et désirant suivre une filière scientifique.
- Smil 2001, p. 48
- Hager 2008, p. 52
- (en) Historical Atlas, « Population of Germany », Historical Atlas, (consulté le )
- Jacques Binoche, Histoire des États-Unis, Ellipses Marketing, , 256 p. (ISBN 978-2-7298-1451-9)
- Smil 2001, p. 51-52
- (en) (Anonyme), « Rich harvest, healthy environment. Calcium cyanamide », Degussa Geschichte (consulté le )
- Hager 2008, p. 76-78, 94-96
- Travis 1993
- Wisniak 2002, p. 163
- David V., « Bradley & Lovejoy », Delcourt, (consulté le )
- Smil 2001, p. 53
- Nicolas Witkowski, « Kristian Birkeland, prophète électromagnétique », La Recherche, [au plus tôt en octobre 2002] (consulté le )
- « Yara - Historique », Yara, (consulté le )
- Smil 2001, p. 54-55
- Wiley-VCH 2007, p. 154
- (en) Alexander Smith, Intermediate Text Book of Chemistry, États-Unis, , 536 p. (ISBN 978-1-4086-2480-7, lire en ligne), p. 320
- Smil 2001, p. 245 (voir Appendix L)
- (en) Eduard Faber, Great Chemists, New York, Interscience Publishers, , p. 1305
- Haber 1920, p. 335
- Smil 2001, p. 68-74
- Haber 1920, p. 336
- Haber 1920, p. 337
- Hager 2008, p. 81, 91
- Haber 1920, p. 337-338
- Smil 2001, p. 79
- Smil 2001, p. 78-79
- (en) Jayant M. Modak, « Haber Process for Ammonia Synthesis », Resonance, (lire en ligne [PDF], consulté le )
- Haber 1920, p. 333-335
- Hager 2008, p. 91
- Hager 2008, p. 92
- Smil 2001, p. 79, diagramme 4.7
- BASF avait déposé une demande de brevet en Allemagne en 1908 : voir Brevet DE 235 421 Verfahren zur synthetischen Darstellung von Ammoniak aus den Elementen, demandé le 13 octobre 1908, délivré le 8 juin 1911
- (en) Fondation Nobel, « Carl Bosch - Biography », Fondation Nobel, (consulté le )
- Hager 2008, p. 92-93.
- Hager 2008, p. 93.
- Bosch avait effectué des expériences avec des cyanures métalliques et des nitrures métalliques. En 1907, il avait lancé un site expérimental de production de cyanure de baryum[69].
- Hager 2008, p. 93-97
- Hager 2008, p. 97
- Hager 2008, p. 99
- Hager 2008, p. 88
- Bosch 1931, p. 197
- Voir par exemple Arkan Simaan, « Le Paradoxe de la science : Fritz Haber », Arkan Simaan, (consulté le )
- Smil 2001, p. 78
- Bensaude-Vincent 2008, p. 66
- (en) Fondation Nobel, « Fritz Haber - Biography », Fondation Nobel, (consulté le )
- Smil 2001, p. 226
- Hager 2008, p. 165-166
- Bensaude-Vincent 2008, p. 70
- Hager 2008, p. 82-86
- Smil 2001, p. 224
- Bosch 1931, p. 198
- Smil 2001, p. 97
- (en) Nexant, « Ammonia Process Overview », Nexant, Inc., (consulté le )
- Hager 2008, p. 105
- Hager 2008, p. 101, 105-108
- Hager 2008, p. 111
- Hager 2008, p. 107
- Bosch 1931, p. 199
- (en) La Nature, « The New Krupp Guns », Scientific American Supplement, vol. XXIII, no 598, , Fig. 1 (lire en ligne)
- Hager 2008, p. 116
- Bosch 1931, p. 200, 203-204 et 206-207
- Bosch 1931, p. 208
- Hager 2008, p. 120-121
- Bosch 1931, p. 208-209
- Bosch 1931, p. 211
- Hager 2008, p. 115.
- Bosch 1931, p. 221-222
- Bosch 1931, p. 222
- Hager 2008, p. 129
- Michel Rival, Les Apprentis Sorciers : Haber, Von Braun, Teller, Seuil, , 234 p. (ISBN 978-2-02-021515-2), p. 44
- Hager 2008, p. 131
- Smil 2001, p. 87
- Hager 2008, p. 96-98
- Hager 2008, p. 105-108
- Hager 2008, p. 119-120
- Smil 2001, p. 202
- Hager 2008, p. 141-142
- Éric Brown, Des chimistes de A à Z, Paris, Ellipses, , 400 p. (ISBN 2-7298-0932-5), p. 144-145
- Hager 2008, p. 136
- Hager 2008, p. 138-139, 142-143
- Smil 2001, p. 104
- Jeffreys 2008, p. 66 et 74
- Jeffreys 2008, p. 74
- Hager 2008, p. 142-143
- Hager 2008, p. 144-145
- Smil 2001, p. 105
- Bosch 1931, p. 224
- Hager 2008, p. 166-167
- Hager 2008, p. 218
- Hager 2008, p. 167-168
- Lawrence 2006
- Smil 2001, p. 103-104
- Hager 2008, p. 140
- Hager 2008, p. 175
- Hager 2008, p. 171-172
- Hager 2008, p. 172-173
- Hager 2008, p. 173
- Hager 2008, p. 174
- (en) Imanuel Geiss, The Question of German Unification, 1806-1996, Routledge, , 176 p. (ISBN 978-0-415-15049-1), p. 160
- Hager 2008, p. 176
- Hager 2008, p. 175-177
- Jeffreys 2008, p. 101
- Hager 2008, p. 177-178
- Hager 2008, p. 178-179
- Hager 2008, p. 178-180
- (en) Claudia Riani (étudiante au doctorat), « Cartel vs Monopoly : The German nitrogen industry in the interwar years », Dept of History and Civilization, European University Institute, Florence, (consulté le ), p. 13
- (en) Alan E. Comyns, Encyclopedic Dictionary of Named Processes in Chemical Technology, Boca Raton (Fla.), CRC Press LLC, , 440 p. (ISBN 978-0-8493-9163-7, lire en ligne), p. 49
- (en) Brevet US 1429483 Process of manufacturing urea, demandé le 9 juillet 1920, délivré le 19 septembre 1922
- Smil 2001, p. 136
- (en) Egon Wiberg (dir.), Nils Wiberg (dir.) et Arnold Frederick Holleman (dir.), Inorganic Chemistry, Academic Press, , 101e éd., 615 p. (ISBN 978-0-12-352651-9, lire en ligne)
- PISSC, CCE, « Ammoniac (anhydre) », Fiches internationales de sécurité chimique, (consulté le )
- PISSC, CCE, « Urée », Fiches internationales de sécurité chimique, (consulté le )
- (en) Deborah A. Kramer, « Nitrogen (fixed) - Ammonia », Mineral Commodity Summaries, U.S. Geological Survey, (lire en ligne [PDF], consulté le )
- Smil 2001, p. 138
- Smil 2001, p. 137
- Hager 2008, p. 195
- Hager 2008, p. 218-219
- (en) Nature, « The Oppau Explosion : Abstract : Nature », Nature, (lire en ligne, consulté le )
- (en) Associated Press, « New Gas Caused Oppau Explosion », The New York Times, (lire en ligne, consulté le )
- Hager 2008, p. 200-201
- Hager 2008, p. 205-206
- Hager 2008, p. 206-207
- Smil 2001, p. 242 (voir Appendix I)
- (en) « A Brief Profile of Giacomo Fauser », (consulté le )
- Auger et Grmek 1969, p. 435.
- (en) rnz IFSU, « Casale's Most Recent Technologies for Grass-Roots Fertilizer Plants », Indian Fertilizer Situation Update, vol. 10, no 01, , p. 3 (lire en ligne [PDF], consulté le )
- Haber 1920, p. 338
- (en) SAO/NASA, « The Claude Process for Ammonia Synthesis », SAO/NASA ADS, (consulté le )
- (en) Brevet US 1501436 Synthesis of Ammonia, demandé le 12 mars 1921, délivré le 15 juillet 1924
- « OPIC - Brevet - 257493 », Office de la propriété intellectuelle du Canada, (consulté le )
- (en) American Institute of Chemical Engineers, « Ammonia Safety Symposium: A Half Century of Progress », CBS Interactive Inc., (consulté le )
- Smil 2001, p. 114
- Maxwell 2004, p. 12-13
- (en) John E. Lesch, The German Chemical Industry in the Twentieth Century, Springer, , 472 p. (ISBN 978-0-7923-6487-0, lire en ligne), p. 173
- (de) Brevet DE 415 686 Ausfuehrung organischer Katalysen, par Alwin Mittasch, Mathias Pier et Karl Winkler, demandé le 24 juillet 1923, délivré le 27 juin 1925
- (en) Brevet US 1569775 Synthetic Manufacture of Methanol of Ammonia, par Alwin Mittasch et Mathias Pier, demandé le 4 septembre 1924, délivré le 12 janvier 1926
- Hager 2008, p. 207
- Smil 2001, p. 113
- (en) John Joseph Beer, The Emergence of the German Dye Industry, Manchester, New Hampshire, États-Unis, Ayer Company Publishers, , 168 p. (ISBN 0-405-13835-0)
- Hager 2008, p. 211-212
- Jeffreys 2008, p. 118-122
- (de) Helmuth Tammen, Die I.G. Farbenindustrie Aktiengesellschaft (1925-1933) : Ein Chemiekonzern in der Weimarer Republik, Berlin, H. Tammen, (ISBN 3-88344-001-9)
- (en) School History, « German Economy 1919-1923 », Schoolshistory.org.uk, (consulté le )
- Hayes 2001, p. 10.
- Jeffreys 2008, p. 136
- Hager 2008, p. 212-213
- Hager 2008, p. 226-227, 231
- Hager 2008, p. 229-230
- Jeffreys 2008, p. 153
- Hager 2008, p. 227-228
- Bosch 1931, p. 240
- Hager 2008, p. 233-235
- Hager 2008, p. 244-245
- Hager 2008, p. 260
- (en) Bruce Ramsey, « Hell's Cartel": The German chemical industry's deal with the devil », The Seattle Times, (lire en ligne, consulté le )
- (en) Macmillan Academic, « Hell's Cartel : IG Farben and the Making of Hitler's War Machine », Macmillan Academic Marketing, (consulté le )
- (en) Jack Ewing, « IG Farben and Hitler: A Fateful Chemistry », BusinessWeek, (lire en ligne, consulté le )
- Hager 2008, p. 262-263
- Jeffreys 2008, p. 217 et 249
- Jeffreys 2008, p. 210-213
- Jeffreys 2008, p. 216
- Smil 2001, p. 117-118
- Jean Trogoff, Les Grandes Dates de la guerre sur mer - 1939-1945, Ouest-France, (ISBN 978-2-7373-1395-0)
- Smil 2001, p. 115-116
- Hager 2008, p. 265
- Jeffreys 2008, p. 75
- Jeffreys 2008, p. 334
- Hager 2008, p. 265-266
- Hager 2008, p. 265-267
- Jeffreys 2008, p. 331-332
- Hager 2008, p. 267
- Par exemple, sur un contingent de 700 bombardiers qui survola Leuna le 2 novembre 1944, plus de 300 furent détruits et la plupart des 400 autres furent endommagés[207].
- Hager 2008, p. 265-268
- Hager 2008, p. 268
- Wiley-VCH 2007, p. 155
- (en) Peter Scholliers (dir.), Leen Van Molle (dir.), Carmen Sarasua (dir.) et Vaclav Smil, Land, shops and kitchens : technology and the food chain in twentieth-century Europe, Turnhout, Brepols Publishers, , 300 p. (ISBN 978-2-503-51780-3, lire en ligne [PDF]), p. 110-119
- (de) Leonid Andrussow, « Über die schnell verlaufenden katalytischen Prozesse in strömenden Gasen und die Ammoniak-Oxydation (V) », Berichte der deutschen chemischen Gesellschaft, vol. 60, no 8, , p. 2005-2018 (DOI 10.1002/cber.19270600857)
- (de) L. Andrussow, « Über die katalytische Oxydation von Ammoniak-Methan-Gemischen zu Blausäure », Angewandte Chemie, vol. 48, no 37, , p. 593-595 (DOI 10.1002/ange.19350483702)
- Brevet US 1,934,838 : Production of hydrocyanic acid, demandé le 6 avril 1931, délivré le 14 novembre 1933
- Hervé Joly, « L’implication de l’industrie chimique allemande dans la Shoah : le cas du Zyklon B », HAL-SHS, (lire en ligne [PDF], consulté le )
- Hager 2008, p. 281
- Serge Bernstein (dir.) et Pierre Milza (dir.), Histoire du XXe siècle, vol. 2 : 1945-1973, le monde entre guerre et paix, Hatier, (ISBN 2-218-71565-1)
- (en) « President Harry S. Truman's Address Before a Joint Session of Congress, March 12, 1947 », Lillian Goldman Law Library, (consulté le )
- (en) Walter Lippmann, The Cold War : A Study in U.S. foreign policy, Harper & Brothers, , 62 p.
- (en) William Whitney Stueck (dir.), The Korean War in World History, Lexington, Kentucky, University Press of Kentucky, , 216 p. (ISBN 978-0-8131-2306-6, lire en ligne)
- Smil 2001, p. 116
- Maxwell 2004, p. 16
- John Fairbank, La Grande Révolution chinoise, 1800-1989, Paris, Flammarion, coll. « Histoires », , 546 p. (ISBN 978-2-08-081380-0)
- Hager 2008, p. 269-270
- Smil 2001, p. 117
- Smil 2001, p. 244
- (en) (Anonyme), « Richard M. Nixon », The Office of Electronic Information, Bureau of Public Affairs, (consulté le )
- Smil 2001, p. 123-124
- Hager 2008, p. 270
- (en) Justin Gillis, « Norman Borlaug, Plant Scientist Who Fought Famine, Dies at 95 », The New York Times, (lire en ligne, consulté le )
- Gilbert Charles, « Révolution verte à refaire », L'Express, (lire en ligne, consulté le )
- Smil 2001, p. 116-117
- (en) C. A. DiFrancesco, D. A. Kramer et L. E. Apodaca, Nitrogen (Fixed)—Ammonia Statistics, USGS, (Le document de 2008 n'est plus en ligne, mais ce fichier au format XLSX comprend sensiblement les mêmes données.)
- Smil 2001, p. 122
- Considine et Kulik 2002, p. 140
- (en) (Anonyme), « Whittle and the Birth of the Jet », The Sir Frank Whittle Commemorative Trust, (consulté le )
- (en) Air Force Historical Studies Office Bolling AFB DC, Jacob Neufeld, George M. Watson, Jr. et David Chenoweth, Technology and the Air Force : A Retrospective Assessment, University Press of the Pacific, , 343 p. (ISBN 978-1-4102-0185-0, lire en ligne), p. 7
- Smil 2001, p. 123
- Smil 2001, p. 122-123
- Smil 2001, p. 120
- Smil 2001, p. 124
- Smil 2001, p. 124-125, 127
- Jones et al. 1973, p. 149-150
- Smil 2001, p. 125
- (en) « Amines washing machine », BASF, (consulté le )
- (en) KBR, « KBR Advanced Ammonia Process (KAAP™) », KBR, Inc., (consulté le )
- (en) World of Invention, « Ammonia Synthesis », Thomson Gale, (consulté le )
- Maxwell 2004, p. 179
- Smil 2001, p. 128
- Smil 2001, p. 128 et 244
- Smil 2001, p. 131-132
- Smil 2001, p. 244 (voir Appendix K)
- (en) InfraLeuna, « A Chronicle of the History of Leuna », InfraLeuna, (consulté le )
- Hager 2008, p. 271
- Smil 2001, p. 125-127
- (en) « Nitrogen (Fixed)—Ammonia », dans Mineral Commodity Summaries 2020, USGS, (lire en ligne [PDF]), p. 117
- (en) Anne Marie Helmenstine, « Haber Process or Haber-Bosch Process », ThoughtCo,
- La Recherche, « 2007 Gerhard Ertl, prix Nobel de chimie », La Recherche, no 423, , p. 86 (ISSN 0029-5671)
- (en) Alexander Neubacher, « A German Industrial Giant Runs into Trouble », Spiegel Online, (lire en ligne, consulté le )
- Environnement Canada, « La pollution par les nitrates : une menace invisible qui pèse sur les populations d'amphibiens », Environnement Canada, (consulté le )
- PNUE, « L'avenir de envrionnement mondial 3 - GEO-3 », Programme des Nations unies pour l'environnement, (consulté le )
- Hager 2008, p. 272-274
- Hager 2008, p. 274
- Hager 2008, p. 274-275
- Hager 2008, p. 275
- Lisa Grossman, « Laughing gas is biggest threat to ozone layer », New Scientist, (lire en ligne, consulté le )
- (en) (Collectif), « Feeding the world », The Economist, (lire en ligne, consulté le )
- (en) FAO, How to Feed the World in 2050, Food and Agriculture Organization, (lire en ligne [PDF])
- Hervé Le Bras, « 69 millions d'habitants au Niger en 2050 ? », La Recherche, nos 501-502, , p. 121
- ContreInfo, « La production alimentaire devra augmenter de 70 % d’ici à 2050, selon la FAO », ContreInfo, (lire en ligne, consulté le )
- (en) Sophia Li, « Has Plant Life Reached Its Limits? », The New York Times, (consulté le )
- (en) Steven A. Running, « A Measurable Planetary Boundary for the Biosphere », Science, vol. 337, no 6101, , p. 1458-1459 (DOI 10.1126/science.1227620, lire en ligne, consulté le )
- (en) « EuroChem Northwest », EuroChem,
- (en) « Europe's Largest Single-Train Ammonia Plant Successfully Started Up with KBR Technology », KBR,
- Hager 2008, p. 25-61
Annexes
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- Pierre Auger (dir.) et Mirko D. Grmek (dir.), Encyclopédie internationale des sciences et des techniques, Vérone, Italie, Presses de la Cité, , 840 p.

- Bernadette Bensaude-Vincent, « Fritz Haber : un criminel de guerre récompensé », La Recherche, no 423, , p. 66-70 (ISSN 0029-5671).

- Bernadette Bensaude-Vincent et Isabelle Stengers, Histoire de la chimie, Paris, La Découverte/Poche, coll. « Sciences humaines et sociales », , 364 p. (ISBN 2-7071-3541-0).

- (en) Carl Bosch, The Development of the Chemical High Pressure Method During the Establishment of the New Ammonia Industry : Nobel Lecture, May 21, 1932, Oslo, Suède, Fondation Nobel, , 45 p. (lire en ligne [PDF]).

- (en) Glenn D. Considine (dir.) et Peter H. Kulik (dir.), Ammonia, Van Nostrand's Scientific Encyclopedia, Ninth Edition, Canada, John Wiley & Sons, inc., , 3898 p. (ISBN 0-471-33230-5), p. 140-143.

- (en) Fritz Haber, The Synthesis of Ammonia From its Elements : Nobel Lecture, June 2, 1920, Oslo, Suède, Fondation Nobel, , 15 p. (lire en ligne [PDF]).

- (en) Thomas Hager, The Alchemy of Air : A Jewish Genius, a Doomed Tycoon, and the Scientific Discovery That Fed the World but Fueled the Rise of Hitler, New York, Harmony Books, , 336 p. (ISBN 978-0-307-35178-4).

- (en) Peter Hayes, Industry and Ideology : IG Farben in the nazi era, New York, Cambridge University Press, (1re éd. 1971), 411 p. (ISBN 978-0-521-78638-6, présentation en ligne).

- (en) Diarmuid Jeffreys, Hell's Cartel : IG Farben and the Making of Hitler's War Machine, Metropolitan Books, , 496 p. (ISBN 978-0-8050-7813-8).

- (en) K. Jones, J. C. Bailar (dir.), H. J. Emeléus (dir.), Sir Ronald Sydney Nyholm (dir.) et A. F. Trotman-Dickenson (dir.), Nitrogen, Comprehensive Inorganic Chemistry, New York, Pergamon Press, , 547 p. (ISBN 0-08-017275-X).

- (en) Stephen A. Lawrence, Amines. Synthesis, Properties and Applications, Cambridge University Press, , 384 p. (ISBN 978-0-521-02972-8, présentation en ligne), « An Introduction to the Amines ».

- (en) Gary R. Maxwell, Synthetic Nitrogen Products : A Practical Guide to the Products and Processes, Springer, , 388 p. (ISBN 978-0-306-48225-0, présentation en ligne).

- (en) Vaclav Smil, Enriching the Earth : Fritz Haber, Carl Bosch, and the Transformation of World Food Production, MIT Press, , 358 p. (ISBN 978-0-262-69313-4, présentation en ligne).

- (en) Anthony S. Travis (dir.), Harm G. Schröter (dir.), Ernst Homburg (dir.) et Peter J. T. Morris (dir.), Determinants in the Evolution of the European Chemical Industry, 1900-1939 : New Technologies, Political Frameworks, Markets and Companies (Chemists and Chemistry), Springer, , 300 p. (ISBN 978-0-7923-4890-0, présentation en ligne)Un ouvrage sur l'évolution technologique de l'industrie chimique européenne de 1900 à 1939.
- (en) Tony Travis, « The Haber-Bosch process: exemplar of 20th century chemical industry », Entrepreneur, Society of Chemical Industry, (lire en ligne, consulté le ).

- (en) Wiley-VCH (dir.), Ullmann's Agrochemicals, États-Unis, Wiley-VCH, , 932 p. (ISBN 978-3-527-31604-5, lire en ligne).

- (en) Jaime Wisniak, « Fritz Haber - a Conflicting Chemist », Indian Journal of History of Science, vol. 37, no 2, , p. 153-173 (ISSN 0019-5235, lire en ligne [PDF]).

Articles connexes
Liens externes
- (en) Chemical Heritage Foundation, « Fritz Haber », Chemical Heritage Foundation, (courte biographie de Fritz Haber accompagnée de deux photographies, dont l'une montrant l'un de ses prototypes de laboratoire)
- Portail de la production industrielle
- Portail de la chimie



