Hydyne
MAF-4, U-DETA
| Hydyne MAF-4 U-DETA | |
| Carburant liquide | |
|---|---|
 |
|
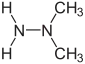 Formule développée plane des constituants de l’Hydyne (1,1-diméthylhydrazine et diéthylènetriamine). 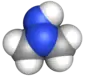 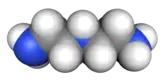 Représentation 3D de type surface de van der Waals (en) de la 1,1-diméthylhydrazine et de la diéthylènetriamine. | |
| Identité | |
| Créateur | Mary Sherman Morgan |
| Date de création | 1956 |
| Utilisé sur | |
| Identification | |
| Synonymes |
Hydine, U-DETA, Mixed amine fuel No. 4, MAF-4, Bagel |
| Apparence | Liquide clair et incolore à l’odeur ammoniacale[1] |
| Propriétés physiques | |
| T° fusion | −84,4 °C[2] |
| T° ébullition | 69,6 °C[3] |
| Masse volumique | 0,845 9 g cm−3[4] |
| T° d'auto-inflammation | 279 °C[5] |
| Point d’éclair | 7,8 °C[5] |
| Limites d’explosivité dans l’air | 2 (LIE) à 90 %vol. à temp. ambiante[5] |
| Pression de vapeur saturante | à 24,85 °C : 15,732 kPa[3] |
| Viscosité dynamique | 1,4 cP[5] |
| Point critique | 285 °C, 53,3 atm[6] |
| Thermochimie | |
| ΔfH0liquide | 51,455 cal/g à 24,85 °C |
| Cp | 0,65 cal g−1 K−1[7] |
| Propriétés optiques | |
| Indice de réfraction | à 24,85 °C : 1,438[8] |
| Précautions | |
| SGH | |
     |
|
| SIMDUT | |
   B2, D1A, D2A, E, |
|
| Unités du SI et CNTP, sauf indication contraire. | |
L'Hydyne, ou Hydine (prononcé en anglais /ˈhaɪdaɪn/), originellement Bagel, est un mélange massique de 60 % de 1,1-diméthylhydrazine (UDMH[alpha 1]) et 40 % de diéthylènetriamine (DETA).
Ergol jusqu'à la fin des années 1950, il était utilisé comme carburant spécifiquement pour les fusées de la série Redstone, en particulier pour les fusées Jupiter-A, Jupiter-C et Juno I et le drone cible Beechcraft AQM-37 Jayhawk. L'oxygène liquide est utilisé comme oxydant, excepté sur le drone cible utilisant de l'IRNFA. North American Aviation a chargé Mary Sherman Morgan de concevoir l'Hydyne afin d'améliorer les performances du lanceur américain Juno I, qui mettra en orbite le premier satellite américain Explorer 1. Sa toxicité et son effet corrosif seront ses inconvénients, ce qui le mettra hors service pour éviter tous risques lors des vols habités du programme Mercury utilisant également les fusées Redstone. Il a cependant continué à asservir le drone cible, jusqu'à sa retraite. L'avion supersonique à moteur-fusée Bell X-1 a également essayé l'Hydyne.
L'Hydyne est une substance hygroscopique, claire à température ambiante, et incolore, dégageant une odeur ammoniacale, miscible en toute proportion à l'eau et à d'autres substances. Les propriétés de l'Hydyne sont semblables à celles de l'UDMH.
L'Hydyne fait partie de la série de carburant Mixed amine fuel, il est désigné sous le nom de code « Mixed amine fuel 4 », abrégé en MAF-4, ou par « U-DETA », contraction de UDMH-DETA.
Étymologie
Le mot Hydyne vient probablement du mot Hydrazines, classe de composés chimiques de l'UDMH et le DETA, les constituants de l'Hydyne, donnant le préfixe Hy-, et du mot dyne, une unité de mesure de puissance, le complétant comme suffixe[9]. Le carburant peut aussi être écrit « Hydine », mais aucune source précise l'origine de la variante d'écriture.
Histoire
Course à l'espace
Wernher von Braun a proposé en 1954 l'idée de mettre un satellite en orbite lors d'une réunion du comité de vol spatial de l'américain Rocket Society. Il baptisait son projet « Orbiter », et son plan était d'utiliser une fusée de recherche et développement, dérivée du PGM-11 Redstone, le Jupiter-C, avec des grappes de petits propulseurs à propulsion solide au sommet[10].
En pleine année géophysique internationale, qui doit s'étaler de à , Les États-Unis et l'Union des républiques socialistes soviétiques déclarent vouloir chacun placer un satellite artificiel en orbite terrestre basse. Aux États-Unis, deux camps de recherches voient le jour, pour réussir la mise en orbite d'un satellite avant les Soviétiques. Le premier, est le projet Orbiter, dirigé par Wernher von Braun et son équipe d'ingénieurs allemands, avec une étroite collaboration de l'US Army. L'autre camp est celui du Naval Research Laboratory, travaillant sur le programme Vanguard, une fusée-sonde Viking modifiée qui permettra l'envoi d'un petit satellite d'un kilogramme. Pour se charger de sélectionner le vainqueur, le comité scientifique suit les directives présidentielles qui stipulent que le projet doit conserver un caractère civil.
Le , au détriment d'Orbiter pourtant plus abouti, le président Eisenhower approuve le programme Vanguard.
Le , les Soviétiques réussissent la première mise en orbite d'un satellite, Spoutnik 1, suivie par Spoutnik 2 un mois plus tard, contenant la chienne Laïka. Les Américains répliquent le , avec un vol d'une fusée Vanguard, volant seulement deux secondes avant d'exploser en se crashant sur le pas de tir[11]. Après cette défaite, les États-Unis se tournent vers Wernher von Braun et ses fusées Redstone, plus particulièrement son Jupiter-C, pour les transformer en lanceurs. Mais un problème apparait : tel que conçu, le Jupiter-C n'avait pas une capacité de levage suffisante pour atteindre l'orbite. Wernher von Braun avait calculé que si on augmentait l'efficacité du carburant de 8 %, la fusée serait capable de mettre un satellite en orbite. Avant la création de l'Hydyne, les fusées de la famille Redstone utilisaient de l'éthanol coupé à 25 % d'eau comme carburant, et de l'oxygène liquide comme comburant (oxydant)[12]. Pour la conception d'un nouveau carburant, mais aussi un oxydant, l'armée insiste pour que la NAA mette à la tête du projet une personne. Ainsi, lorsqu'un colonel vient au bureau de la NAA avec des nouvelles du contrat, la NAA lui répondit sans hésiter que Mary Sherman Morgan sera à la tête du projet. Le colonel s'en oppose, car Mary ne possède pas de diplôme universitaire, et se trouvait également être une femme. Mais après insistance, Mary est mise à la tête du projet, pour la conception du nouveau carburant, mais aussi d'un nouvel oxydant.
Développement

Durant le développement d'Hydyne, Mary est aidée dans ses calculs par Bill Weber et Toru Shimizu, qui venaient d'obtenir une maîtrise en génie chimique et avaient été embauchés lors d'un salon de l'emploi. Travaillant jour et nuit, ils ont essayé de faire des suppositions éclairées sur les combinaisons qui fonctionneraient, puis de faire les calculs pour prouver les résultats. Outre le carburant, la NAA et l'armée avaient également demandé à Mary de concevoir une alternative à l'oxygène liquide, mais sachant qu'il y avait des centaines de combinaisons de carburant, mais peu d'options pour les oxydants, elle a continué avec le développement du carburant, car elle savait qu'il y avait une bien meilleure chance de trouver une alternative pour ce dernier.
Le lendemain, les trois chercheurs trouvent la masse volumique, et Mary commande quatre tonnes de diéthylènetriamine, mais le ratio n'est pas encore établi. En peu de temps, Mary suppose que le ratio UDMH/DETA est 60/40, confirmé par calcul. Elle baptise sa substance « Bagel ». Le choix de ce nom est un jeu de mots avec l'oxydant utilisé, l'oxygène liquide, abrégé en « LOx », qui porte le même nom qu'un filet de saumon baptisé Lox (en), servi avec du bagel. Mais l'armée, n'acceptant pas ce nom, le renomme « Hydyne ». Grâce à ce nouveau carburant, le gain est augmenté de 8 % au minimum, et le moteur devrait pouvoir être en fonctionnement pendant 155 s dans trois tests distincts. Dans les premiers temps, des suppositions ont été établies. Un jour, la manière dont l'Hydyne est introduit et mélangé dans le moteur-fusée est légèrement modifié. Après trois essais, le moteur-fusée consommait le carburant pendant parfaitement 155 s. Le carburant est alors validé[13]. L'Hydyne pouvait produire une poussée de 83 000 lbf (369 kN) mélangé à de l'oxygène liquide, avec un ratio de 1,73[14], plus que l'alcool éthylique. De plus, son impulsion spécifique est supérieure à celui de l'éthanol, et est aussi plus dense, ce qui permettait une charge propulsive accrue.
Vol sur Jupiter A (RS-29) — 19 décembre 1956
L'Hydyne fut utilisé pour la première fois le [15] sur Jupiter-A #RS-29, un missile Redstone reconverti en une fusée expérimentale[16]. Son objectif était de tester le contrôle d'une configuration de missile instable en utilisant un compteur d'angle d'attaque dans la phase ascendante. Le point de visée est manqué de 157 200 m. L'impulsion spécifique a dépassé les valeurs prévues[17],[18].
Vol sur Jupiter A (CC-45) — 14 janvier 1958
Le dernier vol d'un Jupiter-A à eu lieu avec le Jupiter-A #CC-45 le au pas de tir LC-6 de Cap Canaveral. Le vol a permis de démontrer le système de guidage complet. Le vol a également permis de réaliser le cinquième essai en vol complet de l'ogive inerte et du système d'allumage. L'Hydyne a été utilisé lors de ce vol pour améliorer les performances, et des nacelles de télémétrie détachables ont été testées au cours du vol. Tous les objectifs de la mission ont été atteints, et l'amerrissage à 142,4 milles nautiques de la cible s'est produit à 370 mètres au-dessus et à 86 mètres à droite du point d'impact prédéterminé[19].
Vol sur le X-1E — 6 novembre 1958
.jpg.webp)
Le , le pilote John B. McKay prend le contrôle du Bell X-1 modèle E, un avion expérimental à moteur-fusée pour effectuer un vol de recherche afin de tester les changements du moteur. Sur ce vol, les ingénieurs de la NACA du High-Speed Flight Research Center proposent de faire passer la vitesse maximale de l'engin de Mach 2,7 à Mach 3, en augmentant la pression dans le moteur-fusée LR-8-RM-5, mais aussi en remplaçant l'alcool éthylique faisant office de carburant par de l'Hydyne. Cela a permis d'atteindre la vitesse maximale du X-1E à près de Mach 3. Décembre de cette même année, une inspection au rayon-X a dévoilé des fissures dans le réservoir de carburant. À cause du coût de réparation et de la prochainement mise en service du X-15, le X-1E — et les X-1 en général — ont été misent hors service après ce dernier vol[20],[21].
Abandon

Pour le programme Mercury, la NASA doit trouver un missile pour le reconvertir en lanceur spatial, pour lancer une capsule Mercury avec un astronaute à son bord. L'agence choisit le missile SM-65 Atlas pour l'envoi de l'astronaute, mais les essais en vols sont peu satisfaisants : au premier vol, il subit une défaillance structurelle peu après le lancement, elle n'a donc pu atteindre sa trajectoire prévue. Un autre échec a eu lieu lors du lancement en vol orbital de Mercury-Atlas 3. Par précaution, la NASA est forcée de désigner un nouveau lanceur pour le programme, en attendant que l'Atlas devienne opérationnel. La NASA se tourne alors vers le missile PGM-11 Redstone, et sa famille de fusée comprenant Jupiter-C et Juno I, fusées ayant fait leurs preuves grâce à l'Hydyne. Mais le carburant présente un défaut majeur : l'Hydyne est extrêmement toxique et corrosif. De plus, l'A-7, le moteur-fusée du Redstone, n'avait jamais volé avec l'Hydyne[12]. Si l'Hydyne est utilisé sur les vols habités du programme Mercury, cela pourrait mettre en danger l'astronaute en cas de défaillances. Les deux premiers vols habités ont bien eu lieu sur une fusée Redstone, renommé pour le programme Mercury-Redstone, sans l'utilisation de l'Hydyne, mais avec de l'alcool éthylique[22]. Après que les Atlas, alors renommés Atlas LV-3B pour le programme, deviennent opérationnels, la Mercury-Redstone est mise hors service.

Néanmoins, l'entreprise britannique Short Brothers obtient et produit à hauteur de 75 exemplaires sous licence des drones cibles Beechcraft AQM-37 Jayhawk, ici renommé « SD.2 Stiletto », pour le compte de la Royal Air Force, entre 1976 et 1996[23]. Son moteur-fusée Rocketdyne LR64-NA-4 (alias P4-1 Booster[24]) utilise comme comburant de l'acide nitrique fumant rouge (IRFNA[alpha 2]) et de l'Hydyne comme carburant, produisant ainsi 850 lb, soit 3,781 kN[25].
Propriétés

Apparence
L'Hydyne se présente sous l'apparence d'un liquide hygroscopique, clair à température ambiante, et incolore, dégageant une odeur ammoniacale. Il est miscible en toutes proportions avec l'eau, l'UDMH, l'acétonitrile, la DETA, l'hydrazine, l'éthanol et le MMH. Sa miscibilité avec le JP-4 et le RP-1 n'est que partielle[1].
Point d'ébullition
Le point d'ébullition a été mesuré à 69,57 °C, par ajustement de la courbe des moindres carrés de la pression de vapeur à partir de deux mesures rapportées par Rocketdyne et FMC Corporation. Rocketdyne a obtenu un résultat de 71,7 °C, alors que FMC Corporation trouve 64,4 °C[3].
Point de fusion
Rocketdyne rapporte un point de fusion de l'Hydyne à −84,4 °C, mais cette valeur, due à l'aspect visqueux et vitreux que l'Hydyne prend à cette température, présente une incertitude considérable[2].
Pression de vapeur
La pression de vapeur a été mesurée et rapportée par Food Machinery and Chemical Corporation (FMC) et Rocketdyne. Cependant, la pureté et les données de composition faisaient défaut et relativement peu de points de données avec une dispersion considérable ont été obtenus. Basée sur les données disponibles, la pression de vapeur peut être décrite[3] :
Masse volumique
La masse volumique a été mesurée par FMC et Reaction Motors Division (RMD) en trois ensembles de données, mais les ensembles de données comprennent des erreurs, des variations de composition, des impuretés de la DETA allant jusqu'au 9 %, faussant les données. Aucune tentative de correction des données n'a été effectuée, à cause du manque de savoir sur les conditions et les méthodes utilisées sur les mesures. Toutes les données disponibles, à l'exception d'un point manifestement en désaccord avec le reste, ont été utilisées pour dériver l'équation de masse volumique suivante[4] :
Indice de réfraction
Deux valeurs de l'indice de réfraction de l'Hydyne ont été reportées. La première, mesurée par le Bureau des mines des États-Unis, a donné une fourchette entre 1,443 et 1,446 à 13 °C, alors que Grant[Qui ?] a obtenu 1,438 à 25 °C[8].
Propriétés chimiques
Les propriétés chimiques de l'Hydyne peuvent être déterminées grâce à ses deux composants : l'UDMH et la DETA. Ce mélange basique peut être lentement oxydé par le CO2, contenu par exemple dans l'atmosphère terrestre. L'hydyne attaque le cuivre et le laiton, grâce à l'UDMH. Bien qu'aucune donnée spécifique sur les réactions chimiques de l'Hydyne n'ait été reportée, on peut supposer que l'Hydyne possède les mêmes propriétés que l'UDMH[26].
Enthalpie standard de formation
L'enthalpie standard de formation de l'Hydyne peut être calculée à partir de l'enthalpie standard de formation des deux ingrédients et de la fraction molaire. Sachant que la composition massique exacte de l'Hydyne est de 60 % en UDMH et de 40 % en DETA, l'enthalpie standard de formation (à 298,15 K) de l'Hydyne est de 3,70 kcal/mol. La mole est définie comme 72,149 8 g avec la formule brute[27] :
| Composé | Composition massique (%) |
Fraction molaire | (kcal/mol) |
|---|---|---|---|
| UDMH (C2H8N2, M = 60,1 g/mol) | 60 | 0,72 | 12,339[27] |
| DETA (C4H13N3, M = 103,2 g/mol) | 40 | 0,28 | −18,5[27] |
ou :
Constantes d'état critique
Les valeurs critiques de température et de pression, également mesurées par Rocketdyne, rapportaient respectivement 285 °C et 784 livres par pouce carré (5 410 000 Pa). Les méthodes utilisées pour obtenir ces résultats ne sont pas connues car la source originale des données n'était pas disponible, faisant ces valeurs invérifiables. De plus, comme l'Hydyne est un mélange, les données se réfèrent très probablement à un point « pseudocritique », de sorte que ces valeurs doivent donc être traitées comme provisoires[6].
Décomposition radiolytique
La décomposition radiolytique de l'Hydyne a été reportée à 149,4 mL de gaz d'échappement radiolytique, mesurée à 25 °C et 1 atm, lorsqu'il est irradié à 8,5 × 106 rads avec des rayons gamma. Cette étude fut réalisée pour déterminer s'il est possible de supprimer la génération de gaz non condensables lorsque les carburants liquides Hydrazine, RP-1 et Hydyne sont soumis à un rayonnement gamma au cobalt 60. Plus la suppression de cette génération de gaz d'échappement est élevée, plus la capacité de stockage des combustibles par rapport aux rayonnements ionisants dans l'espace et des moteurs-fusées nucléaires est élevée[28].
Propriétés avec oxydants
| Oxydant | Rapport oxydant/Hydyne optimal | Température de combustion | Impulsion spécifique | Impulsion spécifique au niveau de la mer |
Densité |
|---|---|---|---|---|---|
| Oxygène liquide (LOx[alpha 3])[29] | 1,73 | 3 585 K | 359 s | 306 s | 1,02 |
| L'oxygène liquide était le plus récent, le moins cher, le plus sûr et finalement l'oxydant de préférence des lanceurs spatiaux. C'est l'unique comburant qui était utilisé avec l'Hydyne avec l'IRFNA. | |||||
| Mixed oxides of nitrogen (MON[alpha 3])[30] | 2,84 | 3 475 K | 335 s | 287 s | 1,19 |
| Le MON ne fut jamais utilisé avec l'Hydyne. | |||||
| Peroxyde d'azote (NTO[alpha 3])[31] | 2,71 | 3 395 K | 330 s | 282 s | 1,22 |
| Le peroxyde d'azote ne fut jamais avec l'Hydyne. | |||||
| Pentafluorure de brome (BrF5)[32] | 3,85 | 3 195 K | 227 s | 227 s | 1,78 |
| Les problèmes de manipulation et les risques pour la sécurité du pentafluorure de brome toxique l'emportaient sur les avantages de performance. | |||||
| Trifluorure de chlore (ClF3)[33] | 2,98 | 3 710 K | 331 s | 276 s | 1,43 |
| Le trifluorure de chlore a eu de meilleures performances en utilisant du carburant à hydrazine. | |||||
| Fluorure de perchloryle (ClO3F)[34] | 2,78 | 3 290 K | 285 s | 285 s | 1,22 |
| Le fluorure de perchloryle n'a eu aucune application avec l'Hydyne, car il a de meilleures performances en utilisant du carburant à base d'hydrazine. | |||||
Dangerosité
Toxicité
En absence d'informations détaillées pour des mélanges spécifiques, on peut déterminer la toxicité de l'Hydyne à partir de celle de ses deux composants. L'UDMH est le composant ayant la pression de vapeur la plus élevée, il est donc de considération primordiale. L'UDMH et la famille de combustibles aminés mixtes (MAF), comprenant l'Hydyne, représentent un danger humain par[35] :
- contact avec les yeux à l'état liquide ou gazeux ;
- inhalation de vapeur ;
- exposition à la peau à l'état liquide ou à forte concentration de vapeur ;
- explosion ou combustion.
Inflammabilité
L'UDMH est inflammable dans l'air sur une très large gamme de concentrations mais la plage d'inflammabilité pour les MAF, comprenant l'Hydyne, peut être légèrement plus étroite que pour l'UDMH. Toutes ces substances sont hypergoliques avec certains oxydants, tels que les acides nitriques fumants, le tétroxyde d'azote, le peroxyde d'hydrogène, le trifluorure de chlore et le fluor. Les chiffons, déchets de coton, chutes de bois, excelsior et autres matériaux de grande surface, provoquent une inflammation spontanée à l'absorption de l'UDMH ou des MAF. Ils ne doivent en aucun cas être stockés dans des conditions qui empêchent la dissipation de la chaleur qui s'accumule lors de l'oxydation progressive. Lorsqu'ils entrent en contact avec de telles matières organiques, des incendies peuvent être provoqués. Deux types d'incendies se produisent : les feux supportés librement dans l'air et les feux supportés par un oxydant (ex. : combustion de type torche). Dans les espaces clos, le personnel se trouvant dans un environnement où la limite inférieure d'explosivité (LIE) atteint 20 % doit être évacué[36].
Explosion
Les propriétés de l'UDMH et des combustibles aminés mixtes sont presque similaires, puisque la vapeur est principalement de l'UDMH. Une teneur d'UDMH supérieure à 2 % dans l'air peut initier une inflammation par une étincelle électrique ou une flamme nue. En raison de la pression de vapeur élevée et d'une large plage d'inflammabilité, la possibilité qu'un mélange explosif se forme sur le liquide est très élevée. L'UDMH doit être stockée et manipulée sous une atmosphère d'azote[37].
Logistique
Conception
L'Hydyne est un mélange massique de 60 % d'UDMH et de 40 % de DETA, la production se fait sous un rembourrage d'azote[38].
UDMH
L'UDMH est fournie principalement aux États-Unis par Chemical Corporation et Food Machinery, dans l'usine de fabrication de Baltimore, dans le Maryland. La synthèse de l'UDMH est réalisée par FMC Corporation via la nitrosation de la diméthylamine (DMA) en N-nitrosodiméthylamine, suivie de la réduction de cet intermédiaire en (CH3)2 N2H2 (UDMH) :
La substance est ensuite purifiée et distillée, donnant ainsi l'UDMH presque anhydre.
Une autre méthode de fabrication est le procédé de Olin Raschig, utilisé pour la production de l'hydrazine et de la méthylhydrazine. Pour l'UDMH, le procédé est modifié par la substitution de la diméthylamine à l'ammoniac dans la réaction de deuxième étape avec la chloramine[39].
DETA
La DETA est quant à elle disponible dans le commerce, fabriquée par Dow Chemical et Carbide and Carbon Chemicals Company ; elle est obtenue en traitant le dichlorure d'éthylène avec de l'ammoniac. Les conditions de réaction varient, mais dans tous les cas, un mélange est obtenu. À basse pression et température, elle est principalement produite avec un faible rendement ; si la pression et la température sont plus élevées, une plus grande proportion de diéthylènetriamine et d'autres polyéthylènepolyamines est produite[40].
Culture populaire
Le fils de Mary Sherman Morgan, George D. Morgan, dramatise la création de l'Hydyne dans une pièce de théâtre intitulée « Rocket Girl », qui raconte une fiction historique de Mary Sherman Morgan et de sa création, l'Hydyne[43]. Cette pièce fut diffusée au California Institute of Technology, en [44].
Notes et références
Notes
- Pour l'anglais Unsymmetrical DiMethylHydrazine.
- De l'anglais Inhibited Red Fuming Nitric Acid, pour acide nitrique fumant rouge inhibé.
- Dénomination en astronautique.
Références
- Marsh et Knox 1970, Section 2.9.2.1, p. 252. « Introduction »
- Marsh et Knox 1970, Section 2.9.5.2, p. 259. « Melting Point and Heat of Fusion »
- Marsh et Knox 1970, Section 2.9.3.1, p. 252. « Vapor Pressure and Normal Boiling Point »
- Marsh et Knox 1970, Section 2.9.3.2, p. 252. « Density of Liquid MAF-4 »
- United States. Department of the Air Force 1973, Table 10-4, p. 282. « Physical Properties of MAF-4 »
- Marsh et Knox 1970, Section 2.9.5.3, p. 259. « Critical State Constants »
- Marsh et Knox 1970, Section 2.9.1, p. 251. « Property summary sheet »
- Marsh et Knox 1970, Section 2.9.3.9, p. 259. « Index of Refraction »
- Heflin 1966, p. 62 - H. « hydyne »
- Bate, Mueller et White 1971, p. 152.
- « Vanguard - Historique », sur lanceurs.destination-orbite.net (consulté le ).
- (en) « Redstone Rocket Engines (A-6 and A-7) », sur heroicrelics.org (consulté le ).
- (en) Kristina Panos, « Mary Sherman Morgan, rocket fuel mixologist », sur hackaday.com, (consulté le ).
- (en) Mark Wade, « Lox/Hydyne », sur astronautix.com (consulté le ).
- (en) « Cape Canaveral Launch Complexe 5/6/26A/26B Launch Log », sur spacelaunchreport.com (consulté le ).
- Bullard 1965, p. 60.
- Bullard 1970, p. 170.
- (en) Mark Wade, « Jupiter-A », sur astronautix.com (consulté le ).
- Cleary 2013, p. 51.
- (en) Yvonne Gibbs, « NASA Armstrong Fact Sheet: X-1E Research Aircraft », sur nasa.gov, (consulté le ).
- Winter 2017, p. 131.
- (en) NASA, « 4. Mercury-Redstone Launch-Vehicle developement and performance », sur history.nasa.gov (consulté le ).
- Arnaud, « Beechcraft AQM-37 Jayhawk : Le drone cible aux faux airs de missile de croisière », sur avionslegendaires.net, (consulté le ).
- (en) Mark Wade, « P4-1 Booster », sur astronautix.com (consulté le ).
- Space chronicle 2019, p. 30 et 32.
- Marsh et Knox 1970, Section 2.9.4, p. 259. « Chemical properties of MAF-4 »
- Marsh et Knox 1970, Section 2.9.5., p. 259. « Heat of Formation of Liquid »
- Shelberg 1966, p. 4.
- (en) Mark Wade, « Lox/Hydyne », sur astronautix.com (consulté le ).
- (en) Mark Wade, « MON/Hydyne », sur astronautix.com (consulté le ).
- (en) Mark Wade, « N2O4/Hydyne », sur astronautix.com (consulté le ).
- (en) Mark Wade, « BrF5/Hydyne », sur astronautix.com (consulté le ).
- (en) Mark Wade, « ClF3/Hydyne », sur astronautix.com (consulté le ).
- (en) Mark Wade, « ClO3F », sur astronautix.com (consulté le ).
- United States. Department of the Air Force 1973, Section 10-2.1, p. 278. « Health Hazards »
- United States. Department of the Air Force 1973, Section 10-2.2, p. 281. « Fire »
- United States. Department of the Air Force 1973, Section 10-2.3, p. 281. « Explosion »
- Marsh et Knox 1970, Section 2.9.6.1, p. 259. « Manufacture »
- Marsh et Knox 1970, Section 2.5.6.1, p. 177. « Manufacture »
- Marsh et Knox 1970, Section 2.2.6.1, p. 69. « Manufacture »
- Space/aeronautics 1959, p. 76.
- (en) Mark Wade, « Hydyne », sur astronautix.com (consulté le ).
- Morgan 2013.
- Lerner 2009, p. 10.
Annexes
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- [Bate, Mueller et White 1971] (en) Roger R. Bate, Donald D. Mueller et Jerry E. White, Fundamentals of astrodynamics, New York, Dover Publications, , 455 p. (ISBN 9780486600611, OCLC 948854108, lire en ligne
 ).
). 
- [Bullard 1965] (en) John W. Bullard, Army Missile Command Redstone Arsenal AL, History of the redstone missile system, États-Unis, , 199 p. (OCLC 834285704, présentation en ligne, lire en ligne
 ), p. 170.
), p. 170. 
- [Cleary 2013] (en) Mark C. Cleary, Army Ballistic Missile Programs at Cape Canaveral, , 99 p. (ISBN 9781301178926, OCLC 970694031, lire en ligne
 ).
). 
- [Heflin 1966] (en) Woodford Agee Heflin, Air University (U.S.). Aerospace Studies Institute. Documentary Research Division, The Second Aerospace Glossary, Alabama, Maxwell Air Force Base, coll. « Air University documentary research study », , 146 p. (OCLC 1309184, lire en ligne
 ).
). 
- [Marsh et Knox 1970] (en) Walter R. Marsh et Bruce P. Knox, USAF Propellant Handbooks. Hydrazine Fuels, vol. 1, , 543 p. (OCLC 26798687, lire en ligne
 ).
). 
- [Morgan 2013] (en) George D. Morgan, Rocket Girl: The Story of Mary Sherman Morgan, America's First Female Rocket Scientist, Prometheus Books, , 334 p. (ISBN 978-1616147396).
 — Ce livre, écrit par le fils de Mary Sherman Morgan, retrace toute la vie de sa mère, de sa naissance à sa mort, et de ses exploits, comme la création de l’Hydyne.
— Ce livre, écrit par le fils de Mary Sherman Morgan, retrace toute la vie de sa mère, de sa naissance à sa mort, et de ses exploits, comme la création de l’Hydyne.
- [Pan American World Airways 1958] (en) Pan American World Airways, Manual for Handle : Missile Propellants (no AD0710179), (lire en ligne
 ), p. 456
), p. 456
- [Shelberg 1966] (en) W. E. Shelberg, The radiolytic decomposition of Hydrazine, RP-1 and Hydyne rocket fuels, , 17 p. (OCLC 831897227, lire en ligne
 ).
). 
- [Lerner 2009] (en) Preston Lerner, Soundings: She Put The High In Hydyne, vol. 23, no 6, Air & Space Smithsonian Magazine, (ISSN 0886-2257).

- [Space/aeronautics 1959] (en) Space/aeronautics, vol. 31-32, Conover-Mast Publications, (lire en ligne
 ).
). 
- [Space chronicle 2019] (en) Space chronicle, a british interplanetary society publication, vol. 72, no 3, , 40 p. (ISBN 978-0-9567382-2-6, lire en ligne
 ).
). 
- [United States. Department of the Air Force 1973] (en) United States. Department of the Air Force, Air Force Manual, vol. 1 à 2 ; vol. 161, (lire en ligne
 ).
). 
- [Winter 2017] (en) Frank H. Winter, America’s First Rocket Company: Reaction Motors, Inc, American Institute of Aeronautics & Astronautics, coll. « Library of Flight », , 301 p. (ISBN 9781624104411, OCLC 1039138599, lire en ligne
 ).
). 
Articles connexes
Liens externes
- (en) [vidéo] NASA History, The Launch of Explorer 1 sur YouTube, (consulté le )
- (en) [vidéo] Reactions, The Woman Who Saved the U.S. Space Race (And Other Unsung Scientists) sur YouTube, (consulté le )
- Portail de l’astronautique
- Portail de la chimie
- Portail des années 1950
- Portail de l’énergie