Morse (animal)
Odobenus rosmarus
Pour les articles homonymes, voir Morse.


VU A3c[1] : Vulnérable
Statut CITES
Le Morse[alpha 1] (Odobenus rosmarus) est une espèce de grands mammifères marins, unique représentant actuel de son genre, Odobenus, ainsi que de sa famille, celle des Odobenidae. Il possède une répartition discontinue circumpolaire dans l'océan Arctique et sa périphérie, comme le Nord de l'Atlantique ou encore la mer de Béring qui se trouve dans le Nord du Pacifique. Deux à trois sous-espèces sont distinguées par leur taille et l'aspect de leurs défenses : O. r. rosmarus trouvée dans l'Atlantique, O. r. divergens, occupant le Pacifique et O. r. laptevi, au statut discuté, vivant en mer des Laptev.
Le Morse est parfaitement reconnaissable à ses défenses, ses moustaches drues et son allure massive. Les mâles adultes du Pacifique peuvent peser jusqu'à deux tonnes et, parmi les membres de l'ancien sous-ordre des Pinnipèdes, l'espèce n'est dépassée en taille que par l’Éléphant de mer. Le Morse vit principalement dans les eaux peu profondes des plateaux continentaux, passant une part importante de son existence sur les blocs de glace ou les icebergs dérivants. De ces plates-formes, il part à la recherche de sa nourriture de prédilection, les mollusques bivalves du benthos. C'est un animal sociable, à l'espérance de vie d'environ 40 ans, et considéré comme une espèce clé des écosystèmes marins de l'Arctique.
Le Morse occupe une place importante dans la culture de nombreux peuples autochtones de l'Arctique, qui le chassèrent pour sa viande, sa graisse, sa peau, ses défenses et ses os. Aux XIXe et XXe siècles, le Morse fut l'objet d'une très forte exploitation commerciale pour sa graisse et de l'ivoire de ses défenses, faisant diminuer rapidement ses effectifs. Depuis, sa population mondiale a de nouveau augmenté, bien que les populations de l'Atlantique et de la mer des Laptev restent réduites et fragmentées.
Sémantique
Étymologies
Popularisé par Buffon[2], le terme « morse » est vraisemblablement issu d'une onomatopée lapone, morssa, arrivée en français via les langues slaves[3]. L'origine commune de ce terme est en effet facilement identifiable dans le terme морж (morž) en russe, mors en polonais, mursu en finnois mais aussi dans les langues plus méridionales comme morsa en espagnol, morsă en roumain, etc.

Comme dans le cas de nombreux autres animaux marins, le vieux norrois est à l'origine de termes de plusieurs langues nord-européennes. Le terme actuel norvégien (en bokmål) est Hvalross, il dérive directement du vieux norrois hrossvalr qui signifie « cheval-baleine ». Ce terme passa sous une forme juxtaposée dans les dialectes néerlandais et nord-allemands en walros et Walross[4] puis en anglais moderne sous la forme walrus[5], bien que quelques sources en fassent une juxtaposition du néerlandais wal (« rivage ») et de reus ou rus (« géant »)[6].
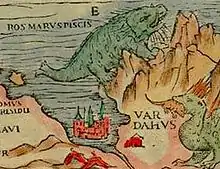
La plus ancienne description connue de l'animal, du moins assez précise pour ne pas souffrir d'ambiguïté, est celle d'Olaus Magnus datant de 1539[7], même si ce religieux scandinave est habituellement fantaisiste dans ses descriptions. Le support où l'animal est représenté est une gravure sur bois nommée Carta Marina. Assez peu ressemblante, l'effigie est légendée rosmarus piscis et l'animal décrit en quelques lignes dans un encart à l'angle inférieur gauche[alpha 2]. Puisque mar est en norrois une racine désignant la mer, comme dans le terme maralmr qui désigne une herbacée des dunes sableuses, il est possible que le terme rosmarus apparu sous la plume de Olaus Magnus soit une latinisation de termes scandinaves[alpha 3], cheval et mer, rosmarus signifiant alors « cheval marin »[8]. Une autre hypothèse donnerait rosmarus comme la forme latinisée d'une déformation de rosmhvalr, rosm désignant chez les Scandinaves la couleur rouge-brun et hvalr signifiant « baleine »[7]. Enfin rosmarus pourrait être une latinisation du nom vernaculaire russe[7]. Ce nom est ensuite repris par de nombreux auteurs comme Conrad Gessner et enfin choisi par Carl von Linné comme dénomination spécifique de l'animal lors de sa description scientifique[9] , et conservé depuis lors.
Le nom latin du genre, Odobenus, vient du grec odous, signifiant « dent » et baino, signifiant « marcher », et tiré des observations de morses s'aidant de leurs défenses afin de se hisser hors de l'eau. On retrouve également cette étymologie pour les Odobenocetopsidae. Odobenus rosmarus pourrait se traduire par « le cheval marin marchant sur ses dents », sous réserve des origines imprécises de la dénomination spécifique.
Appellations

Pour distinguer en français les deux sous-espèces principales, la sous-espèce type, O. r. rosmarus, est appelée « morse de l'Atlantique » et O. r. divergens « morse du Pacifique », en référence évidente à leurs aires de répartition respectives.
Comme chez tous les pinnipèdes, le petit est couramment appelé « veau », ainsi les mâles peuvent être nommés « taureaux » et les femelles « vaches », mais ces deux dernières appellations tiennent plus de l'anglicisme issu des termes bull et cow. Lorsque le jeune atteint l'âge de quatre mois, il est de la même manière nommé yearling[10].
L'animal conservait toujours de nombreux noms au début du XIXe siècle « vache marine » (latinisé en Vacca marina), « cheval marin »[alpha 4] (latinisé en Equus marinus), « bête à grandes dents » ou encore « lamantin morse »[12],[13]. Le terme de « vache de mer » est ambigu car il était à l'époque également attribué à d'autres mammifères marins comme les éléphants de mer ou comme les sirénéens parmi lesquels les taxonomistes l'ont d'ailleurs classé pendant un temps.
Concernant les appellations autochtones, l'animal est appelé aivik en inuit et aivuk chez les Yupiks[14].
Description
Mensurations et particularités anatomiques
_Bacalum_Morse.jpg.webp)
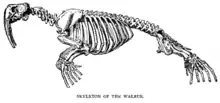
Bien que certains mâles isolés du Pacifique puissent peser près de deux tonnes, la plupart pèsent entre 0,8 et 1,8 tonne. Les femelles pèsent environ les deux tiers de ce poids, les morses de l'Atlantique étant globalement légèrement plus petits[16]. La sous-espèce atlantique a également tendance à avoir des défenses plus courtes et un museau plus aplati. Le morse est la deuxième plus grande espèce de pinnipèdes, derrière les éléphants de mer[16]. Le mâle mesure de 2,70 à 3,60 mètres de long et la femelle entre 2,30 et 3,10 mètres[14].
Ses yeux, petits et noirs, sont placés haut de chaque côté de son crâne presque cubique, au museau court et large. Son cou est massif et sa queue très courte est souvent cachée par un repli de peau[14]. Comme les phoques, il ne possède pas d'oreille externe et son corps est conique[17].
Les mâles possèdent un grand baculum, os du pénis appelé « oosik » chez les inuits, tubulaire et creux atteignant les 63 cm de longueur, soit le plus grand chez tous les mammifères, aussi bien par sa longueur absolue que par sa longueur relative, c'est-à-dire par rapport à la taille de l'animal[16],[18]. Les testicules se trouvent à l'intérieur du corps. La femelle présente deux paires de tétines[11],[13].
Locomotion
Le morse partage certaines caractéristiques avec les otaries (Otariidae) et les phoques (Phocidae). Ses palettes natatoires, appelées improprement nageoires, sont garnies de cinq doigts[12]. Comme les otariidés, il peut orienter les nageoires postérieures vers l'avant et se déplacer à quatre pattes, mais il reste globalement maladroit sur la terre ferme[19]. Lors de la nage, il rappelle davantage les phocidés, se propulsant en ondulant de son corps plutôt qu'à l'aide de ses nageoires[16]. Les nageoires antérieures mesurent le quart de la longueur totale, les nageoires postérieures étant de quinze centimètres plus courtes[20]. Il nage généralement à une vitesse de 7 km/h, mais peut atteindre 35 km/h[21].
Les mâles, et plus rarement certaines femelles, possèdent au-dessous de la gorge deux poches d'air qui peuvent se gonfler d'une cinquantaine de litres d'air[22]. Elles leur servent de caisses de résonance pour leurs vocalisations ou de flotteurs, leur permettant même de se tenir verticalement dans l'eau tout en dormant[23].
Denture

La principale caractéristique du morse réside dans ses longues défenses, exclusivement composées d'ivoire, le plus pur après celui des éléphants[24]. Ces canines très allongées peuvent atteindre une longueur d'un mètre pour un poids allant jusqu'à 5,4 kg[25], même si elles ne dépassent généralement pas 75 cm[23]. On les trouve chez les deux sexes, celles des mâles étant plus longues et plus droites, ainsi que de section plutôt aplatie alors que celles des femelles plus courtes et plus courbées ont une section plutôt ronde[21],[14]. Elles sont constituées de deux couches de dentine entourées de cément, et commencent à percer chez les jeunes dès l'âge de six mois, sortant du repli labial à l'âge d'environ deux ans[21], et cessent leur croissance quand l'individu a environ 15 ans, même si elles peuvent chez certains mâles ne jamais cesser de grandir[14]. Ces défenses, qui perdent leur revêtement d'émail lors de la jeunesse de l'animal[26], sont souvent parcourues de fissures et viennent même à se briser chez les vieux individus.
Les défenses sont un peu plus longues et épaisses chez les mâles, chez lesquels elles sont signes extérieurs de puissance et de dominance : les mâles les plus forts aux défenses les plus grandes dominent généralement les groupes sociaux, ou combattent en cas d'équivalence. Avec ces longues dents, les morses peuvent également se hisser hors de l'eau après les avoir plantées dans la glace[27].
| Formule dentaire | |||||||
|---|---|---|---|---|---|---|---|
| mâchoire supérieure | |||||||
| 0 | 3 | 1 | 1 | 1 | 1 | 3 | 0 |
| 0 | 3 | 1 | 0 | 0 | 1 | 3 | 0 |
| mâchoire inférieure | |||||||
| Total : 18[alpha 5] | |||||||
On a longtemps supposé que ces défenses étaient utilisées pour déterrer les proies des fonds marins. Mais l'étude de l'abrasion des défenses indique que celles-ci traînent simplement dans les sédiments lorsque le bord supérieur du museau est utilisé pour creuser, et qu'elles ne s'usent alors que dans leur partie supérieure[28]. Les individus aux défenses cassées peuvent donc continuer à s'alimenter[23].
Le reste de la denture est rarement complet, mais les dents arrondies avoisinant les 5 cm sont également constituées d'ivoire[26]. C'est principalement celui-ci, considéré comme l'un des plus beaux qui soient, qui valut à l'animal une chasse d'abord autochtone puis plus généralisée.
Vibrisses

De nombreux poils épais et rigides entourent les défenses (vibrisses mystaciales), donnant au morse son apparence moustachue caractéristique. Il peut y avoir de 400 à 700 vibrisses réparties en 13 à 15 lignes mesurant trois millimètres de diamètre[21] pour 30 centimètres de longueur, mais celles-ci sont beaucoup plus courtes à l'état sauvage, s'usant constamment lors de la recherche de nourriture[29]. Les vibrisses sont reliées à des muscles et sont donc érectiles[23] ; elles sont alimentées en sang et innervées, ce qui en fait un organe très sensible permettant au morse d'être capable de distinguer au toucher des formes de 3 mm d'épaisseur pour 2 mm de largeur[29], et repoussent chaque année[30].
Peau et graisse
Excepté les vibrisses, la pilosité du morse est réduite à une fourrure répartie de manière très éparse, aux poils longs d'un centimètre, et l'animal semble presque glabre, le fœtus seul étant poilu[23]. La peau imperméable[31], très ridée et épaisse de plusieurs centimètres le protège de la glace ou des pierres aux arêtes vives, et atteint les 10 cm d'épaisseur autour du cou et des épaules des mâles, chez qui elle peut également prévenir des blessures lors de combats. La couche de graisse sous-cutanée, ou lard, mesure jusqu'à 15 cm d'épaisseur et le morse craint moins le froid que les excès de chaleur, qu'il évacue à l'aide de ses nageoires hautement vascularisées[23]. Chez un morse en bonne santé la graisse représente un tiers du poids, soit près de 500 kg[11],[20].
Les jeunes morses sont brun foncé voire rougeâtres et pâlissent, virant au brun-cannelle au fur et à mesure de leur vieillissement. Les vieux mâles, en particulier, deviennent presque rose et la couleur peut servir à fournir une estimation grossière de l'âge. Les vaisseaux sanguins de la peau se contractant dans l'eau froide, le morse peut paraître presque blanc lorsqu'il nage et reprend sa couleur sombre voire rosit au soleil[22]. Les mâles ont pour caractère sexuel secondaire d'importants nodules, en particulier autour du cou et des épaules[27], où persistent également chez les mâles aguerris les cicatrices de combats passés. La face ventrale est généralement plus sombre que le dos.
Perceptions par les sens
À cause de leur régime alimentaire ciblant des proies inféodées au plancher marin, la vue est probablement moins bien développée que chez les autres pinnipèdes qui ont à chasser des proies mouvantes. Le sens tactile est notamment assuré par les vibrisses, la peau épaisse étant particulièrement peu sensible. L'ouïe est bien développée tout comme l'odorat, permettant la communication entre mères et petits, ou pour repérer à distance un prédateur. On ne connait pas la réelle importance du goût pour le choix de la nourriture, même si le morse a des préférences évidentes. Les papilles gustatives sont moins nombreuses mais plus grosses que celles des mammifères terrestres[14].
Écologie et comportement
Alimentation

Le morse affectionne les eaux peu profondes du plateau continental où il prospecte dès l'aube le fond de la mer, souvent en groupes de dix à quinze individus, en partant d'un bloc de glace lui servant de plate-forme[16]. Il est nettement moins pélagique que les autres pinnipèdes, mais ses plongées, bien que moins profondes en moyenne, avoisinent tout de même 80 mètres et peuvent durer près d'une demi-heure[32], même si la moyenne n'excède guère dix minutes[21]. Le record de plongée mesuré chez la sous-espèce atlantique était de 113 mètres de profondeur[19]. Pour trouver sa nourriture, il peut s'éloigner jusqu'à deux kilomètres des côtes lorsque les risques de se retrouver prisonnier sous la glace sont trop grands[21].
Le morse a un régime alimentaire diversifié et opportuniste, se nourrissant de plus de soixante genres d'organismes marins, comprenant crevettes, crabes, vers tubicoles, coraux mous, tuniciers, concombres de mer, divers mollusques et petits poissons[33]. Sa source d'alimentation de prédilection reste toutefois les mollusques bivalves du benthos, en particulier myes, palourdes, mais aussi coques, clams ou bucardes qui constituent 60 à 80 % de son régime alimentaire[23]. Il part en quête de nourriture deux fois par jour et peut consommer jusqu'à 400 palourdes par jour, soit 27 kg de nourriture et 3 à 6 % de son poids[14].

Il déniche ses proies sur le plancher marin à l'aide de ses vibrisses et chasse le sable en créant un courant à l'aide de sa nageoire ou en propulsant un puissant jet d'eau avec sa bouche[34]. Une fois le terrain nettoyé, le morse casse les bivalves entre ses nageoires ou aspire la chair en plaquant ses puissantes lèvres sur l'organisme et en reculant rapidement sa langue dans sa bouche, comme un piston, créant un vide[30]. Son palais particulièrement voûté, permet une aspiration efficace.
À côté de sa consommation de nombreux organismes, sa méthode de recherche de nourriture a un grand impact périphérique sur les communautés benthiques. Elle est une source de bioturbation du plancher de la mer, libérant des nutriments dans toute la colonne d'eau et encourageant le mélange et la circulation de nombreux organismes, ce qui accroît la dispersion du benthos[28]. Leur voracité pourrait quant à elle avoir un impact négatif non négligeable sur les bancs de bivalves à reconstitution lente, et donc sur l'ensemble de la faune se nourrissant de ceux-ci[23].
Des restes de phoques ont déjà été retrouvés en quantité non négligeable dans l'estomac de morses du Pacifique, mais l'importance de ces mammifères dans l'alimentation des morses reste débattue[35]. Quelques rares exemples de prédation sur les oiseaux de mer ont été rapportés, en particulier sur le Guillemot de Brünnich (Uria lomvia)[36]. Enfin, le morse peut se montrer cannibale, notamment envers les nouveau-nés, ou encore charognard, consommant carcasses de cétacés[21], de congénères, d'ours polaires ou même de chiens de traîneau[37].
Parasites et maladies
La peau du morse peut héberger de nombreux types de parasites, comme ceux suceurs de sang du sous-ordre des Anoplura, et les acanthocéphales. Certains nématodes sont des parasites internes des plus courants. Une étude portant sur les Trichinella a trouvé les larves du parasite, et notamment celles de l'espèce T. nativa, chez 2,4 % des 1 529 morses étudiés : alors que les autres pinnipèdes et les cétacés ne sont que des porteurs occasionnels, le morse est un porteur vital pour le parasite, avec une prévalence de 0 à 9,4 %. Ses habitudes charognardes en font un vecteur particulièrement privilégié de la trichinellose[37], inoffensive pour l'animal mais un fléau pour les autochtones qui consomment la viande de morse crue[38].
Les infections bactériennes contractées par les nageoires ou les yeux mènent rapidement à la perte de poids précédant la mort de l'individu, comme cela a notamment été étudié pour le genre Brucella. L'impact des infections virales causées par les calicivirus et le morbillivirus est encore largement inconnu.
Comportement social et prédateurs naturels

Les morses sont extrêmement grégaires, les plus sociables des pinnipèdes. Ils forment souvent de grands groupes comptant de quelques centaines à quelques milliers d'individus[21], où les individus se collent et se frottent les uns aux autres, peut-être afin de supprimer les parasites. La communication de la colonie se fait par beuglements et grognements[23]. Ces derniers pourraient même s'entendre jusqu'à 1,5 km de distance[39]. La hiérarchie est édictée par les mâles les plus imposants et aux plus belles défenses, trônant au centre du groupe[21], mais les comportements en vue de la reproduction et l'organisation au sein d'un groupe varient quelque peu entre les populations du Pacifique et de l'Atlantique. De plus les sexes sont généralement séparés en dehors de la saison de reproduction, les femelles remontant vers le nord[22]. Les jeunes mâles n'ayant pas encore atteint leur maturité sexuelle se regroupent généralement, en périphérie du gros de la colonie. Certains individus sont vigilants pour le reste du groupe, donnant l'alerte en cas de danger en sifflant, auquel cas tous les morses se réfugient dans l'eau[21].
Grâce à sa taille imposante, le morse n'a que deux prédateurs naturels : l'orque (Orcinus orca) et l'ours blanc (Ursus maritimus)[39],[40]. Il ne constitue cependant pas une grosse part du régime alimentaire de ceux-ci. L'ours polaire peut chasser le morse en se précipitant dans les groupes formés sur les plages, et consomme les individus écrasés ou blessés dans la panique, en général jeunes ou infirmes[41],[18]. Cependant, un morse même blessé reste un adversaire redoutable pour un ours blanc, et les attaques directes sont rares. De plus, les membres d'une colonie peuvent s'unir pour faire face à un prédateur et secourir un congénère. Ainsi seuls les individus se tenant éloignés du groupe sont réellement susceptibles d'être victime d'un ours[21].
De la parade à l'accouplement
Les mâles atteignent leur maturité sexuelle dès l'âge de 7 ans, mais ne se reproduisent généralement pas avant leur développement complet, vers 15 ans[16], pour pouvoir commencer à disputer les femelles aux autres mâles de la colonie. Le rut a lieu de janvier à avril, et les mâles diminuent alors leur consommation de nourriture de façon spectaculaire. Les femelles ovulent dès l'âge de 4 ou 6 ans[16]. Elles connaissent plusieurs œstrus, entrant en chaleur en fin d'été ainsi que vers février, mais les mâles sont uniquement fertiles en février ; le potentiel de fécondité en été est inconnu. L'accouplement a lieu de janvier à mars, mais plus généralement en février.
Les populations du Pacifique adoptent un comportement relativement placide, où les mâles se regroupent dans l'eau autour des blocs de glace où s'entassent les femelles en œstrus et se concurrencent en prestations vocales[42], utilisant leurs poches d'air pharyngiennes pour produire des sons de cloche ou des cliquetis qui séduiront les femelles ou impressionneront les concurrents[23]. Les femelles les rejoignent, et les partenaires s'accouplent alors dans l'eau[27]. Chez la sous-espèce atlantique, un mâle possède généralement un harem composé d'une vingtaine de femelles, sur lequel il veille jalousement. Les vocalisations sont moins utilisées, et les mâles se montrent très territoriaux, combattant tout rival, l'abandon d'un des protagonistes ou le premier sang versé suffisant généralement à clore la lutte[23]. Les plus faibles ne se reproduiront pas, et la pratique masturbatoire est observée[43].
De la gestation au sevrage
La gestation dure de quinze à seize mois durant lesquels la femelle augmente son alimentation de 30 à 40 %[14]. Les trois ou quatre premiers mois, l'embryon suspend son développement et demeure sous forme de blastocyste, avant de s'implanter dans l'utérus. Cette stratégie d'implantation différée, forme de diapause, est fréquente chez les pinnipèdes et optimise à la fois la saison des amours et celle des naissances. Son évolution fut déterminée par les conditions climatiques qui favorisent la survie des nouveau-nés[44], et son rythme est probablement en partie régi par le photopériodisme[45]. Le petit perd son lanugo trois mois avant de naître. La mise-bas a lieu durant la migration du printemps, d'avril à juin. La mère accouche sur la terre ferme ou sur la banquise d'un seul petit, les jumeaux étant rares. Le petit, parfois appelé « veau », pèse entre 50 et 75 kg[18], pour une moyenne de 63 kg et une longueur proche du mètre[19]. Le veau est gris argenté avec les nageoires gris foncé, mais prend au bout d'une à deux semaines une couleur brune[14], subissant une seconde mue au début de son premier été extra-utérin[21], puis muera toutes les fins d'été pour les mâles, ou de manière plus espacée pour les femelles[14]. Il est apte à nager dès sa naissance. Le lait maternel est composé de 60 % d'eau, 30 % de matières grasses et 5 à 10 % de protéines, et peut-être complété de nourriture solide dès le sixième mois. En captivité, les petits consomment environ neuf litres de lait par jour, mais dans la nature ce volume n'a pas été évalué[14]. À l'âge d'un an, le petit pèse déjà 200 kg[23].
Les petits se retrouvant orphelins peuvent parfois être adoptés[30]. Les mères s'occupent des petits pendant plus d'un an avant le sevrage, mais les jeunes peuvent passer jusqu'à trois à cinq ans aux côtés de leur mère[27]. Le jeune forme ensuite son propre groupe et intègre les grands rassemblements aux alentours de ses 9 ans. Dans la nature, les morses vivent entre 20 et 30 ans[46]. La stratégie de reproduction du morse est différente des autres pinnipèdes : les femelles s'occupent de leur petit exceptionnellement longtemps, et étant donné que l'ovulation est stoppée jusqu'au sevrage du petit, elles donnent naissance au maximum tous les deux ans, la fréquence diminuant avec l'âge, faisant du morse le pinnipède au taux de reproduction le plus faible[47].
Répartition et habitat

Répartition géographique
La plus grande partie de la population du Pacifique passe l'été au nord du détroit de Béring, dans la mer des Tchouktches et dans la mer de Beaufort, entre l'est de la Sibérie, près de l'île Wrangel, et le nord de l'Alaska. Certains mâles, moins nombreux, passent l'été dans le golfe d'Anadyr, sur la rive sud de la péninsule Tchouktche et dans la baie de Bristol à l'ouest de la péninsule d'Alaska. Au printemps et en automne, ils se rassemblent dans le détroit de Béring, rejoignant le golfe d'Anadyr depuis la côte ouest de l'Alaska. Ils passent l'hiver dans la mer de Béring, le long de la rive orientale de la Sibérie, au sud, jusqu'à la partie nord de la péninsule du Kamtchatka, et le long de la rive sud de l'Alaska[16]. Un spécimen fossile vieux de vingt-huit mille ans a été dragué dans la baie de San Francisco, indiquant que le morse du Pacifique vivait loin vers le sud au cours de la dernière glaciation[48].
La population de la sous-espèce type, comprenant moins de membres, occupe l'Arctique canadien, le Groenland, le Svalbard et la partie occidentale de l'Arctique russe. On estime qu'il y a huit sous-populations, principalement distinguées par leurs répartitions géographiques et leurs déplacements. Cinq vivent à l'ouest du Groenland et les trois autres à l'est[49]. Autrefois, le morse de l'Atlantique vivait au sud jusqu'au cap Cod et se trouvait en grand nombre dans le golfe du Saint-Laurent. En , le Canadian Species at Risk Act liste la population de morses de l'Atlantique du Nord-Est du pays (Québec, Nouveau-Brunswick, Nouvelle-Écosse, Terre-Neuve et Labrador) comme ayant disparu du Canada[50].
La population isolée de Laptev est confinée à longueur d'année dans les régions centrales et occidentales de la mer du même nom, dans les régions les plus à l'Est de la mer de Kara, et dans les régions les plus à l'ouest de la mer de Sibérie orientale.
Très rarement, de rares morses isolés sont observés dans les îles britanniques, jusqu'au pays de Galles[51]. Été 2022, un morse a eté observé dans la mer Baltique, jusqu'au Golfe de Finlande. <https://news.err.ee/1608648100/walrus-spotted-on-latvian-beach> News.err.ee 5 July 2022 <https://yle.fi/news/3-12538568> Yle News 15 July 2022
Répartition passée
Le Morse a disparu d'Islande aux alentours du IXe siècle à la suite de l'installation des Vikings[52]. Il a disparu de l'île aux Ours au XIXe siècle[52].
Historiquement, les populations ont également été observées bien plus au sud, en Amérique du Nord jusqu'en Acadie et les îles de la Madeleine et en Europe jusque sur les côtes des Pays-Bas, des îles Britanniques et de Belgique[21],[11].
Biotope et migrations

Sa capacité de plongée étant limitée, le morse est dépendant des eaux peu profondes et aux berges couvertes de glace pour lui permettre d'aller chercher ses proies benthiques favorites. Il peut supporter des températures allant de −35 °C à 15 °C, restant dans l'eau lorsque la température excède cette valeur[14].
En dehors de la saison des amours et de gestation, c'est-à-dire à la fin de l'été et en automne, les morses forment des colonies de plusieurs dizaines de milliers d'individus sur les plages ou les affleurements rocheux. Ils sont contraints à suivre tour à tour l'expansion puis le recul de la banquise, les femelles et les jeunes demeurant sur la glace en toute saison, les mâles reproducteurs préférant passer l'été sur les côtes et îlots rocheux[40]. La migration peut être longue et spectaculaire. À la fin du printemps et en été, par exemple, plusieurs centaines de milliers de morses du Pacifique migrent de la mer de Béring à la mer des Tchouktches à travers l'étroit détroit de Béring[27]. Souvent les mâles restent dans le Sud, seuls les femelles et les jeunes migrant. Certains individus peuvent parcourir plus de trois mille kilomètres par an[21].
Taxinomie
Descriptions et systématique
Le morse a été décrit pour la première fois en 1758 par le naturaliste suédois Carl von Linné dans la dixième édition de son Systema naturæ, sous le protonyme latin de Phoca roſmarus[9]. En 1762, Mathurin Jacques Brisson place l'animal dans le genre Odobenus. En 1766 paraît la douzième édition du Systema naturae, dans laquelle Linné déplace l'animal aux côtés des lamantins dans le genre Trichechus, sous le nom de Trichechus rosmarus[53], n'adoptant pas le genre Odobenus de Brisson. D'autres taxons du genre Trichechus, créés pour désigner le morse, ajouteront à la confusion. De son côté, Giovanni Antonio Scopoli crée en 1777 pour cet animal le genre Rosmarus[54], quelquefois attribué à Morten Thrane Brünnich[55], que Theodore Nicholas Gill inclut en 1866 dans une certaine famille des Rosmaridae, et Carl Jakob Sundevall nomme en 1860 le genre Hodobaenus. Enfin, il existe d'autres taxons placés dans le genre Odobenus correspondant parfois à l'espèce ou bien à une sous-espèce particulière ainsi que quelques cacographies[alpha 6]. Tous ces taxons sont dorénavant considérés comme synonymes de l'espèce ou d'une sous-espèce particulière, mais non valides, comme les noms binomiaux listés ci-après :
- Binômes désuets, synonymies et taxons incertains
- Phoca rosmarus Linnaeus, 1758, le protonyme[9] ;
- Rosmarus arcticus Pallas, 1811[56],[57], synonyme d'O. r. rosmarus[16] ;
- Trichechus divergens Illiger, 1815[58] ;
- Odobenus divergens (Illiger, 1815), devenu une simple sous-espèce, O. r. divergens[58] ;
- Trichechus obesus Illiger, 1815, nomen nudum, désignerait la sous-espèce du Pacifique (O. r. divergens)[7] ;
- Odobaenus obesus (Illiger, 1815) pour laquelle fut même distinguée une sous-espèce du Pléistocène aujourd'hui fossile O. o. antiquus Kardas, 1965[59] ;
- Trichechus longidens Frémery, 1831, description probablement basée sur un crâne de femelle de la sous-espèce atlantique[7] ;
- Trichechus cookii Frémery, 1831, synonyme de O. r. divergens[16] ;
- Odobenus virginianus ou Trichechus virginianus De Kay, 1842[60] ;
- Trichechus orientalis Dybowski, 1922[60], nomen nudum mais peut-être synonyme d'O. r. laptevi[61].
Histoire évolutive

Le morse est un mammifère de l'ordre des Carnivora. Il est l'unique survivant de la famille des Odobenidae, qui constituait l'une des trois lignées de l'ancien sous-ordre des pinnipèdes, aux côtés des Phocidae et des Otariidae. Ce sous-ordre est globalement considéré comme ne formant pas un clade monophylétique, c'est-à-dire que ses représentants ne descendraient pas d'un ancêtre unique. Des récentes études génétiques suggèrent que les trois familles descendent d'un ancêtre du sous-ordre des Caniformia, et peu éloigné de celui des ours modernes[62]. Une incertitude demeure cependant quant à savoir si au sein du sous-ordre, lesquels des odobenidés ou des phocidés ont divergé en premier des otariidés[62], bien qu'une étude de synthèse de données moléculaires de 2006 suggère que les phocidés ont été les premiers à diverger[63]. Les Odobenidae constituaient il y a 10 millions d'années une famille plus répandue que tous les autres pinnipèdes et aux formes variées[21], comprenant au moins une vingtaine d'espèces[64]. La caractéristique distinctive principale de ses membres était le développement d'une méthode d'alimentation par aspiration et jet d'eau ; les défenses sont une caractéristique spécifique des seuls Odobeninae.
Sous-espèces

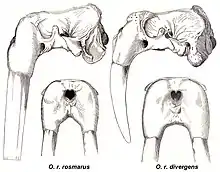
Deux sous-espèces sont unanimement reconnues : le morse de l'Atlantique, O. r. rosmarus (Linnaeus, 1758), la sous-espèce type, relativement petite ; le morse du Pacifique, O. r. divergens (Illiger, 1815), sous-espèce plus grosse et massive, divergens venant du latin, signifiant « tournant indépendamment » et fait allusion à l'orientation des défenses. Les différences génomiques entre les sous-espèces de l'Atlantique et Pacifique indiquent un flux génétique très restreint, mais une séparation relativement récente, qu'on estime remonter à entre 500 000 et 785 000 ans[65]. Ces dates coïncident avec l'hypothèse selon laquelle le morse aurait évolué depuis un ancêtre des climats subtropicaux ou tropicaux, dont une partie se serait retrouvée isolée dans l'océan Atlantique, et se serait progressivement adaptée aux conditions plus froides de l'Arctique, tandis que l'autre périclitait pour finalement disparaître[65]. De là, le morse aurait pu coloniser à nouveau le Pacifique nord durant les périodes de forte glaciation du Pléistocène, en empruntant le passage séparant les deux Amériques du temps de la Pangée[63], près du Panama actuel. Mammal Species of the World[66] ainsi que certains biologistes russes[67] considèrent la population isolée dans la mer des Laptev comme une troisième sous-espèce, O. r. laptevi (Chapskii, 1940), de taille intermédiaire à celle des deux autres sous-espèces[14]. Les auteurs qui réfutent la validité de cette sous-espèce ont discuté de son appartenance à l'une ou à l'autre des deux autres sous-espèces[16],[68], mais une étude génétique de 2008 a rapproché les populations de Laptev de la sous-espèce du Pacifique[69].
Le morse et l'Homme
Chasse au morse


Historiquement, les Vikings furent les premiers Européens à chasser le morse pour son ivoire. Ils trouvaient les animaux en nombre au Groenland et autour de la mer Blanche, et utilisaient leur « or blanc » pour fabriquer divers objets de luxe tels que des peignes, des crucifix ou des pièces de jeu d'échecs[70]. L'exploitation est telle que les morses chassés sont au fil du temps de plus en plus petits et vivent de plus en plus au nord[52].
Le morse fut fortement exploité par les chasseurs de phoques et de baleines américains et européens pour sa graisse et son ivoire. Aux XVIe et XVIIe siècles, plusieurs milliers de morses étaient tués chaque année. L'animal vivait jusqu'au cap Cod et dans le golfe du Saint-Laurent, où il n'est plus aujourd'hui que sporadique[71]. En effet, au cours des XVIe et XVIIe siècles, les populations de morses du Labrador sont exterminées, poussant l'homme à aller les chasser de plus en plus loin. Entre 1861 et 1863, moins d'un millier de morses sont tués, pour l'exportation de 4 800 kg d'ivoire par an[21]. En 1867 lorsque les Américains achètent l'Alaska aux Russes, l'exploitation de l'animal s'accélère : de 1869 à 1879 ce sont douze mille morses qui alimentent chaque année le marché mondial. À la fin du XIXe siècle, les autorités américaines freinent la chasse, mais les populations connaissent un maigre répit : en effet vers 1930, c'est l'URSS qui entame à son tour la chasse de l'animal. De 1925 à 1931, on a estimé que sur les seules côtes de l'île de Baffin au Canada, environ cent soixante-quinze mille morses furent tués, et bien que ce chiffre soit contesté[72], il n'en reste pas moins que les populations atlantiques furent menées au bord de l'extinction[73].
La sous-espèce du Pacifique ne fut victime de la chasse que plus tard, et ses effectifs n'ont pas frôlé de seuil critique, les États-Unis et la Russie ayant pris des mesures protectrices afin de reconstituer les populations dès les années 1960. La chasse commerciale des morses est désormais interdite dans toute l'aire de répartition de l'animal.
Statut de conservation
Il est classé à partir de 1996 par l'UICN en LC (préoccupation mineure), en 2008 son statut est revu et changé en DD (données insuffisantes). En 2016 son statut est de nouveau modifié, il est alors classé VU (vulnérable)[1]. Le dernier recensement global de morses du Pacifique, par voie aérienne, date de 1990 et estimait l'effectif de la sous-espèce à deux cent mille individus[74],[75]. La population du morse de l'Atlantique, qui s'est moins bien remise de son passé malheureux, est beaucoup plus petite. Bien qu'il soit difficile d'avoir de bonnes estimations, la population totale est probablement inférieure à vingt mille individus[76],[77]. L'Endangered Species Act ne considère l'espèce ni « menacée » ni « en danger ». L'état russe classe cependant le morse du Pacifique comme « en déclin » et les populations de la mer de Laptev comme « rares »[78], car elles ne comptent que de cinq à dix mille individus[78]. Le COSEPAC, organisme canadien, considère le morse de l'Atlantique comme au statut « préoccupant »[79]. Enfin, le commerce mondial de l'ivoire de morse est soumis aux restrictions dictées par l'annexe III de la CITES et ne provient que des morses tués par les autochtones, quand il n'est pas utilisé pour l'artisanat local[80],[81].
La chasse du morse est réglementée par des plans de gestion des ressources en Russie, aux États-Unis, au Canada et au Danemark (comprenant le Groenland) et par les représentants des communautés de chasseurs respectives. Chaque année, de quatre à sept mille morses du Pacifique sont tués en Alaska et en Russie dans un cadre alimentaire, dont 42 % d'animaux blessés ou égarés[82]. Seules plusieurs centaines de morses sont abattues chaque année autour du Groenland et dans l'Est du Canada, les populations atlantiques étant numériquement plus faibles et donc plus fragiles[83]. L'impact de cette chasse est difficile à mesurer étant donné l'imprécision des données démographiques et des paramètres tels que la fécondité et la mortalité[82]. Aux États-Unis, le morse est protégé par le Marine Mammal Protection Act (MMPA).
Menaces actuelles

Les Tchouktches, les Yupiks et les Inuits[84] continuent de tuer de petits nombres de morses vers la fin de chaque été. Cette chasse fait partie de leurs traditions, et toutes les parties du morse sont utilisées[85] : la viande, souvent conservée, est une importante source de nourriture pour l'hiver ; les nageoires sont mises à fermenter et sont stockées comme un mets délicat jusqu'au printemps[86],[21] ; défenses et os forment une matière première dans l'artisanat et étaient même autrefois utilisés dans la fabrication d'outils ; l'huile (ou la graisse) servait au chauffage et à l'éclairage ; la peau dure était utilisée pour fabriquer corde et revêtements des maisons et bateaux ; les intestins permettaient la confection de parkas imperméables, les vibrisses peuvent même servir de cure-dents. Le long os pénien, localement appelé oosik était également, comme ceux d'autres mammifères, utilisés par les autochtones pour fabriquer étuis à couteau et piquets de tente[18]. Certaines de ces utilisations se sont perdues avec l'arrivée de technologies de remplacement, mais la viande de morse constitue toujours une part importante de l'alimentation locale, couvrant près de la moitié des besoins en protéines aux côtés des viandes de phoques barbus, phoques annelés et des cétacés[87],[88]. Parallèlement le braconnage pour le précieux ivoire persiste toujours[21].
Les effets du réchauffement climatique planétaire sont plus préoccupants. La surface et l'épaisseur de la banquise a atteint des niveaux exceptionnellement bas depuis le début du XXIe siècle. Le morse a besoin de cette glace, notamment pour la mise-bas et lors des regroupements en colonies pour la période de reproduction. Le recul de la banquise sur la mer de Béring entraîne la régression des zones de repos proches des secteurs d'alimentation. Il a aussi pour effet de forcer les femelles allaitantes à faire de plus longs trajets pour s'alimenter, et donc de laisser leurs veaux plus longtemps seuls, ce qui a pour effet d'augmenter le stress nutritionnel chez les jeunes et ainsi de diminuer les taux de reproduction[89]. La réduction de surface de la glace côtière est également impliquée dans l'augmentation substantielle du nombre de morses morts par écrasement, victimes d'une foule qui doit s'entasser de plus en plus le long des rivages de la mer des Tchouktches, entre l'Est de la Russie et l'Ouest de l'Alaska[90],[91],[92]. De même la hausse des températures de la mer est susceptible d'avoir un impact sur les proies du morse. Toutefois, les données climatiques sont insuffisantes pour faire des prévisions fiables sur l'évolution démographique de l'espèce. Enfin des effets plus directs de l'action de l'Homme sont à considérer, comme la surpêche mais surtout les catastrophes environnementales et la pollution marine telles que les marées noires : cette pollution cause des problèmes de santé par inhalation des vapeurs ou des irritations par contact cutané, mais induit également l'accumulation des hydrocarbures lourds au fond de la mer, et donc dans les peuplements de bivalves, réduisant d'autant les zones de prospection du morse[93]. Enfin, il convient de mentionner le dérangement des colonies de morses par l'homme, notamment la pollution sonore, comme les bateaux, semant la panique dans les colonies, ou comme les aéroports et le bruit de leurs avions[19].
Aspects culturels
Durant le Moyen Âge, la similarité de sonorité entre les termes latins morsus, mors i.e. la mort, et mordere i.e. mordre a donné une réputation de monstre terrifiant à l'animal[7].
Peuples autochtones

Le morse joue un rôle important dans la religion et le folklore de nombreux peuples de l'Arctique. La peau et les os sont utilisés dans certaines cérémonies et l'animal figure dans nombre de légendes. Par exemple, dans une version tchouktche du mythe répandu du Corbeau créateur du monde, le corbeau Kutkh récupère le soleil et la lune en séduisant la fille d'un mauvais esprit. Le père en colère pousse celle-ci du sommet d'une haute falaise et, tombant dans l'eau, elle se transforme en un morse. Selon diverses légendes, les défenses sont formées soit par les traces du mucus nasal de la jeune fille en pleurs ou par ses longues tresses[94]. Ce mythe tchouktche est peut-être lié à celui de la vieille femme à tête de morse régnant au fond de la mer, qui est lui-même lié à la déesse inuite Sedna. Tant dans la péninsule Tchouktche qu'en Alaska, les aurores boréales sont considérées comme le monde particulier où vivent ceux que la violence a tués, les rayons changeants représentant les âmes des défunts jouant comme au ballon avec la tête d'un morse[95]. Un autre conte esquimau narre la lutte entre le morse et le renne : le premier se vantait de pouvoir tirer le cervidé dans l'eau, mais, s'attachant l'un à l'autre par une corde autour de leur taille, c'est le renne qui tira le morse au loin vers l'intérieur des côtes[94].
De nombreux peuples arctiques, tel les Tchouktches et les Inuits du Canada, utilisent les défenses de morse pour la confection d'objets d'arts en ivoire, ainsi que des armes, artisanat profondément ancré dans leurs traditions.
Dans l'art et la culture populaire

La « bête à grande dents », comme l'appelaient les marins, a longtemps été décrite comme un danger pour les embarcations. L'animal était, aux yeux des peuples autochtones de l'Arctique, le plus dangereux de tous[23]. Il eut en effet la réputation de s'aider de ses défenses afin de faire chavirer les petits bateaux, parfois même en groupes, tout en mugissant, et poursuivant autant que possible les embarcations[96], comme le narre par exemple le navigateur hollandais Zorgdrager[11]. Pourtant l'animal est plutôt calme et relativement insensible à la présence humaine, même si des cas de confrontations ont été observés[97].

En raison de son apparence facilement reconnaissable, de sa carrure, de ses moustaches et défenses très distinctives, le morse apparaît également dans les cultures populaires d'autres peuples, notamment dans la littérature enfantine anglaise. Les représentations de morses restées célèbres sont toujours des personnages de second rôle.
En littérature et au cinéma, son apparition la plus connue est peut-être celle du poème fantaisiste de Lewis Carroll intitulé Le Morse et le Charpentier (The Walrus and the Carpenter dans sa version originale), figurant dans son roman de 1871 intitulé De l'autre côté du miroir (Through the Looking-Glass). Ce poème, où l'antihéros éponyme utilise sa ruse pour manger un grand nombre d'huîtres, est également repris dans le film d'animation des studios Disney de 1951 Alice au pays des merveilles. Bien que Carroll décrit le morse consommant les mollusques bivalves des littoraux et des estrans, ceux-ci ne constituent en réalité qu'une partie insignifiante de son alimentation, même en captivité[98].
.jpg.webp)
Wally Walrus, un personnage des dessins animés de la Walter Lantz Productions est devenu aussi célèbre. Le morse apparaît également dans la littérature dans un des épisodes du Livre de la jungle de Rudyard Kipling intitulé Le phoque blanc (The White Seal), où il est décrit comme le « vieux Sea Vitch, le gros vilain morse bouffi et dartreux du Nord Pacifique, au col épais et aux longues défenses, qui n'a de bonnes manières que lorsqu'il dort »[99]. Toujours dans la littérature, Wal Russ, est le compagnon de Rocket Raccoon, créé par Bill Mantlo et Keith Giffen dans les premiers comics où ce dernier apparaît, originaire d'Halfworld il s'agit d'un inventeur bricoleur qui remplace ses défenses par des prothèses en tout genre (tournevis, perceuse ou pistolet laser). Dans La Petite Sirène 2 : Retour à l'océan de Disney, apparait un morse nommé Flash. On le retrouve également dans la chanson chez les Beatles et leur I Am the Walrus (en français Je suis le Morse) inspiré du poème de Lewis Carroll, ou en philatélie sur de nombreux timbres, notamment édités par les gouvernements canadiens mais également par l'U.R.S.S., la Bulgarie ou encore le Mali[100].
L'expression « moustache de morse » est utilisée pour désigner les moustaches importantes et broussailleuses, comme celles du joueur de hockey Lanny McDonald ou du professeur Horace Slughorn, personnage fictif de la saga Harry Potter.
Certains spécimens de morses ont également acquis une certaine célébrité, comme Antje, mascotte de la Norddeutscher Rundfunk qui logeait au Tierpark Hagenbeck, parc zoologique de Hambourg, ou encore Tanja, morse femelle du zoo de Hanovre euthanasiée en 2007 à 33 ans, car souffrant de sa vieillesse.
Notes et références
Notes
- Le nom de l'animal prend une majuscule initiale quand le mot désigne l'espèce, mais une minuscule quand il désigne un ou plusieurs individus précis. Exemples : « le Morse est une espèce de mammifères dont la taille…» ; « de nombreux morses sont présents sur cette plage ».
- « Rosmarus est bellua marina, ad magnitudinem Elephantis. Littorum montes scandit et gramine pascitur. Somni gracia dentibus se a rup suspendit, et adeo profundet dormit, ut piscatores laqueis et funibus victum comprehendant », comme cité dans Ambroise Paré, Des Monstres Et Prodiges, , 283 p. (ISBN 978-2-600-03034-2, lire en ligne), p. 190.
- Il ne peut s'agir d'une racine latine, le terme marin étant marinus en latin.
- Comme dans l'Encyclopédie ou Dictionnaire raisonné des sciences, des arts et des métiers, l'Histoire naturelle de Buffon[11] ou Le Pays des fourrures de Jules Verne.
- Cette formule dentaire est la plus communément retrouvée car les morses présentent rarement une denture complète, qui comporterait 38 dents[16].
- On pourra relever le Odobenus dérivé en Ordobenus[56] ou en Odobaenus[54],[7], ainsi que Trichechus parfois orthographié Trichecus.
Références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Walrus » (voir la liste des auteurs) et en allemand « Walross » (voir la liste des auteurs).
- UICN, consulté en 2010.
- Définitions lexicographiques et étymologiques de « Morse » dans le Trésor de la langue française informatisé, sur le site du Centre national de ressources textuelles et lexicales
- (fr) Henriette Walter et Gérard Walter, Dictionnaire des Mots d'origine étrangère, éditions Larousse, , 427 p. (ISBN 978-2-03-584564-1)
- (de) Niels Åge Nielsen, Dansk Etymologisk Ordbog, Gyldendal,
- (en) Define Walrus at Dictionary.com
- (en) « Etymology of mammal names », sur iberianature.com
- (en) Joel Asaph Allen, History of North American pinnipeds, , 785 p. (ISBN 978-0-405-05702-1, lire en ligne), p. 5-186
- (fr) Dictionnaire le Littré, « morse » (consulté le )
- (la) Carl von Linnaeus, Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis, t. I, Holmiae (Laurentii Salvii), , 10e éd., 824 p. (lire en ligne [PDF]), p. 38 « P. dentibus laniariis ſuperioribus exſertis. »
- Linsay Knight, Grands mammifères, Paris, éditions Bordas, coll. « À la découverte des animaux », , 68 p. (ISBN 2-7434-4828-8), p. 36.
- (fr) Georges-Louis Leclerc de Buffon et Charles-Sigisbert Sonnini, Histoire naturelle, générale et particulière, , 524 p. (lire en ligne), p. 158-183
- (fr) Jean-Emmanuel Gilibert, Abrégé du système de la nature de Linné, Histoire des mammaires ou des quadrupèdes & cétacés, (lire en ligne)
- (fr) Anselme Gaëtan Desmarest, Mammalogie ou description des espèces de mammifères, vol. 1, coll. « Encyclopédie méthodique ou par ordre de matières - Mammalogie ou description des espèces de mammifères », (lire en ligne)
- [PDF](en) « Walruses - A seaworld education department publication », Sea World,
- Daniel Robineau, Phoques de France, Fédération Française des Sociétés des Sciences Naturelles, , p. 31.
- [PDF](en) Francis Hollis Fay, « Odobenus rosmarus », Mammalian Species, vol. 238, no 238, , p. 1–7 (DOI 10.2307/3503810, lire en ligne, consulté le )
- (fr) Anselme Gaëtan Desmarest, Mammalogie, ou, Description des espèces de mammifères, vol. 2, , 555 p. (lire en ligne), p. 252-254
- (fr) Jean-Pierre Fleury et Arnaud Filleul, « Le morse, géant de la banquise », sur pratique.fr, (consulté le )
- (fr) ROMM (Réseau d'observation de mammifères marins), « Morse de l'Atlantique - Odobenus rosmarus rosmarus » (consulté le )
- (en) « Walrus - Odobenus rosmarus » (consulté le )
- (fr) Encyclopédie Larousse, « morse », sur Larousse.fr
- [PDF](de) « Handbuch des Nordpazifiks », sur polartravel.de (consulté le ), p. 26-27
- (fr) Guillaume Rondelet, « Morses : La plage aux romantiques », Terre sauvage, Paris, Nuit et Jour, no 32, , p. 30-41
- (fr) « Morse », sur Terra Nova, (consulté le )
- (en) Annalisa Berta et James L. Sumich, Marine mammals : evolutionary biology, San Diego, Academic Press, , 494 p. (ISBN 978-0-12-093225-2, lire en ligne), p. 315
- [PDF](fr) Edgard O. Espinoza et Mary-Jacque Mann, « Guide d'identification de l'ivoire et de ses substituts », WWF, Traffic et CITES
- (en) Francis Hollis Fay, « Ecology and Biology of the Pacific Walrus, Odobenus rosmarus divergens Illiger », United States Department of the Interior, Fish and Wildlife Service,
- (en) G. Carleton Ray, Jerry McCormick-Ray, Peter Berg et Howard E. Epstein, « Pacific Walrus: Benthic bioturbator of Beringia », Journal of Experimental Marine Biology and Ecology, vol. 330, , p. 403–419 (DOI 10.1016/j.jembe.2005.12.043)
- (en) Ronald A. Kastelein, S. Stevens et Piet Mosterd, « The sensitivity of the vibrissae of a Pacific Walrus (Odobenus rosmarus divergens). Part 2: Masking », Aquatic Mammals, vol. 16, no 2, , p. 78–87
- ADW, consulté en 2010
- [PDF](en) Joy S. Reidenberg, « Anatomical Adaptations of Aquatic Mammals », The Anatomical Record, New York, no 290, , p. 507–513 (lire en ligne)
- (en) Jason F. Schreer, Kit M. Kovacs et R. J. O'Hara Hines, « Comparative diving patterns of pinnipeds and seabirds », Ecological Monographs, vol. 71, , p. 137–162 (DOI 10.1890/0012-9615(2001)071[0137:CDPOPA]2.0.CO;2)
- (en) Gay Sheffield, Francis Hollis Fay, Howard Feder et Brendan P. Kelly, « Laboratory digestion of prey and interpretation of walrus stomach contents », Marine Mammal Science, vol. 17, , p. 310–330 (DOI 10.1111/j.1748-7692.2001.tb01273.x)
- (en) Nette Levermann, Anders Galatius, Goran Ehlme, Soren Rysgaard et Erik W. Born, « Feeding behaviour of free-ranging walruses with notes on apparent dextrality of flipper use », BMC Ecology, vol. 3, no 9, , p. 9 (DOI 10.1186/1472-6785-3-9, lire en ligne)
- (en) L.F. Lowry et K.J. Frost, The Eastern Bering Sea Shelf : Oceanography & Resources, vol. 2, University of Washington Press, , 813–824 p., « Feeding and Trophic Relationships of Phocid Seals and walruses in the Eastern Bering Sea »
- (en) Mark L. Mallory, Kerry Woo, Anthony J. Gaston, W. Eric Davies et Pierre Mineau, « Walrus (Odobenus rosmarus) predation on adult thick-billed murres (Uria lomvia) at Coats Island, Nunavut, Canada », Polar Research, vol. 23, no 1, , p. 111–114 (DOI 10.1111/j.1751-8369.2004.tb00133.x)
- (en) Edoardo Pozi, « New patterns of Trichinella infection », Veterinary Parasitology, vol. 98, nos 1-3, , p. 133-148 (DOI 10.1016/S0304-4017(01)00427-7)
- (fr) Alain Zasadzinski, « Les morses et le réchauffement climatique : un risque sanitaire accru pour les hommes de l’Arctique ? », INIST (CNRS), (consulté le )
- (fr) « Carnets d'histoire naturelle », Musée canadien de la nature
- (en) Encyclopedia of Life, « Odobenus rosmarus (Linnaeus, 1758) » (consulté le )
- (en) Nikita Ovsyanikov, « Ursus ubiquitous », BBC Wildlife, vol. 10, no 12, , p. 18–26
- (en) S.N. Nowicki, Ian Stirling et Becky Sjare, « Duration of stereotypes underwater vocal displays by make Atlantic walruses in relation to aerobic dive limit », Marine Mammal Science, vol. 13, no 4, , p. 566–575 (DOI 10.1111/j.1748-7692.1997.tb00084.x)
- (fr) « Morses : Les uns sur les autres », Terre sauvage, Paris, Nuit et Jour « Gestes d'amour : La tendresse et les rites amoureux chez les mammifères marins », no 2 hors-série, , p. 24-27
- (en) Mikael Sandell, « The Evolution of Seasonal Delayed Implantation », The Quarterly Review of Biology, vol. 65, no 1, , p. 23–42 (PMID 2186428, DOI 10.1086/416583)
- (fr) ROMM (Réseau d'observation de mammifères marins), « Biologie des phoques » (consulté le )
- (en) Francis Hollis Fay, « Carnivorous walrus and some arctic zoonoses », Arctic, vol. 13, no 2, , p. 111-122
- (en) Peter G.H. Evans et Juan Antonio Raga, Marine mammals : biology and conservation, Londres & New York, Kluwer Academic/Plenum Press,
- (en) Arthur S. Dyke, James Hooper, C. Richard Harington et James M. Savelle, « The Late Wisconsinan and Holocene record of walrus (Odobenus rosmarus) from North America: A review with new data from Arctic and Atlantic Canada », Arctic, vol. 52, , p. 160–181
- (en) Erik W. Born, Liselotte Wesley Andersen, Ian Gjertz et Øystein Wiig, « A review of the genetic relationships of Atlantic walrus (Odobenus rosmarus rosmarus) east and west of Greenland », Polar Biology, vol. 24, , p. 713–718 (DOI 10.1007/s003000100277)
- (en) Fisheries and Oceans Canada, « Atlantic Walrus: Northwest Atlantic Population »
- (en) « Walrus spotted in Wales, days after one seen off Ireland », sur bbc.com, .
- (en) James H. Barrett, SanneBoessenkool et al., « Ecological globalisation, serial depletion and the medieval trade of walrus rostra », Quaternary Science Reviews, vol. 229, (lire en ligne).
- (la) Carl von Linnaeus, Systema naturae per regna tria naturae, secundum classes, ordines, genera, species, cum characteribus, differentiis, synonymis, locis, t. I, Holmiae (Laurentii Salvii), , 12e éd. (lire en ligne), p. 49
- (en) Gerrit Smith Miller, Key to the land mammals of northeastern North America, , 160 p. (lire en ligne), p. 120
- (en) « Odobenus Brisson, 1762 », (consulté le ).
- (en) Peter Simon Pallas, « Zoographia Rosso-Asiatica, sistens omnium Animalium in extenso Imperio Rossico et adjacentibus maribus observatorum recensionem, domicillia, mores et descriptiones, anatomen atque icones plurimorum », Imper. Acad. Sci., Petersburg, no 1, 1811 [1831], p. 269 (lire en ligne)
- (en) Référence Mammal Species of the World (3e éd., 2005) : Odobenus rosmarus rosmarus (Linnaeus, 1758)
- (en) « Odobenus rosmarus divergens Illiger 1815 », sur The Paleobiology Database (consulté le ).
- (en) « Classification of Subspecies: Odobenus obesus antiquus », sur GBIF (Global Biodiversity Information Facilities) (consulté le )
- (en) « Odobenus rosmarus Linnaeus 1758 », sur The Paleobiology Database (consulté le )
- (en) « Mikko's Phylogeny Archive : Odobenidae – walrusies » (consulté le ).
- (en) Gina M. Lento, Robert E. Hickson, Geoffrey K. Chambers et David Penny, « Use of spectral analysis to test hypotheses on the origin of pinnipeds », Molecular Biology and Evolution, Oxford University Press, vol. 12, no 1, , p. 28–52.
- (en) Ulfur Arnason, Anette Gullberg, Axel Janke, Morgan Kullberg, Niles Lehmanb, Evgeny A. Petrovc et Risto Väinöläd, « Pinniped phylogeny and a new hypothesis for their origin and dispersal », Molecular Phylogenetics and Evolution, vol. 41, no 2, , p. 345–354 (PMID 16815048, DOI 10.1016/j.ympev.2006.05.022)
- (en) Naoki Kohno, « A new Miocene Odobenid (Mammalia: Carnivora) from Hokkaido, Japan, and its implications for odobenid phylogeny », Journal of Vertebrate Paleontology, vol. 26, no 2, , p. 411 (DOI 10.1671/0272-4634(2006)26[411:ANMOMC]2.0.CO;2)
- (en) A. Rus Hoelzel, Marine mammal biology : an evolutionary approach, Oxford, Wiley-Blackwell, , 432 p. (ISBN 0-632-05232-5)
- MSW, consulté en 2010
- (en) K.K. Chapskii, « Distribution of the walrus in the Laptev and East Siberian seas », Problemy Severa, no 6, , p. 80–94
- (en) Erik W. Born, Ian Gjertz et Randall R. Reeves, Population assessment of Atlantic Walrus (Odobenus rosmarus rosmarus L.), Oslo, Norway, Meddelelser. Norsk Polarinstitut, , p. 100
- (en) Charlotte Lindqvist, Lutz Bachmann, Liselotte W. Andersen, Erik W. Born, Ulfur Arnason, Kit M. Kovacs, Christian Lydersen, Alexei V. Abramov et Øystein Wiig, « The Laptev Sea walrus Odobenus rosmarus laptevi: an enigma revisited », Zoologica Scripta, vol. 38, no 2, , p. 113-127 (DOI 10.1111/j.1463-6409.2008.00364.x)
- (fr) Lisa Garnier, « Byzance et les Vikings, un pan de l'histoire reste à explorer », Cahiers de Sciences et Vie « Vikings : enquête sur les secrets des maîtres des mers », no 80, , p. 93
- (fr) ROMM (Réseau d'observation de mammifères marins), « Les phoques et le morse de l'Atlantique »
- (en) P.R. Richard et R.R. Campbell, « Status of the Atlantic walrus, Odobenus rosmarus rosmarus, in Canada », Canadian Field-Naturalist, no 102, , p. 337-350
- (en) John Roberts Bockstoce et Daniel B. Botkin, « The Harvest of Pacific Walruses by the Pelagic Whaling Industry, 1848 to 1914 », Arctic and Alpine Research, vol. 14, no 3, , p. 183–188 (DOI 10.2307/1551150)
- (en) James R. Gilbert, G.A. Fedoseev, Dana J. Seagars, Evgenii Razlivalov et A. LaChugin, « Aerial census of Pacific walrus, 1990 », USFWS R7/MMM Technical Report 92-1, , p. 33
- [PDF](en) US Fish and Wildlife Service, « Stock Assessment Report: Pacific Walrus - Alaska Stock »,
- (en) NAMMCO (North Atlantic Marine Mammal Commission), « Report of the third meeting of the Scientific Committee », NAMMCO Annual Report, Tromsø, NAMMCO, , p. 71-127
- [PDF](en) North Atlantic Marine Mammal Commission, « Status of Marine Mammals of the North Atlantic: The Atlantic Walrus »
- (en) « Ministry of Natural Resources of the Russian Federation protected species list » [archive du ] (consulté le )
- [PDF](fr) COSEPAC, « Mise à jour - Évaluation et Rapport de situation du COSEPAC sur le Morse de l'Atlantique Odobenus rosmarus rosmarus au Canada » (consulté le )
- (en) The Chichester Group in Toronto, Canada, « Walrus Tusks »
- (en) « HUNTING AND USE OF WALRUS BY ALASKA NATIVES », (consulté le )
- (en) Joel L. Garlich-Miller et Douglas M. Burn, « Estimating the harvest of Pacific walrus, Odobenus rosmarus divergens, in Alaska », Fish. Bulletin, vol. 97, no 4, , p. 1043–1046
- (en) L. Witting et Erik W. Born, « An assessment of Greenland walrus populations », ICES Journal of Marine Science, vol. 62, no 2, , p. 266–284 (DOI 10.1016/j.icesjms.2004.11.001)
- (en) Christopher John Chivers, « A Big Game », sur New York Times Online,
- [PDF](en) US Fish and Wildlife Service, « Hunting and Use of Walrus by Alaska Natives »,
- (en) J. Forsyth, A History of the Peoples of Siberia : Russia's North Asian Colony, 1581-1990, Londres, Cambridge University Press, , 475 p. (ISBN 978-0-521-40311-5)
- (en) A.I. Kozlov et E.I. Zdor, « Whaling Products as an Element of Indigenous Diet in Chukotka », The Anthropology of East Europe Review « Special Issue: Food and Foodways in Post-Socialist Eurasia », no 21, , p. 127–137
- (en) E. Weine Eleanor, Milton M.R. Freeman et Jeanette C. Makus, « Use and preference for Traditional Foods among Belcher Island Inuit », Artic, vol. 49, no 3, , p. 256–264
- (en) Marc Kaufman, « Warming Arctic Is Taking a Toll, Peril to Walrus Young Seen as Result of Melting Ice Shelf », sur The Washington Post,
- (en) Andrew C. Revkin, « Global warming could reverse a walrus comeback », NY Times,
- (en) Nick Sundt, « As artic sea ice reaches annual minimum, large number of walrus corpses found » [archive du ], World Wildlife Fund, (consulté le )
- (en) « Dramatic videos shows how climate change threatens walruses », World Wildlife Fund (consulté le )
- (en) Shaye Wolf, « Petition to List the Pacific Walrus (Odobenus Rosmarus Divergens) as a Threatened or Endangered Species Under the Endangered Species Act », Center for Biological Diversity, (consulté le ), p. 83-84
- (en) Waldemar Bogoras, « The Folklore of Northeastern Asia, as Compared with That of Northwestern America », American Anthropologist, New Series, vol. 4, no 4, , p. 578-683 (lire en ligne)
- (en) Franz Boas, « The Eskimo of Baffin Land and Hudson Bay. From notes collected by Capt. George Comer, Capt. James S. Mutch, and Rev. E. J. Peck », Bulletin of the American Museum of Natural History, New York, vol. 15, , p. 146
- (fr) Alfred Frédol (ill. Pierre Lackerbauer), Le monde de la mer, Paris, , 693 p. (lire en ligne), chap. XLVIII (« Le morse »), p. 645-651
- (en) Barry H. Lopez, Arktische Träume : Leben in der letzten Wildnis, , 478 p. (ISBN 978-3-423-11154-6)
- (en) Ronald A. Kastelein, P.R. Wiepkema et C. Slegtenhorst, « The use of molluscs to occupy Pacific walrusses (Odobenus rosmarus divergens) in human care », Aquatic Mammals 15.1, vol. 15, , p. 6–8 (lire en ligne)
- (fr) Rudyard Kipling (trad. Louis Fabulet et Robert d'Humières), Le Livre de la jungle, (lire en ligne)
- WoRMS, consulté en 2010
Annexes
Articles connexes
- Odobenidae, la famille et Odobenus, le genre
- Walrus
 | Morse
| Morse 
- Défense | Ivoire | Lard de mammifère marin
- Art inuit
Références taxinomiques
- (en) Référence Mammal Species of the World (3e éd., 2005) : Odobenus rosmarus Linnaeus, 1758
- (en) Référence Catalogue of Life : Odobenus rosmarus (Linnaeus, 1758) (consulté le )
- (en) Référence Fauna Europaea : Odobenus rosmarus
- (en) Référence Paleobiology Database : Odobenus rosmarus (Linnaeus 1758)
- (fr+en) Référence ITIS : Odobenus rosmarus (Linnaeus, 1758)
- (en) Référence World Register of Marine Species : espèce Odobenus rosmarus (Linnaeus, 1758)
- (en) Référence Animal Diversity Web : Odobenus rosmarus
- (en) Référence NCBI : Odobenus rosmarus (taxons inclus)
Liens externes
- (en) Référence UICN : espèce Odobenus rosmarus (Linnaeus, 1758) (consulté le )
- (fr+en) Référence CITES : espèce Odobenus rosmarus (Linnaeus, 1758) (+ répartition) (sur le site de l’UNEP-WCMC)
- (fr) Référence CITES : taxon Odobenus rosmarus (sur le site du ministère français de l'Écologie) (consulté le )
- (fr) Encyclopédie Larousse, « morse », sur Larousse.fr
- (fr) Morse de l'Atlantique, Faune et flore du pays
- (fr) enregistrement subaquatique d'un Morse
- Portail des mammifères
- Portail de l’Arctique
- Portail de la conservation de la nature
- Portail de la biologie marine