n-Butyllithium
Le n-butyllithium, abrégé n-BuLi, est un composé chimique de formule LiCH2–CH2–CH2–CH3, isomère du sec-butyllithium et du tert-butyllithium. C'est le plus utilisé des réactifs organolithiens[4]. Il est largement utilisé comme amorceur de polymérisation dans la production d'élastomères tels que le polybutadiène (BR) ou le styrène-butadiène-styrène (SBS), et comme base forte (superbase) en synthèse organique, tant à l'échelle industrielle qu'à celle du laboratoire.
| n-Butyllithium | ||
| ||
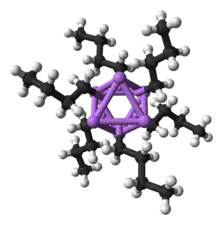
| Modèle 3D d'un hexamère de n-butyllithium (haut) et formule plane du n-butyllithium (bas). | ||
| Identification | ||
|---|---|---|
| Nom UICPA | Butyllithium, Tétra-μ3-butyl-tétralithium |
|
| Synonymes |
BuLi |
|
| No CAS | ||
| No ECHA | 100.003.363 | |
| No CE | 203-698-7 | |
| PubChem | 61028 | |
| ChEBI | 51469 | |
| SMILES | ||
| InChI | ||
| Apparence | solide cristallin incolore, instable et obtenu habituellement en solution légèrement jaune | |
| Propriétés chimiques | ||
| Formule | C4H9Li [Isomères] |
|
| Masse molaire[1] | 64,055 ± 0,006 g/mol C 75 %, H 14,16 %, Li 10,84 %, |
|
| Propriétés physiques | ||
| T° fusion | −95 °C (solution à 15 % dans l'hexane)[2] | |
| T° ébullition | 69 °C (solution à 15 % dans l'hexane)[2] | |
| Solubilité | violente décomposition dans l'eau, soluble dans l'éther, le THF, le cyclohexane. Réagit violemment avec les solvants protiques et les solvants chlorés. |
|
| Masse volumique | 0,68 g·cm-3 (solution à 15 % dans l'hexane, 20 °C)[2] | |
| T° d'auto-inflammation | 240 °C (solution à 15 % dans l'hexane)[2] | |
| Point d’éclair | −22 °C (solution à 2,5 mol·L-1 dans l'hexane)[2] | |
| Limites d’explosivité dans l’air | LIE=1,2 % vol. ; LSE=7,8 % vol. (solution à 15 % dans l'hexane)[2] | |
| Pression de vapeur saturante | 16,3 kPa (solution à 15 % dans l'hexane, 20 °C)[2] | |
| Précautions | ||
| SGH[2] | ||
     Danger |
||
| SIMDUT[3] | ||
 B6, |
||
| Transport[2] | ||
| Composés apparentés | ||
| Isomère(s) | t-BuLi, s-BuLi | |
| Unités du SI et CNTP, sauf indication contraire. | ||

Le n-butyllithium est disponible dans le commerce en solution (à 15 %, 20 %, 23 %, 24 %, 25 %, 2 M, 2,5 M, 10 M, etc.) dans des hydrocarbures (pentane, hexane, cyclohexane, heptane, toluène) mais pas dans les éthers tels que l'éther diéthylique et le tétrahydrofurane (THF), car il réagit avec ces derniers à température ambiante. La production et la consommation mondiales annuelles de n-butyllithium sont d'environ 900 tonnes[4].
Bien qu'il s'agisse d'un solide incolore, le n-butyllithium se présente généralement sous la forme d'une solution, jaune pâle dans les alcanes. De telles solutions sont stables indéfiniment si elles sont correctement stockées[5] mais, en pratique, elles se dégradent progressivement ; un fin précipité blanc d'hydroxyde de lithium LiOH se dépose, et la couleur vire à l'orange.
Structure et liaison
Le n-BuLi est sous forme de cluster à l'état solide et en solution dans la plupart des solvants. Cette tendance à s'agréger est commune aux composés organolithiens. Ces agrégats sont maintenus compacts par les liaisons covalentes délocalisées entre le lithium et le carbone terminal des chaînes butyle[6]. Dans le cas du n-BuLi, les clusters sont des tétramères (dans l'éther diéthylique) ou des hexamères (dans l'hexane). Les clusters tétramères ont une structure de cubane distordu avec les atomes de lithium et des groupes méthylène CH2 disposés alternativement sur les sommets. Une description équivalente est de voir le tétramère comme un tétraèdre Li4 interpénétré par un autre tétraèdre [CH2]4. Les liaisons à l'intérieur du cluster sont du même type que celles décrites pour le diborane (liaisons à trois centres et deux électrons), mais sont plus complexes puisqu'elles impliquent huit atomes. Reflétant son caractère déficitaire en électron, le n-butyllithium est très réactif vis-à-vis des bases de Lewis.
Du fait de la grande différence d'électronégativité entre le carbone (2,55) et le lithium (0,98), la liaison Li–C est fortement polarisée. La séparation des charges est estimée entre 55 et 95 %. Ainsi, même si pour des raisons pratiques, n-BuLi est souvent considéré comme un réactif qui agit via l'anion butyle, n-Bu−, avec le cation Li+, ce modèle est incorrect, n-BuLi n'est pas ionique.
Préparation
La préparation standard pour n-BuLi est la réaction du 1-bromobutane ou du 1-chlorobutane avec le lithium métallique[5] :
Le lithium pour cette réaction contient habituellement de 1 à 3 % de sodium. Les solvants utilisés pour cette préparation incluent le benzène, le cyclohexane et l'éther diéthylique. Lorsque le 1-bromobutane est le précurseur, le produit est une solution homogène, consistant en des clusters mêlant bromure de lithium LiBr et n-butyllithium. Le n-BuLi formant un complexe moins stable avec le chlorure de lithium LiCl, la réaction avec le 1-chlorobutane produit un précipité blanc de LiCl.
Réactions
Le n-butyllithium est une base forte (pKa ≈ 50) mais aussi un nucléophile puissant et un réducteur, son caractère dépendant des autres réactifs. En outre, en plus d'être un nucléophile fort, n-BuLi se lie aux bases de Lewis aprotiques comme les éthers et les amines tertiaires, qui dissocient les clusters en se liant directement aux centres Li. Cette utilisation comme acide de Lewis correspond à ce qui est appelé métallation. Les réactions sont typiquement réalisées dans le THF ou l'éther diéthylique, qui sont de bons solvants pour les dérivés organolithiens résultant de la réaction de BuLi (voir ci-dessous).
Métallation
Une des propriétés chimiques les plus utiles du n-BuLi est son aptitude à déprotoner une large gamme d'acides de Brønsted faibles ; le tert-butyllithium et le sec-butyllithium sont à cet égard encore plus basiques. Le n-BuLi peut déprotoner (dans ce sens, métaller) de nombreux types de liaisons C–H, notamment lorsque la base conjuguée est stabilisée par délocalisation électronique ou par un ou plusieurs hétéroatomes. Les exemples incluent les alcynes (H–C≡C–R), les sulfures de méthyle (H–CH2SR), les thioacétals (H–CH(SR)2) tels que le dithiane, les méthylphosphines (H–CH2PR2), les furanes, les thiophènes et les ferrocènes, (Fe(H–C5H4)(C5H5))[7]. En plus de ces composés, il peut également déprotoner des composés plus acides, comme les alcools, les amines, les composés carbonylés énolisables et tout composé acide pour former des alcoolates, des amides, des énolates et d'autres dérivés organiques du lithium. La stabilité et la volatilité du butane résultant de ces réactions de déprotonation est pratique et commode, mais peut aussi être un problème dans des réactions à grande échelle car cela produit un volume important d'un gaz facilement inflammable :
La basicité cinétique du n-BuLi est affectée par le solvant de réaction ou par un cosolvant. Des solvants qui complexent Li+, tels que le tétrahydrofurane (THF), le tétraméthyléthylènediamine (TMEDA), l'hexaméthylphosphoramide (HMPA) et le 1,4-diazabicyclo[2.2.2]octane (DABCO), polarisent en plus la liaison Li–C et accélèrent la métallation. De tels ligands peuvent aussi aider à isoler les produits lithiés, un exemple typique est celui du dilithioferrocène :
La base de Schlosser est une superbase produite en traitant le n-butyllithium avec du tert-butylate de potassium KOC(CH3)3. Elle est cinétiquement plus réactive que le n-BuLi et est souvent utilisée pour réussir des métallations difficiles. L'anion butanolate complexe le lithium et produit effectivement du butylpotassium, qui est plus réactif que le composé lithié correspondant.
Un autre exemple de l'emploi du n-butyllithium en tant que base est l'addition d'une amine sur un carbonate méthylé pour former un carbamate, où n-BuLi sert à déprotoner l'amine :
Échange lithium-halogène
Le n-butyllithium réagit avec certains bromures et iodures dans des réactions qui forment les dérivés organolithiens correspondants. Cette réaction est normalement inopérante avec les chlorures et les fluorures organiques.
Cette réaction est une méthode pratique pour la préparation de nombreux types de composés RLi, particulièrement les réactifs aryllithiums et certains vinyllithiums. L'utilité de cette méthode est toutefois limitée par la présence dans le mélange réactionnel de 1-bromobutane ou de 1-iodobutane, qui peuvent réagir avec le dérivé organolithien formé ou par des réactions de déshydrohalogénation, où n-BuLi sert de base :
- C4H9Br + RLi → C4H9R + LiBr.
- C4H9Li + R'CH=CHBr → C4H10 + R'C≡CLi + LiBr.
Ces réactions secondaires sont sensiblement moins importantes avec RI que pour RBr car la vitesse de l'échange Li-I est plus rapide de plusieurs ordres de grandeur que la vitesse de l'échange Li-Br. Pour cette raison, on préfère utiliser les iodures d'aryle, de vinyle et d'alkyle primaires, et utiliser t-BuLi plutôt que n-BuLi, car le t-iodobutane formé est immédiatement détruit par le t-BuLi dans une réaction de déshydrohalogénation qui requiert deux équivalents de t-BuLi. Alternativement, les composés vinyllithium peuvent être préparés par réaction d'échange directe entre l'halogénovinyle et le lithium métallique ou par un échange lithium-étain[5] (voir la section suivante).
Transmétallation
Une famille de réactions apparentées est la transmétallation, où deux composés organométalliques échangent leurs métaux. Beaucoup d'exemples de telles réactions mettent en jeu l'échange Li-Sn (lithium-étain) :
Les réactions d'échange lithium-étain ont un avantage majeur sur les échanges lithium-halogène pour la préparation des dérivés organolithiens car le composé d'étain produit, (C4H9SnMe3 dans l'exemple ci-dessus) est beaucoup moins réactif vis-à-vis du n-BuLi que ne le sont les produits halogénés de la réaction d'échange Li-halogène correspondante (C4H9Br ou C4H9I). D'autres métaux et métalloïdes dont les composés organiques peuvent intervenir dans de telles réactions d'échange sont le mercure, le sélénium et le tellure.
Synthèse de composés carbonylés
Les organolithiens, n-BuLi inclus, sont utilisés dans la synthèse d'aldéhydes et de cétones spécifiques. Une de ces voies de synthèse est la réaction d'un organolithien avec un amide bisubstitué :
- R1Li + R2CONMe2 → LiNMe2 + R2C(O)R1.
Carbolithiation
Le butyllithium peut s'additionner sur certains alcènes activés tels que le styrène ou le butadiène et même sur l'éthylène pour former de nouveaux organolithiens. Cette réaction est la base d'une utilisation commerciale importante du n-BuLi pour la production de polystyrène (PS) et de polybutadiène :
- C4H9Li + CH2=CH–C6H5 → C4H9–CH2–CH(Li)–C6H5.
Dégradation du THF
Le tétrahydrofurane (THF) est déprotoné par le n-butyllithium, notamment en présence de tétraméthyléthylènediamine (TMEDA), par perte d'un des quatre atomes d'hydrogène liés à un atome de carbone adjacent à l'atome d'oxygène. Ce processus, qui consomme du n-BuLi en générant du butane, induit une cycloaddition inverse qui donne de l'énolate d'éthanal et de l'éthylène. Cependant, les réactions avec le n-BuLi dans le THF sont conduites à basse température, typiquement à −78 °C, température convenablement tenue par un bain de dioxyde de carbone solide dans l'acétone. Des températures moins basses (−25 °C, ou même −15 °C) peuvent également être utilisées.
Décomposition thermique
Lorsqu'il est chauffé, le n-butyllithium, de manière analogue aux autres alkyllithiums avec des hydrogènes en position β — c'est-à-dire des hydrogènes sur le carbone β adjacent au carbone α qui est lié au Li — subit une β-hydroélimination qui produit du 1-butène CH3CH2CH=CH2 et de l'hydrure de lithium LiH :
- C4H9Li → CH3CH2CH=CH2 + LiH.
Sécurité
Il est important de stocker et de manipuler tout alkyllithium sous atmosphère inerte pour éviter toute réaction et surtout pour des raisons de sécurité. Le n-BuLi réagit très violemment avec l'eau pour former de l'hydroxyde de lithium (corrosif) :
Le n-BuLi réagit avec le dioxygène O2, ainsi qu'avec le dioxyde de carbone CO2 pour former du pentanoate de lithium C4H9COOLi :
- C4H9Li + CO2 → C4H9COOLi.
Le butyllithium — et plus particulièrement le tert-butyllithium — est extrêmement réactif vis-à-vis de l'air et de l'humidité. Son hydrolyse est suffisamment exothermique pour enflammer le solvant qui le dissout (les sources commerciales utilisent typiquement du THF, de l'éther diéthylique ou des hexanes), de sorte qu'une exposition à l'atmosphère suffit pour conduire à l'inflammation. Dans certaines circonstances, par exemple dans des aiguilles, il peut s'auto-sceller en formant une barrière d'oxydes et d'hydroxydes qui prévient une poursuite de l'accès à l'air. Tous les isomères et formes de butyllithium étant classés « R17 » (spontanément inflammable à l'air), le BuLi est toujours manipulé sous atmosphère de diazote ou d'argon parfaitement anhydre (gaz neutres).
Essentiellement dû au BuLi :
- R11 : facilement inflammable.
- R14/15 : réagit violemment au contact de l'eau en dégageant des gaz extrêmement inflammables.
- R17 : spontanément inflammable à l'air.
- R34 : provoque des brûlures.
Essentiellement dû au solvant :
- R48/20 : nocif : risque d'effets graves pour la santé en cas d'exposition prolongée par inhalation.
- R51/53 : toxique pour les organismes aquatiques, peut entraîner des effets néfastes à long terme pour l'environnement aquatique.
- R62 : risque possible d'altération de la fertilité.
- R65 : nocif : peut provoquer une atteinte des poumons en cas d'ingestion.
- R67 : l'inhalation de vapeurs peut provoquer somnolence et vertiges.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Butyllithium » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 8 mai 2013 (JavaScript nécessaire)
- « Butyllithium normal » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- Jacques Drouin, Introduction à la chimie organique : Les molécules organiques dans votre environnement. Usages, toxicité, synthèse et réactivité, vol. 2005, Corbas, Librairie du Cèdre, , 1re éd., 785 p. (ISBN 978-2-916346-00-7 et 2-916346-00-7), p. 502
- Brandsma, L. ; Verkraijsse, H. D. ; Preparative Polar Organometallic Chemistry I, Springer-Verlag, Berlin, 1987. (ISBN 3-540-16916-4)
- Elschenbroich, C. ; Organometallics, Wiley-VCH, Weinheim, 2006. (ISBN 3-527-29390-6)
- Sanders, R. ; Mueller-Westerhoff, U. T. ; The Lithiation of Ferrocene and Ruthenocene - A Retraction and an Improvement, J. Organomet. Chem., 1996, vol. 512, p. 219–224. DOI:10.1016/0022-328X(95)05914-B
- Ovaska, T. V. ; Encyclopedia of Reagents for Organic Synthesis, n-butyllithium, John Wiley & Sons. 2006. DOI:10.1002/047084289X.rb395
- Greenwood, N. N. ; Earnshaw, A. ; Chemistry of the Elements, 2e éd., 1997, Butterworth-Heinemann, Boston.
- *
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « n-Butyllithium » (voir la liste des auteurs).

