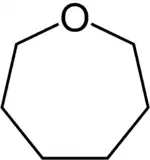
Oxépane
L'oxépane est un composé organique du groupe des hétérocycles saturés. L'oxépane consiste en un cycle à sept chaînons dont l'un est un atome d'oxygène, c'est donc un éther-oxyde. Il correspond aussi à la forme complètement hydrogénée de l'oxépine. L'oxépane est aussi le composé parent des composés organiques qui comportent ce type de cycle.
| Oxépane | |
| |
| Identification | |
|---|---|
| Nom UICPA | oxépane |
| Synonymes |
oxyde d'hexaméthylène, oxacycloheptane, hexahydrooxépine, perhydrooxépine |
| No CAS | |
| No ECHA | 100.008.890 |
| No CE | 209-777-2 |
| PubChem | 11618 |
| ChEBI | 49106 |
| SMILES | |
| InChI | |
| Apparence | liquide clair légèrement jaune[1] |
| Propriétés chimiques | |
| Formule | C6H12O [Isomères] |
| Masse molaire[2] | 100,158 9 ± 0,005 9 g/mol C 71,95 %, H 12,08 %, O 15,97 %, |
| Propriétés physiques | |
| T° ébullition | 124 à 126 °C[3] |
| Masse volumique | 0,9 g·cm-3[4] |
| Propriétés optiques | |
| Indice de réfraction | 1,4400 à 20 °C[5] |
| Précautions | |
| Directive 67/548/EEC[1] | |
 F |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
La synthèse de l'oxépane est possible via la cyclisation du 1,6-hexanediol dans le DMSO à 190 °C. Cependant, le rendement de cette réaction reste faible[6]. Une autre réaction possible, mais qui a un rendement aussi mauvais, est la cyclisation du 1,6-dichlorohexane avec de l'hydroxyde de potassium[7].
Utilisation
L'ouverture du cycle des oxépanes permet d'obtenir des dérivés d'hexane α, ω-fonctionnalisés. Pour réaliser cette ouverture, des acides de Lewis ou de Brønsted sont utilisés. Ainsi, la réaction de l'oxépane avec du dichlorophosphate de phényle et de l'iodure de sodium fournit le 1,6-diiodohexane[8] :
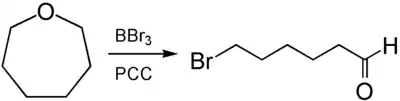
De la même façon, la réaction avec le tribromure de bore, suivie de l'oxydation par PCC, donne du 6-bromohexanal[9] :
Enfin, l'oxépane peut être polymérisée en utilisant des amorceurs cationiques comme (C2H5)3OSbCl6, et fournit alors le poly(oxyde d'hexaméthylène), un solide cristallin qui a un point de fusion vers 56-58 °C[10].
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Oxepan » (voir la liste des auteurs).
- Hexamethylene Oxide sur TCI Europe
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- A. Misono, T. Osa, Y. Sanami, Bull. Chem. Soc. Jpn., 1968, vol. 41, p. 2447–2453.
- A. Müller, W. Vanc, Monatsh. Chem., 1947, vol. 77, p. 259–263.
- David R. Lide, CRC Handbook of Chemistry and Physics, 90e éd., CRC Press, Taylor & Francis, Boca Raton, FL, Physical Constants of Organic Compounds, p. 3-408.
- V.J. Traynelis, W.L. Hergenrother, H.T. Hanson, J.A. Valicenti, J. Org. Chem., 1964, vol. 29, p. 123–129.
- H.A. Zahalka, Y. Sasson, Synthesis, 1986, vol. 9, p. 763–765.
- H.-J. Liu, L.M. Shewchuk, M. Llinas-Brunet, Heterocycles, 1986, vol. 24, p. 3043–3046.
- S.U. Kulkarni, U. Surendra, V.D. Patil, Heterocycles, 1982, vol. 18, p. 163–167.
- Takeo Saegusa, Toshiaki Shiota, Shu-ichi Matsumoto, Hiroyasu Fujii, Ring-opening Polymerization of Oxepane, Polymer Journal, 1972, vol. 3(1), p. 40–43, DOI:10.1295/polymj.3.40 (ISSN 1349-0540).