Oxyde de propylène
L'oxyde de propylène, ou 1,2-époxypropane, est un composé chimique de formule CH3CHCH2O. Il se présente sous la forme d'un liquide combustible incolore très volatil à l'odeur d'éther et susceptible de former des mélanges explosifs avec l'air. Il s'agit d'un époxyde chiral généralement utilisé sous forme du racémique. Il est principalement utilisé pour produire des polyols destinés à la fabrication de polyuréthanes. Il possède un isomère, l'oxétane, dont le cycle contient quatre atomes, et non trois.
| Oxyde de propylène | |
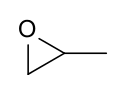 Structure de l'oxyde de propylène |
|
| Identification | |
|---|---|
| Nom UICPA | méthyloxirane |
| Synonymes |
1,2-époxypropane |
| No CAS | (RS) (R)-(+) (S)-(–) |
| No ECHA | 100.000.800 |
| No CE | 200-879-2 |
| PubChem | 6378 |
| ChEBI | 38685 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore à l'odeur d'éther |
| Propriétés chimiques | |
| Formule | C3H6O [Isomères] |
| Masse molaire[1] | 58,079 1 ± 0,003 1 g/mol C 62,04 %, H 10,41 %, O 27,55 %, |
| Propriétés physiques | |
| T° fusion | −112 °C[2] |
| T° ébullition | 34,4 °C[2] |
| Solubilité | 680 g·l-1[2] à 20 °C |
| Masse volumique | 0,83 g·cm-3[2] |
| T° d'auto-inflammation | 430 °C[2] |
| Point d’éclair | −37 °C[2] |
| Point critique | 209,1 C[2], 4,91 MPa[2] |
| Précautions | |
| SGH[2] | |
   Danger |
|
| Transport[2] | |
| Classification du CIRC | |
| groupe 2B : peut-être cancérogène pour l'Homme | |
| Unités du SI et CNTP, sauf indication contraire. | |
Stéréochimie
L'atome de carbone qui porte le substituant méthyle est chiral. L'1,2-époxypropane existe donc sous la forme de deux énantiomères :
- le (R)-(+)-1,2-époxypropane de numéro CAS
- le (S)-(–)-1,2-époxypropane de numéro CAS
Production
La production industrielle de l'oxyde de propylène part du propylène CH3–CH=CH2. Deux grandes approches sont utilisées, la première par hydrochloration et la seconde par oxydation.
La voie traditionnelle par hydrochloration passe par la conversion du propylène en 1-chloro-2-propanol CH3–CHOH–CH2Cl et 2-chloro-1-propanol CH3–CHCl–CH2OH :
- 2 CH3–CH=CH2 + Cl2 + H2O → CH3–CHOH–CH2Cl + CH3–CHCl–CH2OH.
Ce mélange de chloropropanols est ensuite déshydrochloré, par exemple :
- CH3–CHOH–CH2Cl + OH− → CH3C2H3O + Cl− + H2O.
La chaux est souvent utilisée pour absorber les ions chlorure Cl−.
L'autre grande voie de synthèse de l'oxyde de propylène passe par la co-oxydation de l'éthylbenzène C6H5CH2CH3 et de l'isobutane HC(CH3)3. En présence de catalyseurs, l'oxydation par l'air se déroule comme suit :
- CH3–CH=CH2 + C6H5–CH2–CH3 + O2 → CH3C2H3O + C6H5–CH=CH2 + H2O.
Les coproduits de ces réactions, qu'il s'agisse du styrène C6H5–CH=CH2 ou du tert-butanol HOC(CH3)3, sont des matières premières importantes pour d'autres réactions. Par exemple, le tert-butanol peut réagir avec le méthanol CH3OH pour donner du méthyl tert-butyl éther CH3OC(CH3)3 (MTBE), un additif pour carburant automobile : avant la restriction actuellement imposées quant à l'utilisation du MTBE dans les carburants en raison des risques écologiques qu'il soulève, la voie de synthèse par le propylène et l'isobutane était l'une des plus importantes.
Un procédé alternatif partant du cumène C6H5CH(CH3)2 a été mis en production par Sumitomo Chemical en . Il s'agit d'une adaptation du procédé par co-oxydation utilisant l'hydroperoxyde de cumène à la place de l'hydroperoxyde d'éthylbenzène et recyclant en cumène l'α-hydroxycumène coproduit, par déshydratation et hydrogénation.
Plus récemment, BASF et Dow Chemical ont mis en production leur première ligne implémentant le procédé HPPO dans lequel le propylène est oxydé par le peroxyde d'hydrogène H2O2 :
- CH3–CH=CH2 + H2O2 → CH3C2H3O + H2O.
Ce procédé est réputé ne générer que de l'eau comme sous-produit.
Détection dans l'espace
Le , Brett A. McGuire et ses collaborateurs annoncent la détection d'oxyde de propylène dans la phase gazeuse d'une coquille moléculaire étendue froide autour des amas protostellaires imbriqués massifs dans la région de formation d'étoiles Sagittarius B2[3]. Des molécules chirales avaient déjà été détectées dans des météorites et des comètes dans notre système solaire, mais celle-ci est la première détectée dans l'espace[4]. C'est également l'une des molécules les plus complexes détectées à ce jour dans l'espace interstellaire[4].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Propylene oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 24 février 2013 (JavaScript nécessaire).
- [McGuire et al. 2016] Brett A. McGuire et al., « Discovery of the interstellar chiral molecule propylene oxide (CH3CHCH2O) » [« Découverte de la molécule chirale interstellaire d'oxyde de propylène (CH3CHCH2O) »], Science, American Association for the Advancement of Science, vol. 352, no 6292, 17 juin 2016 (première version en ligne le 14 juin 2016), p. 1449-1452 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.aae0328)Les co-auteurs de l'articles sont, outre Brett A. McGuire, P. Brandon Carroll, Ryan A. Loomis, Ian A. Finneran, Philip R. Jewell, Anthony J. Remijan et Geoffrey A. Blake. L'article a été reçu par l'éditeur le 31 décembre 2015 et accepté pour publication le 11 mai 2016.
- « Une molécule organique détectée dans l'espace », http://fr.canoe.ca, (lire en ligne).
- Portail de la chimie
- Portail de l’astronomie
