Phénylacétone
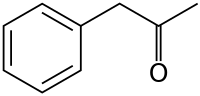
La phénylacétone est un composé organique de formule C6H5CH2C(O)CH3. C'est un liquide huileux jaune soluble dans les solvants organiques, avec une forte odeur caractéristique, utilisé dans l'industrie chimique et pharmaceutique.
| Phénylacétone | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 1-phénylpropan-2-one | |
| Synonymes |
benzylméthylcétone |
|
| No CAS | ||
| No ECHA | 100.002.859 | |
| No CE | 203-144-4 | |
| PubChem | 7678 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide jaune à l'odeur agréable[1] | |
| Propriétés chimiques | ||
| Formule | C9H10O [Isomères] |
|
| Masse molaire[2] | 134,175 1 ± 0,008 2 g/mol C 80,56 %, H 7,51 %, O 11,92 %, |
|
| Propriétés physiques | ||
| T° fusion | −15 °C[1] | |
| T° ébullition | 216 °C[1] | |
| Solubilité | quasiment insoluble dans l'eau[1] | |
| Masse volumique | 1,01 g·cm-3 (20 °C)[1] | |
| Point d’éclair | 83 °C (coupelle fermée)[1] | |
| Précautions | ||
| SGH | ||
| non dangereux selon le SGH[1] | ||
| Transport | ||
non-soumis à régulation[1] |
||
| Écotoxicologie | ||
| LogP | 1,44[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Elle est notamment utilisée dans la synthèse de la méthamphétamine et l'amphétamine. Du fait de son utilisation clandestine, elle fait partie des substances contrôlées aux États-Unis depuis 1980[3].
La phénylacétone est le produit de désamination de l'amphétamine par le métabolisme humain.
Synthèse
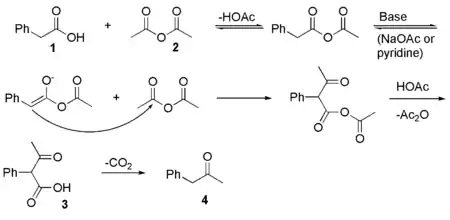
La phénylacétone peut être préparée de nombreuses façons. La méthode la plus économique est sans doute un dérivé de la réaction de Dakin-West ou cétonisation (déshydratation et décarboxylation) à partir de l'acide phénylacétique (1) et de l'anhydride acétique (2) sous catalyse basique. Dans un premier temps, l'acide phénylacétique vient se substituer à un groupe acétyle sur l'anhydride acétique, formant un anhydride mixte. Ce composé subit un équilibre céto-énolique pour former un énolate. Cet énolate va se substituer sur un nouvel anhydride acétique formant, à la suite du départ du groupe acétyle de la fonction anhydride mixte, à un β-cétoacide (3). Ce dernier subit alors une décarboxylation pour former la phénylacétone (4) :
Cette réaction peut aussi se faire avec l'acide phénylacétique et de l'acide acétique catalysée par l'alumine vers 400-500 °C[4] :
- C6H5CH2CO2H + CH3CO2H → C6H5CH2C(O)CH3 + CO2 + H2O
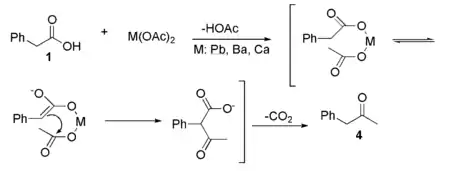
Un autre méthode consiste faire réagir l'acide phénylacétique avec un acétate de métal divalent, en particulier le plomb (acétate de plomb(II)) :
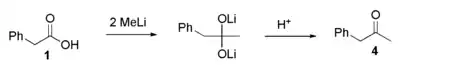
Une version plus « élégante » est la réaction de l'acide phénylacétique avec le méthyllithium suivie d'une étape de déprotonation :
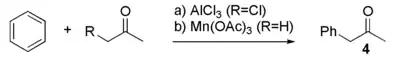
Du fait du contrôle sur l'acide phénylacétique, d'autres méthodes de synthèse ont été rapportées[5]. La plupart utilisent des réactifs dangereux ou coûteux, avec des rendements faibles, si bien que de telles synthèses ne se font qu'à l'échelle des laboratoires. Parmi ces réactions, on peut citer l'acylation de Friedel-Crafts du benzène avec la chloracétone catalysée par le chlorure d'aluminium (a), ou bien à partie de l'acétone et d'un radical benzyle en présence d'acétate de manganèse(III) qui est le réactif limitant de la réaction. Cette méthode est cependant peu utilisée en pratique du fait de la sur-alcylation fréquente par l'alcylation de Friedel-Crafts.
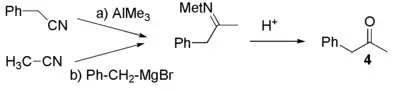
Une cétone peut être produite par réaction avec d'un organométallique avec des nitriles. Dans notre cas, la phénylacétone peut être synthétisée par réaction entre le triméthylaluminium (ou aussi un réactif de Grignard de méthyle) et le phénylacétonitrile (a) ou par réaction entre le bromure de benzylmagnésium et l'acétonitrile (b). Dans les deux cas, l'hydrolyse de l'intermédiaire imine obtenu donne la phénylacétone (4).
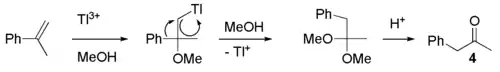
Une autre réaction intéressante est l'oxydation de l'α-méthylstyrène par des sels de thallium(III) dans le méthanol. Après l'addition du thallium et du groupe méthoxy de part et d'autre de la double liaison, il y a clivage avec départ de l'ion Tl+ formant un carbocation. Ce carbocation subit ensuite un réarrangement sigmatropique et une nouvelle addition d'un groupe méthoxy. Le diméthylcétal ainsi obtenu peut être hydrolysé en catalyse acide en phénylacétone (4).
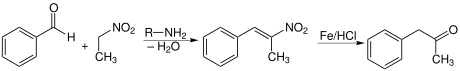
Enfin, elle peut être produite par condensation du benzaldéhyde et du nitroéthane, formant le phényl-2-nitropropène, suivie d'une réduction, habituellement en présence d'un acide.
Applications
La phénylacétone est utilisée dans la synthèse de pesticides et de composés pharmaceutiques. Parmi ceux-ci, on peut citer la diphacinone, un anticoagulant utilisé comme rodenticide.
Notes et références
- (en)/(de) Cet article est partiellement ou en totalité issu des articles intitulés en anglais « Phenylacetone » (voir la liste des auteurs) et en allemand « Phenylaceton » (voir la liste des auteurs).
- Entrée du numéro CAS « 103-79-7 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Lists of: Scheduling Actions, Controlled Substances, Regulated Chemicals », U.S. Department of Justice, Drug Enforcement Administration
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a15_077)
- Synthesis of Phenyl-2-Propanone (P2P)
- Portail de la chimie