Prédation
La prédation (emprunt de la Renaissance [1574] au latin praedator, « voleur, pilleur », lui-même issu de praeda, « proie » et de prehendō, « prendre », qui exprime le fait de se saisir de quelqu'un ou de capturer une proie déterminée par sa poursuite (en)[1]) est une interaction trophique directe, de nature antagoniste, entre deux organismes, par laquelle une espèce dénommée prédateur, consomme entièrement ou partiellement une à plusieurs espèces dénommée(s) proies, généralement en les tuant, pour s'en nourrir ou pour alimenter sa progéniture. La définition lato sensu inclut la zoophagie (depuis les micro-organismes procaryotes[2] jusqu'aux grands mammifères (en) superprédateurs, en passant par les hématophages ou les plantes carnivores), la bactériophagie[3], la microphagie (depuis les mollusques jusqu'aux baleines à fanons), mais aussi la phytophagie (consommation de plantes par les herbivores, de graines par les granivores…), le parasitoïsme, le parasitisme ou les interactions hôte-pathogène[4].
Pour les articles homonymes, voir Prédateur (homonymie).

Cette interaction fait appel à de nombreux concepts (intention volontaire ou non de consommer, taille du prédateur par rapport à sa proie, taille minimale et nature de la proie, méthode de capture, consommateur final) qui sont l'objet de débats et de définitions, sinon contradictoires ou sources de confusion, du moins polysémiques[5].
Ainsi, une définition plus restrictive limite la prédation à l'ingestion d'animaux vivants[pas clair] par d'autres animaux (zoophagie et plus spécifiquement carnivorie, les carnivores étant appelés consommateurs secondaires ou prédateurs qui composent le troisième niveau trophique) et exclut les autres modes d'alimentation, la nécrophagie, la saprophagie (avec le cas particulier des charognards exclusifs ou opportunistes — arthropodes aquatiques et terrestres tels que des insectes, des oiseaux marins ou des corbeaux, des ours, des hypercarnivores tels que Crocodiliens, féliformes, Canidés, Mustelidés, Viverridés, serpents, vautours — appelés prédateurs), ainsi que le parasitisme, qui en général ne requiert pas la mort de l'animal consommé[6].
La perception de la prédation évolue au cours du temps : alors que les prédateurs traditionnels (serpent, crapaud) sont relégués en bas de la Scala naturæ au Moyen Âge ou qu'ils sont caractérisés par une ambivalence (chauve-souris, rapaces nocturnes, ours, loups), ils sont encore vus au XVIIIe siècle comme un mal nécessaire par Linné, naturaliste « fixiste » qui considère que tout être vivant sur terre est issu de la Création divine. Cette perception évolue avec Charles Darwin pour qui la prédation interspécifique et la cruauté de la concurrence intraspécifique sont des mécanismes purement et simplement « naturels », c'est-à-dire échappant totalement au jugement des hommes. Dès lors, les notions d'interactions néfastes qui se développent dans le cadre du darwinisme social, théorie qui reflète les idées de l'époque victorienne au Royaume-Uni, au moment où s'opère la transition d'une économie agraire à une économie industrielle capitaliste, font émerger les concepts de prédation, de survie du plus apte, de progrès entraîné par la compétition pour justifier un capitalisme sans frein à la fin du XIXe siècle[7],[8]. Les notions d'interactions bénéfiques apparaissent à la fin du XIXe siècle parmi des penseurs de sympathies socialistes ou anarchistes. Le développement de ces deux notions opposées le doit ainsi autant « à des irréductibilités de points de vue scientifiques qu’à des oppositions entre leurs prolongements philosophiques et sociétaux »[9]. Au débat politique sur le modèle économique prédateur et pilleur, succède à la fin du XXe siècle l'éthique de la prédation[10] et du « principe de naturalité » qui s'inscrivent dans le cadre plus général de l'éthique animale (et de son bien-être) et l'éthique environnementale[11].
La complexité du réseau trophique, notamment au niveau des micro-organismes (certains mixotrophes puisent leur énergie parfois de la lumière par photosynthèse et parfois de la prédation par assimilation d'autres organismes vivants), des comportements omnivores ou du continuum d'interactions entre prédation et parasitisme, remet en question la notion de niveau trophique et le classement producteurs primaires, consommateurs primaires (herbivores) et consommateurs secondaires, tertiaires… (prédateurs), d'où la mise en avant par le chercheur Steve Cousins[12] du concept de continuum trophique plutôt que de niveaux trophiques discrets[13].
Cela n'empêche pas la prédation de faire l'objet encore de nombreuses recherches sur les pressions de sélection qu'elle exerce et les réponses adaptatives des proies, sur l'évolution des stratégies de prédation et des défenses anti-prédation ou la course aux armements évolutive. Courante dans la nature où les prédateurs jouent un rôle prépondérant dans le maintien des équilibres écologiques, elle est un des facteurs écologiques majeurs dans la dynamique des écosystèmes et peut-être le facteur majeur par lequel la sélection naturelle a déterminé la fréquence des traits d'histoire de vie dans les populations[4].
Dynamique des systèmes prédateurs-proies

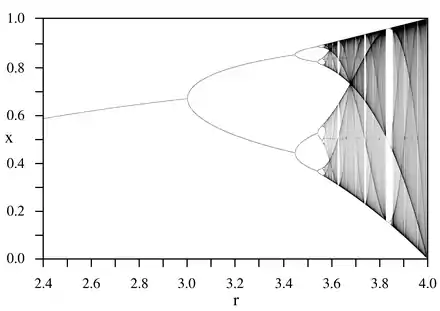

Les relations entre proie et prédateur déterminent le fonctionnement et l'organisation des réseaux alimentaires dits « réseaux trophiques » (ou pyramides alimentaires), avec à leur sommet des prédateurs dits « absolus » (ceux qui ne sont pas eux-mêmes la proie d'autres prédateurs).
Les prédateurs influent sur la dynamique prédateurs/proies et donc sur les populations des proies. Ils contribuent à maintenir l'équilibre biologique des écosystèmes et influent indirectement sur le paysage et les habitats naturels. C'est pour protéger les arbres qu'on a réintroduit en 1994 des loups d'Alberta dans le Parc national de Yellowstone afin qu'ils régulent les populations de wapitis et autres grands herbivores qui étaient devenues assez importantes pour mettre en péril la forêt (par consommation des jeunes plants, écorçage… et surexploitation du milieu).
La dynamique de l'évolution des effectifs relatifs d'un système proie/prédateur est un sujet complexe. Même le modèle le plus simple, basé sur l'équation logistique, comporte des développements très poussés sur le seul plan mathématique.
Prédateur et déprédateur
Le terme de prédateur est à ne pas confondre avec la notion de déprédateur, qui désigne un animal qui commet des dégâts sur une plante ou des denrées, le plus souvent dans le but de se nourrir et parfois pour marquer son territoire.
Type de prédateurs

Les prédateurs généralistes
Ils se nourrissent d'un large éventail de proies, leur population est relativement stable, et ils contribuent à exercer un contrôle continu sur le niveau des populations de proies.
Les prédateurs spécialistes
Ils se nourrissent d'une ou d'un petit nombre d'espèces (ex : Harfang des neiges et lemmings). Chez les mammifères, les véritables prédateurs spécialistes semblent rares. Le putois (Mustela putorius L.) est par exemple considéré comme « un prédateur spécialiste régulier du lapin et un prédateur temporaire des petits rongeurs »[18]. Ce type de prédateur est souvent apparemment spécialiste d'une espèce quand celle-ci est très abondante (ex : hermine face au campagnol[19]), et il diversifie ses proies en cas de nécessité.
Les prédateurs nomades
A la différence de la murène qui passe sa vie au même endroit, certains requins et d'autres prédateurs spécialistes font des milliers de km à la recherche de proies dispersées ou en migration. Sur terre, ainsi des loups suivent les troupeaux de caribous ou des hyènes et des lions suivent les migrations de troupeaux de gnous : Les prédateurs nomades qui se déplacent là où leurs proies sont les plus abondantes ou suivent leurs migrations saisonnières sont supposés mieux contribuer à la stabilisation des populations-proies dont ils vivent[20],[21],[22].
Les microprédateurs
Terme parfois employé dans certains contextes pour désigner les espèces prédatrices de petite taille (musaraigne, etc.) ou des espèces de petites taille par rapport à celle de ses proies dont elles se nourrissent en s'attachant à ces dernières (exemple : tiques, moustiques)[23].
Remarques
- Quand une espèce de prédateur est introduite hors de son milieu d'origine, si elle s'adapte à son nouvel environnement, elle peut parfois devenir une espèce exotique envahissante[24]. Ce fut le cas par exemple de la perche du Nil (prédateur généraliste) introduite dans certains lacs africains où elle a entraîné la disparition de plusieurs espèces. Il en va de même pour le chat domestique (prédateur généraliste) introduit dans certaines îles.
- Dans le contexte utilitaire de la lutte intégrée, on distingue parfois une prédation de choc et de fond ; ainsi, Anthocoris sp. a un comportement de prédateur de choc sur les populations larvaires de psylle du poirier (Psylla pyri) qu'il cible spécifiquement, alors que les mirides ou les forficules[25] jouent un rôle de prédateurs de fond en s'attaquant aussi à d'autres espèces. L'effet de prédation « de choc » est recherché par la lutte biologique contre les déprédateurs en favorisant le maintien et de développement in situ d'organismes prédateurs, parasites et parasitoïdes de ces ennemis des cultures.
L'homme
Depuis qu'il a maîtrisé l'agriculture et l'élevage, l'homme n'a que peu recours à la prédation pour se nourrir - à l'exception notable du cadre de la pêche en mer et moindrement de la chasse (la recherche de viande de brousse reste une activité importante dans certains pays[26] (y compris pour l'approvisionnement urbain[27]), et il reste quelques populations autochtones vivant essentiellement de la chasse et/ou de la pêche).
Il n'en reste pas moins capable, si nécessaire (ou s'il le souhaite, dans le cadre de la pêche ou de la chasse sportives ou de loisir), de tuer n'importe quelle espèce animale et de consommer sa chair.
Inversement, aucune espèce animale, dans des conditions normales, ne s'attaque à l'homme pour se nourrir. L'homme est donc parfois considéré comme le superprédateur ultime.
Modes et stratégies de prédation

Les prédateurs - selon l'espèce et/ou selon les conditions du milieu - chassent en groupe ou en solitaire.
Trois grandes stratégies existent :
- Chasse « active » (en solitaire ou en groupe) (ex : loup),
- Chasse à l'affut (l'araignée sur sa toile),
- chasse « passive » (ex : filtreur fixe se nourrissant de zooplancton, anémone de mer, méduse).
Remarque : Quelques familles ou espèces sont herbivores ou omnivore à l'état de larve et prédatrices à l'état adulte (ex : grenouilles, crapauds). Dans ce cas elles ont aussi changé de milieu de vie (aquatique à semi-aquatique ou terrestre). Inversement certaines espèces peuvent être prédateurs insectivores jeune, puis plutôt granivore ensuite (la perdrix par exemple).
La nature présente une variété considérable de modes et stratégies de prédation. En voici quelques-unes :
- Les grands carnassiers terrestres (comme les félins) se précipitent sur leurs proies (solitairement ou en groupe) ou les poursuivent pour les tuer par étouffement ou par rupture des vertèbres ;
- Certains insectes comme les guêpes paralysent les proies qu'ils destinent à leurs larves ;
- Quelques espèces chassent en groupe ou en essaims avec des comportements synchronisés et adaptés qui laissent moins de chance à leur proies de leur échapper. Cette méthode de prédation est appelée synchroprédation. (Voir illustration ci-contre à partir de vidéos prises in situ par le laboratoire ATOLL) ;
- Les faucons utilisent leur pointe de vitesse en vol pour surprendre leur proie ;
- Quelques espèces, profitant des activités humaines ont récemment développé des comportements opportunistes (goélands ayant appris à se nourrir de vers de terre rendus disponibles par le labour, guêpes pillant le matin les provisions accumulées par des araignées sous des luminaires dans la nuit, chauve-souris profitant de l'attraction d'insectes nocturne par les lampadaires, phoques veaux marins capturant les jeunes saumons dévalant une rivière de nuit, sous les lampadaires d'un pont[28], etc.
Conséquences de l'hétérogénéité spatiale dans les interactions de prédation
Hétérogénéité spatiale
D’après Guyon (2005), l’hétérogénéité spatiale se définit comme une composante structurelle du paysage[29]. C’est une mesure qui prend en compte la complexité et la variabilité des propriétés (taille, forme) d’un système écologique dans l’espace. Elle peut se traduire par la diversité des éléments (biotiques et abiotiques) et leurs relations spatiales. L’homogénéité étant rare dans la nature, il serait important de prendre en compte le facteur de variabilité de l’espace pour considérer les interactions de prédation.
Échelles d'hétérogénéité
Les conséquences de l’hétérogénéité spatiale sur le risque de prédation s’observent à différentes échelles pour lesquelles une hétérogénéité est observée.
Par exemple en milieu urbain, d’après une étude de D. Frey et al. (2018), l’hétérogénéité s'observe à différentes échelles spatiales[30]. A petite échelle, il existe une forte variation de la végétation ligneuse, allant de patchs de végétation simplifiée (comme des arbres coupés uniformément sans sous-étage) à des patchs complexes avec différentes couches de végétation (avec des arbres et arbustes de différentes tailles) correspondant à une hétérogénéité verticale.
A plus grande échelle, l’hétérogénéité s’observe avec une forte variabilité du paysage urbain, mais de manière plus générale, la couverture végétale ligneuse diminue avec l'augmentation de la densité des terrains pavés.
De même, il est possible d’observer l’hétérogénéité spatiale en milieu marin. Il est en effet possible par exemple d’observer différents pourcentages de recouvrement du sol par des posidonies. Les “lits” qu’elles forment ont des formes et des tailles différentes et peuvent être inégalement réparties dans l’espace[31]. Des expériences menées par Irlandi et al. ont montré que ces formes d’hétérogénéité ont des conséquences sur la prédation des praires (bivalves). Ces derniers ont une survie deux fois plus élevée dans des zones où le pourcentage de recouvrement est de 99 % que dans des zones où le recouvrement est à 23%[31].
Hétérogénéité spatiale et type de prédateur
Selon l’hétérogénéité observée dans l’environnement, les prédateurs vont être plus ou moins avantagés, selon les types de proies qu’ils consomment et leur mode de prédation ou encore leurs caractéristiques physiques. L’hétérogénéité verticale de la végétation ligneuse augmente le risque de prédation des proies par les oiseaux et les arthropodes dans les jardins urbains, mais ces différentes espèces de prédateurs peuvent présenter des activités de prédation contrastées. D’après D. Frey et al., dans les paysages modérément urbanisés l'hétérogénéité de l'habitat boisé favoriserait plus efficacement la prédation par les oiseaux que par les arthropodes, car les premiers chassent au niveau des branches supérieures des arbustes, alors que les seconds présente des taux de prédation plus élevés au niveau du sol. Cela serait dû à la mobilité plus faible des arthropodes, et donc à leur type de prédation.
Impact de l’hétérogénéité spatiale sur les prédateurs généralistes et spécialistes
Les prédateurs se distinguent en deux catégories selon leurs ressources alimentaires :
- les prédateurs spécialistes,
- les prédateurs généralistes
Au vu de leurs régimes alimentaires, les prédateurs spécialistes ou généralistes ont une préférence pour une certaine représentation spatiale des paysages. Si le paysage est hétérogène, c’est-à-dire avec une grande diversité de ressources, alors les généralistes sont favorisés car ils ont accès à plus de proies. Au contraire, les spécialistes ne tirent pas de bénéfices de cette hétérogénéité car ils ne consomment qu’un seul type de proie et donc ne sont pas concernés par la diversité de proies possibles[29].
Un paysage hétérogène affecte donc positivement les prédateurs généralistes car les ressources sont plus abondantes et un paysage homogène (c’est-à-dire avec des ressources concentrées dans un même grand ensemble d’habitats) est plus favorable aux espèces spécialistes[32].
Par exemple, la perdrix grise (Perdix perdix) est un oiseau vivant dans les milieux agricoles et qui connaît un déclin de population liées aux techniques de l’agriculture moderne (modification des paysages, utilisation des produits phytosanitaires) mais aussi à cause de la prédation. La perdrix grise est la proie de nombreux prédateurs terrestres (martes, fouines, renards) ou aériens (busard Saint-Martin ou busard cendré). Ces prédateurs sont pour la plupart des généralistes, mais le busard Saint-Martin peut être considéré comme un « semi-spécialiste » car d’ordinaire, il se nourrit principalement de rongeurs. Mais dans le contexte des régions céréalières, il se nourrit aussi de perdrix grises. Le busard Saint-Martin se spécialise sur les proies les plus abondantes localement et donc le régime alimentaire de cette espèce est différent selon les milieux. Ce type de spécialisation est appelé « spécialisation opportuniste »[33].
Cet exemple permet, en s'intéressant à l’impact de l’hétérogénéité spatiale chez une proie, d’étudier en même temps cet impact chez les prédateurs.
Selon Guyon (2005), le paysage influence les communautés de prédateurs, dans leurs déplacements, leur temps de recherche, de capture et donc cela influence les populations de proies de manière indirecte[29]. Le paysage est un filtre des relations proies/prédateurs. En effet, dans un paysage plus homogène (de type parcelles de champs), les proies sont plus exposées aux prédateurs aériens et donc leur mortalité est plus importante. Dans un paysage hétérogène (type boisement), les proies sont aussi très exposées aux prédateurs terrestres[32],[29]. Gorini et al. (2011) montrent également que la variation spatiale peut induire un changement d’habitat par les proies pour échapper à un prédateur, mais en étant ainsi exposées plus facilement à un autre type de prédateur.
Impact de la fragmentation sur les prédateurs spécialistes et généralistes
Depuis le milieu du XXème siècle, l’agriculture a entraîné la fragmentation des espaces naturels. Celle-ci a inévitablement eu des impacts directs sur les habitats des espèces vivant dans ces milieux et des impacts indirects sur l’abondance, la diversité des espèces et les interactions entre-elles (de type proies/prédateurs)[33]. Cependant, selon les espèces et leurs besoins écologiques, la fragmentation n’aura pas le même effet.
Sans fragmentation, les habitats forment un paysage lisse alors que la fragmentation crée un paysage en forme de mosaïque où les habitats se retrouvent dispersés en « patchs » séparés les uns des autres. Un exemple de fragmentation en zone agricole est la transformation des zones boisées en bosquets. Par conséquent, si les ressources disponibles dans les patchs deviennent insuffisantes, les organismes vivant dans ceux-ci doivent se déplacer et parcourir de plus grandes distances pour trouver des ressources.
Cette fragmentation aura théoriquement un impact différent selon que l’espèce est spécialiste ou généraliste. En effet, les spécialistes sont régulés par l’abondance de leurs proies. La fragmentation de l’habitat aura donc un effet néfaste pour les proies et les prédateurs, car si le nombre de proies diminue dans une population, les prédateurs spécialistes auront accès à moins de ressources. Il sera alors possible d’observer une diminution des populations de prédateurs spécialistes.
Les prédateurs généralistes sont indépendants de leurs proies puisqu’ils se nourrissent de plusieurs types de proies. La fragmentation des habitats les affecte négativement ou positivement selon le degré d’intensité de celle-ci. Si une des proies du prédateur généraliste est très affectée et que sa population tend à diminuer, alors une mortalité possible sera observée chez ces prédateurs. A l’inverse, si la fragmentation entraîne une perte d’habitats pour un type de proies mais qu’une autre proie réussit à s’implanter dans cet environnement, le prédateur généraliste aura accès à des nouvelles ressources et cette fragmentation l’affectera positivement.
D’autre part, selon Gorini et al. (2011)[32], une fragmentation importante de l’habitat peut augmenter l’efficacité de détection des proies par un prédateur généraliste, alors qu’elle peut diminuer l’efficacité d’un prédateur spécialiste pour la capture et la mise à mort de sa proie[32].
L'expérience de Huffaker et le modèle de Hilborn[34],[35]
Les premières expériences sur les interactions prédateurs-proies, dans un système fermé, montraient que les organismes finissaient par s’auto-détruire par la mort d’abord de la proie puis du prédateur. En effet, le prédateur surexploite sa proie et s’éteint. Pour que le système soit durable, il faut qu’il soit régulé, en ajoutant par exemple des refuges pour les proies ; cela implique donc l’hypothèse d’un rôle régulateur de l’hétérogénéité spatiale. Selon Carl Barton Huffaker la variation spatiale peut être largement responsable de la persistance des systèmes de prédation naturels[35]. Il réalise une expérience, publiée en 1963, à partir des résultats qu’il avait obtenus en 1958 (Huffaker's mite experiment)[35]. A l’aide de 252 oranges où le prédateur considéré est l’acarien Typhlodromus occidentalis et la proie le phytophage Eotetranychus sexmaculatus, il montre que les organismes se maintiennent plus longtemps en vie lorsque le milieu est hétérogène[35]. La complexité du système est assurée par le renouvellement de la surface de l’orange exposée.[35]
En 1975 Ray Hilborn modélise l’expérience de Huffaker mais en prenant en compte 50 oranges[34]. Il ne considère pas une cachette pour les proies mais considère que les proies et prédateurs peuvent disperser de manière complètement aléatoire[35]. Une fois que l’orange a été colonisée par les proies, celles-ci se maintiennent jusqu’à une capacité de charge (K) et restent à ce niveau jusqu’à ce que l’orange soit colonisée par les prédateurs qui dispersent[34]. Les prédateurs exploiteront alors les proies jusqu’à l’extinction.[34]
Il y a trois résultats pour ce modèle : soit la proie et le prédateur sont portés à l’extinction; soit le prédateur ne possède pas des capacités suffisantes de dispersion et meurt n’ayant pas atteint les proies; soit les proies et les prédateurs persistent[34]. Les trois résultats dépendent de deux paramètres : la capacité de dispersion de la proie et la capacité de dispersion du prédateur. Aucune prédiction définitive ne peut être faite, car les systèmes sont entre eux très variables : pour certains, si on augmente la capacité de dispersion du prédateur le système sera plus stable, pour d’autres ce sera l’inverse[34]. De plus à travers ce modèle, Hilborn montre que plus le nombre de cellules augmente, plus la surface est grande, plus il y a des chances de survie du système car la probabilité d’échappement de la proie augmente[34].
L’« hypothèse de l'ennemi naturel » de Root (1973)
L'hétérogénéité de l'habitat joue un rôle important dans les interactions entre les plantes, les herbivores et leur prédateurs.
Selon Bellone et al. qui énoncent “l'hypothèse de l'ennemi naturel” de Root (1973), les insectes prédateurs et les parasites contrôlent plus efficacement les populations d’insectes herbivores dans des habitats ou communautés de plantes complexes, telles que les polycultures, que dans des environnements plus simples (monocultures)[36]. Ainsi, le taux de prédation sur les herbivores serait supérieur dans les polycultures. En effet, dans les communautés de plantes variées, la densité d’ennemis naturels est accru grâce à de meilleures conditions pour leur survie, ce qui augmente la pression de prédation. De plus, les polycultures offrent des refuges pour les proies, ce qui leur permet de ne pas être complètement éradiquées.
Ces structures d'habitat variées fournissent également des ressources supplémentaires comme le pollen et le nectar qui attirent les ennemis naturels et augmentent leur potentiel de reproduction, accroissent la diversité d'insectes herbivores servant de source de nourriture alternative aux prédateurs, et augmentent la couverture du sol qui favorise certains prédateurs.
Ces communautés hétérogènes abritent également une diversité d’herbivores avec différentes phénologies, fournissant ainsi un approvisionnement constant de proies aux prédateurs. Ainsi, une hétérogénéité plus forte pourrait augmenter la mortalité des herbivores par ce contrôle de type ''top-down'', les prédateurs limitant les populations de proies.
Risque de prédation
De par son influence sur les étapes de la prédation, l'hétérogénéité spatiale peut avoir des conséquences sur la réponse fonctionnelle du prédateur[37],[32],[38]. En étudiant les systèmes proie-prédateur chez les mammifères, Gorini et al. (2011) ont observé que la variabilité spatiale modifiait la disponibilité des proies pour le prédateur[32].
Hauzy et al. (2010) ont déterminé expérimentalement l’effet de la densité d’obstacles sur la réponse fonctionnelle dans le système proie-prédateur “Folsomia candida-Pergamasus crassipes”[37]. A l’issue de leurs expériences, les auteurs ont remarqué que le taux d’attaque n’était pas influencé par la densité de proies ou de prédateurs, mais par la densité d’obstacles. Le même résultat est obtenu pour le taux de rencontre entre deux prédateurs. Le temps de manipulation (i.e. de consommation) n’est pas influencé par la densité d’obstacles, par la densité de prédateurs, ni par la densité de proies. Deux mécanismes sont proposés pour expliquer ces résultats : les obstacles modifient la trajectoire des prédateurs. Il y a alors une plus grande probabilité que le prédateur aille dans une zone où il a déjà mangé toutes les proies. Il se peut les prédateurs perdent du temps à reconnaître les obstacles et à les manipuler. Ils ont ainsi moins de temps pour chercher des proies.
Trochine et al. (2005)[38] mettent en évidence une influence claire de l’hétérogénéité spatiale sur les taux de prédation du turbellarié Mesostoma ehrenbergii sur les copépodes Boeckella gracilis et Acanthocyclops robustus. En effet, une diminution de la prédation est observée dans les milieux hétérogènes comparé aux milieux homogènes, amenant l’hypothèse que la complexité de l’habitat diminue la capacité de prédation pour ce système proie-prédateur. Cependant, le taux de prédation le plus faible est présent dans des milieux d’hétérogénéité médium, ce qui permet de déduire que ce type de milieux favorise la fuite des proies, ou diminue leur détection.
D. Bellone et al. se sont intéressés à cette influence de l’hétérogénéité de l’habitat à travers l’étude de la prédation des petits mammifères sur les cocons de Diprion du pin sylvestre en forêt[36].
Les petits mammifères (musaraigne commune (Sorex araneus), campagnol des prés (Myodes glareolus)), sont des prédateurs généralistes qui régulent la dynamique des populations d'insectes herbivores dans les écosystèmes forestiers. L'abondance des petits mammifères et donc les interactions de prédation peuvent être affectées par l'hétérogénéité de l'habitat, considérée ici comme la densité de la végétation, la couverture, la hauteur de la végétation du sous-étage et la présence de bois mort.
La densité des arbres ainsi que la présence de bois mort augmentent la proportion de cocons prédatés. En effet, cela augmente la présence de petits mammifères grâce à une abondance plus importante de ressources alimentaires liées à la végétation (graines, baies) ou au bois mort (champignons, lichens, insectes). Ainsi, cette hétérogénéité de l'habitat induit une pression de prédation accrue. De plus, la présence de bois mort et la forte densité d'arbres, protègent les petits mammifères lors de l'alimentation leur offrant le potentiel d'accroître leur activité alimentaire.
La proportion de pins a au contraire un effet négatif global sur le taux de prédation sur les cocons. Dans ces peuplements plus homogènes avec une forte proportion de pins, les habitats sont pauvres et secs, et entraînent une réduction de la présence de petits mammifères et donc une diminution de la prédation.
Étapes de prédation
La variation spatiale joue sur le taux de prédation car elle peut influer les différentes étapes de la prédation[32] et aura des effets différents selon les perturbations engendrées sur l’espace :
- Impact sur la recherche (détection) et l’attaque
Des variations de l’espace peuvent modifier le nombre de prédateurs ; en fonction du risque de prédation perçu par les proies, celles-ci vont changer leur utilisation de l’espace. Ainsi, Les proies peuvent migrer vers d’autres milieux :
- Soit, des espaces à plus faible densité de prédateurs (voire vers des espaces où les prédateurs ne peuvent pas les suivre) ce qui réduirait leur taux de détection et de rencontre par ces prédateurs.
- Soit, des espaces où les ressources sont meilleures mais à plus forte densité de prédateurs, si la compétition est trop importante dans les espaces avec peu de prédateurs. Dans ce cas, le risque de prédation et le taux de rencontre d’un prédateur augmentent.
La détectabilité varie également selon la densité de proies de l’environnement. D’après D. Bellone et al.[36], les groupes de cocons de tailles différentes, prédatés par les petits mammifères, diffèrent par leur détectabilité. En effet, les groupes de 50 cocons sont plus détectés que les groupes de 10 cocons ou les cocons seuls. Cependant, au cours de l’expérimentation, un cocon seul présentait 48 % de chances d'être détecté et prédaté, contre 24 % si, au contraire, le cocon faisait partie d'un groupe plus important. La probabilité de survie plus élevée au sein d'un groupe important fait partie d'un mécanisme appelé «effet de dilution».
Si la variation de la couvrance disponible dans l’habitat varie, c’est-à-dire si le nombre de cachettes, d’abris, de structures protectrices ou d’obstacles est modifié, la probabilité de détection par le prédateur varie également. Par exemple, des obstacles peuvent forcer les proies à emprunter certains couloirs fréquentés par les prédateurs, et ainsi favoriser leur rencontre. D’autre part, l’ouverture de l’habitat varie et modifie la visibilité de la proie pour le prédateur, mais également la détection du prédateur pour la proie.
En fonction de la variation de l’espace, les prédateurs sont affectés différemment selon leur stratégie de prédation : d’après Gorini et al. (2011)[32], une variation du terrain influe davantage sur la chasse d’un prédateur actif par rapport à celle d’un prédateur à l’affût. En effet, cette modification spatiale a plus d’impact sur l’attaque (étape fondamentale de la stratégie de prédation active), par la présence d’obstacles ou de cachettes, par exemple. En revanche, les prédateurs à l’affût sont eux plus sensibles à une modification spatiale qui a un impact sur leur temps de détection (par exemple une modification du couvert végétal).
- Capture, mise à mort, et consommation
Les obstacles spatiaux et cachettes peuvent empêcher la capture des proies par les prédateurs.
D’autre part, l’espace influe sur les conditions physiologiques de la proie car son hétérogénéité induit la variation de la quantité de ressources. Cela a des conséquences directes sur la capacité de défense de la proie, et donc sur la capacité de mise à mort par le prédateur.
L’hétérogénéité de l’habitat peut également favoriser la compétition entre prédateurs, en influant notamment sur l’ouverture de l’habitat : un espace plus ouvert (moins hétérogène) offre une meilleure visibilité pour le prédateur, mais également pour d’autres, ce qui favorise la compétition entre prédateurs et diminue le taux de capture et de consommation pour un prédateur.
Selon D. Frey et al. (2018)[30], le risque de prédation par les oiseaux en zone urbaine est significativement plus élevé dans les jardins hétérogènes. Dans les zones urbaines où les ressources sont rares, ces jardins représentent un environnement favorable pour les oiseaux où ils peuvent se nourrir, se cacher et nicher. On retrouve des réponses similaires dans les paysages agricoles et les forêts où une répartition inégale des ressources et/ou une perte d'habitat peuvent conduire à des concentrations locales d'organismes et avoir des conséquences fonctionnelles telles qu'une prédation accrue.
D’autre part, dans les habitats homogènes de jardins au sein de zones urbaines où la quantité d'habitat boisé est élevée la prédation n’augmente que faiblement. Cela peut s'expliquer par une combinaison de prédateurs en excès (et donc de la compétition entre prédateurs), et une détectabilité et accessibilité accrue des proies dans ces types de jardins.
Le risque de prédation par les arthropodes s’oppose à ce qui est observé pour les oiseaux. En effet, la prédation augmente dans les habitats de jardin homogènes, comme dans des jardins de paysages agricoles pauvres en arbres.
Auxiliaires de l'agriculture
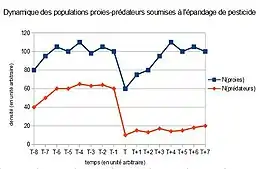
De nombreux petits prédateurs sont depuis longtemps considérés comme auxiliaires de l'agriculture ou du jardinage (hérisson, grenouille, crapaud, tritons, orvet et certains oiseaux grands consommateurs de chenilles, d'escargots et de limaces, coccinelle prédatrice de pucerons, etc), mais ils ont disparu d'une grande partie de leur aire naturelle de répartition, notamment à cause des pesticides qui les privent de leurs proies et/ou les empoisonnent. Le labour et certaines pratiques agricole intensive (remembrement, recul du bocage et arrachage des haies) leur sont aussi défavorables.
Quelques espèces (rapaces, nocturnes notamment) ont souvent été mal aimés avant que ce rôle leur soit reconnu. Pour des raisons culturelles, sociologiques, historiques (l'Ours des cavernes et le lion des cavernes ont sans doute été des prédateurs redoutables pour l'homme jusqu'à leur disparition il y a moins de 10 000 ans), les grands prédateurs carnivores ont longtemps été considérés comme « nuisibles » et pourchassés jusque dans leurs derniers refuges. Leur réapparition ou réintroduction ne se fait pas sans compromis, parfois difficiles avec une partie des habitants et usagers du milieu, qui ont perdu l'habitude de vivre avec eux[39].
Biogéographie de la prédation
Dans les écosystèmes des terres émergées, il a été constaté que les interactions biotiques (notamment la concurrence interspécifique et la prédation) augmentent de manière générale en intensité aux altitudes basses et aux latitudes supérieures selon un gradient retrouvé aux échelles mondiales et régionales. La prédation est plus intense en forêt tropicale humide[40]. Dans les zones plus chaude le développement est plus rapide, mais la pression de prédation est également plus intense[41].
Par exemple, Roslin et al. (2017) ont disposé de fausses chenilles (plasticine verte) sur des sites situés sur six continents et sur un gradient latitudinal de plus de 11 600 km. En observant les traces de morsures ou de bec laissés par les prédateurs, ils ont constaté que le taux de prédation sur ces pseudo-chenilles augmentait en s'approchant de l'équateur. De plus, les prédateurs y sont plus souvent des prédateurs d'arthropodes (comme les fourmis) que des oiseaux et mammifères[41].
Pour les espèces de cours d'eau des évènements tels que les étiages de sécheresses peuvent augmenter l'exposition d'espèces telles que les poissons ou écrevisses à la prédation[42].
Bioindicateurs, Biointégrateurs
L'évaluation de l'intensité de la prédation dans un territoire se fait généralement par le suivi de proies représentatives (espèces sentinelles le cas échéant)[43] ou parfois de proies artificielles (chenille artificielle par exemple[41]). Diverses méthodes ont été établies pour inventorier les proies de prédateurs invertébrés, éventuellement microscopiques[44].
Les prédateurs (naturels), de par leur position en tête de pyramide alimentaire et de par leurs fonctions écosystémiques sont considérés comme de bons bioindicateurs. Leur organisme bioconcentre de nombreuses substances toxiques et écotoxiques (métaux lourds, PCB, dioxines, pesticides, perturbateurs endocriniens…) qui sont souvent cause de leur régression ou disparition et qui peuvent alerter les décideurs, épidémiologues et écoépidémiologistes. Ce sont aussi - pour les mêmes raisons - de bons biointégrateurs qui peuvent être utilisés pour un monitoring de l'environnement.
Introduit volontairement ou accidentellement hors de son milieu naturel, un prédateur spécialiste meurt généralement assez rapidement, car fragile, se reproduisant peu, et mal adapté à une autre niche écologique que la sienne. On ne connaît pas d'exemples d'invasions rapides d'un milieu par un grand prédateur introduit ou échappé.
Inversement un petit prédateur généraliste, souvent caractérisé par une plus grande plasticité écologique (adaptabilité) peut rapidement pulluler et devenir invasif et poser des problèmes écologiques, allant jusqu'à la disparition d'espèces devenues leurs proies (ex : coccinelle asiatique face à la coccinelle à 7 points, chat domestique lâché sur une île riche en oiseaux).
Une espèce introduite peut aussi en éliminer une autre par concurrence dans une même niche écologique. Par exemple, le vison d'Amérique tend à éliminer le vison d'Europe depuis son introduction sur ce continent[45].
Coévolution
En termes d'évolution et de sélection naturelle, on considère que les prédateurs coévoluent avec leurs proies, apprenant avec le temps à déjouer leurs stratégies adaptatives, ce qui explique aussi l'extrême spécialisation de certains prédateurs (ex : fourmilier, et les nombreux insectes hyperparasites qui ne s'attaquent qu'à une seule espèce-cible).
Notes et références
- Alain Rey, Dictionnaire historique de la langue française, Le Robert, , p. 2903 et 2912
- (en) Edouard Jurkevitch, Predatory Prokaryotes. Biology, Ecology and Evolution, Springer Science & Business Media, , 251 p. (lire en ligne)
- (en) Edouard Jurkevitch, Predatory Prokaryotes. Biology, Ecology and Evolution, Springer Science & Business Media, , p. 63-65
- (en) Brian D. Fath, Encyclopedia of Ecology, Elsevier, (lire en ligne), p. 365
- (en) Richard E. Blackwelder, Handbook of Animal Diversity, CRC Press, , p. 121
- Robert Barbault, Écologie générale. Structure et fonctionnement de la biosphère, Masson, , p. 115
- (en) Richard C. Lewontin, « The Units of Selection », Annual Review of Ecology and Systematics, vol. 1, , p. 1-18 (DOI 10.1146/annurev.es.01.110170.000245).
- Pascal Acot, Histoire de l'écologie, Presses universitaires de France, , p. 197
- Marc-André Selosse, « Symbiose et mutualisme versus évolution : de la guerre à la paix ? », Atala, no 15, , p. 35.
- De nombreux articles sont consacrés à l'examen des arguments et des contre-arguments à ce sujet et qui ont conduit, dans les années 1980, à la rupture entre éthique animale conséquentialiste sentientiste, et éthique environnementale écocentrée : cf. (en) John Baird Callicott, « Animal Liberation : A Triangular Affair », Environmental Ethics, no 2, , p. 311-338 ; (en) Mark Sagoff, « Animal Liberation and Environmental Ethics : Bad Marriage, Quick Divorce », Osgoode Hall Law Review, no 22, , p. 297-230 ; (en) Kent Baldner, « Realism and Respect », Between The Species, vol. 6, no 1, , p. 1-8 ; (en) Charles K. Fink, « The Predation Argument », Between The Species, vol. 13, no 5, , p. 1-15 ; Thomas Lepeltier, « Faut-il sauver la gazelle du lion ? », in La révolution antispéciste, PUF, 2018
- « Malgré une forte communauté d’inspiration, éthique environnementale et éthique animale ne s’entendent guère sur le statut de l’animal. La première reproche à la seconde son étroitesse quant à son motif – centré sur la souffrance – et à son point de vue, strictement individuel. Elle se pose pour sa part comme une conception éthique moins tributaire de l’émotion, plus instruite par la science et possédant une plus grande ampleur de vue prenant en compte les ensembles naturels. La seconde ne manque cependant pas de répondant critique, incriminant la première de carence dans son fondement éthique lui-même. Des perspectives de réconciliation ne semblent toutefois pas impossibles si tant est que l’on admette de reconnaître deux statuts éthiques différents de l’animal : celui de l’intégrité pour l’animal sauvage et celui s’inspirant du modèle du contrat pour l’animal domestique. ». cf. Jean-Luc Guichet, « La question animale dans l'éthique environnementaliste », Journal International de Bioéthique, vol. 24, no 1, , p. 29.
- (en) Steve Cousins, « The decline of the trophic level concept », Trends in Ecology & Evolution, vol. 2, no 10, , p. 312-316 (DOI 10.1016/0169-5347(87)90086-3)
- (en) Bernard C. Patten, Sven Erik Jørgensen, Complex Ecology : The Part-whole Relation in Ecosystems, Prentice Hall, , p. 521
- Odum EP (1953) Fundamentals of ecology. WB Saunders, Philadephia
- Udvardy, M. F. (1959). Notes on the ecological concepts of habitat, biotope and niche. Ecology, 725-728.
- Zhang Z, Tao Y & Li Z (2007) Factors affecting hare-lynx dynamics in the classic time series of the Hudson Bay Company, Canada. Climate Research, 34(2), 83.
- certains champignons s'attaquant à des animaux vivants peuvent aussi être considérés comme des exceptions.
- Roger M (1990) Analyse d'un système proies-prédateur: le modèle" lapin-petits rongeurs-putois" (thèse de doctorat) (Notice Inist-CNRS).
- Pascal, M. (1993) Perspectives de lutte biologique contre les Rongeurs champêtres. Le Courrier de l'environnement de l'Inra, (19), 45-52.
- Hanski I, Hansson L, Henttonen H (1991) Specialist predators, generalist predators and the microtine rodent cycle. Journal of animal ecology 60-1 353-367 doi:10.2307/5465
- Ims R & Steen H (1990) Geographical synchrony in microtine population cycle a theoretical evaluation of the role of nomadic avian predators. Oikos 57:381-387
- Ims R.A, Henden J-A Killengreen S.T (2008) Collapsing population cycles. Trends in Ecology and Evolution 23:79-86
- François Ramade (2008), Dictionnaire encyclopédique des sciences de la nature , voir entrée microprédateur, p 372
- Zarzoso-Lacoste, D. (2013). Vers une meilleure compréhension des interactions trophiques directes et indirectes entre prédateurs invasifs et espèces natives au sein des écosystèmes insulaires (Doctoral dissertation, Aix-Marseille).
- Sauphanor, B., Lenfant, C., Brunet, E., & Faivre D'Arcier, F. (1994). Regulation des populations de Psylle du poirier Cacopsylla pyri (L.) par un predateur generaliste, Forficula auricularia L. IOBC wprs Bulletin, 17, 125-125.
- Bahuchet S (2000) La filière “viande de brousse”. Les Peuples des forêts tropicales aujourd'hui: volume II, Une approche thématique, 331-363.
- Bahuchet, S., & Ioveva-Baillon, K. (1998). Le rôle de la restauration de rue dans l'approvisionnement des villes en viande sauvage : le cas de Yaoundé (Cameroun). Villes du Sud et environnement, 171-182.
- YURK H. & TRITES A.W. (2000) ; Experimental attemps to reduce predation by Harbour seals on out-migrating juvenile salmonids. Trans. Am. Fish. Soc. 129 : 1360-1366.
- GUYON, Jérémy. Influence de l’hétérogénéité du paysage sur l’utilisation de l’espace et l’interaction habitat-prédation. Exemple de la perdrix grise en plaine céréalière [en ligne]. Thèse de doctorat : biologie. Rennes : Université de Rennes 1, 2005. [consulté le 27 novembre 2018]. Disponible à l’adresse : http://citeseerx.ist.psu.edu/viewdoc/download?doi=10.1.1.710.4305&rep=rep1&type=pdf
- (en) David Frey, Kevin Vega, Florian Zellweger et Jaboury Ghazoul, « Predation risk shaped by habitat and landscape complexity in urban environments », Journal of Applied Ecology, vol. 55, no 5, , p. 2343–2353 (ISSN 1365-2664, DOI 10.1111/1365-2664.13189, lire en ligne, consulté le )
- (en) E. A. Irlandi, « Large- and small-scale effects of habitat structure on rates of predation: how percent coverage of seagrass affects rates of predation and siphon nipping on an infaunal bivalve », Oecologia, vol. 98, no 2, , p. 176–183 (ISSN 1432-1939 et 0029-8549, DOI 10.1007/BF00341470, lire en ligne, consulté le )
- (en) Lucrezia Gorini, John D. C. Linnell, Roel May et Manuela Panzacchi, « Habitat heterogeneity and mammalian predator–prey interactions », Mammal Review, vol. 42, no 1, , p. 55–77 (ISSN 1365-2907, DOI 10.1111/j.1365-2907.2011.00189.x, lire en ligne, consulté le )
- (en) Krista L. Ryall et Lenore Fahrig, « Response of Predators to Loss and Fragmentation of Prey Habitat: A Review of Theory », Ecology, vol. 87, no 5, , p. 1086–1093 (ISSN 1939-9170, DOI 10.1890/0012-9658(2006)87[1086:ROPTLA]2.0.CO;2, lire en ligne, consulté le )
- (en) « The effect of spatial heterogeneity on the persistence of predator-prey interactions », Theoretical Population Biology, vol. 8, no 3, , p. 346–355 (ISSN 0040-5809, DOI 10.1016/0040-5809(75)90051-9, lire en ligne, consulté le )
- (en) S. Herman, K. Shea et C. Huffaker, « Experimental studies on predation: Complex dispersion and levels of food in an acarine predator-prey interaction », Hilgardia, vol. 34, no 9, , p. 305–330 (ISSN 0073-2230, DOI 10.3733/hilg.v34n09p305, lire en ligne, consulté le )
- (en) Davide Bellone, Maartje J. Klapwijk et Christer Björkman, « Habitat heterogeneity affects predation of European pine sawfly cocoons », Ecology and Evolution, vol. 7, no 24, , p. 11011–11020 (ISSN 2045-7758, PMID 29299277, PMCID PMC5743652, DOI 10.1002/ece3.3632, lire en ligne, consulté le )
- (en) Roger Arditi, Grégory Paul, Thierry Spataro et Thomas Tully, « Spatial heterogeneity and functional response: an experiment in microcosms with varying obstacle densities », Oecologia, vol. 163, no 3, , p. 625–636 (ISSN 1432-1939 et 0029-8549, DOI 10.1007/s00442-010-1585-5, lire en ligne, consulté le )
- (en) Esteban Balseiro, Beatriz Modenutti et Carolina Trochine, « Influence of spatial heterogeneity on predation by the flatworm Mesostoma ehrenbergii (Focke) on calanoid and cyclopoid copepods », Journal of Plankton Research, vol. 28, no 3, , p. 267–274 (ISSN 0142-7873, DOI 10.1093/plankt/fbi071, lire en ligne, consulté le )
- 2007 -« Crier au loup pour avoir la peau de l'ours. Une géopolitique locale de l'environnement à travers la gestion et la conservation des grands prédateurs en France ». Thèse de 3e cycle (Agro-Paris-Tech'- ENGREF, École Nationale du Génie Rural des Eaux des Forêts), Paris, 649 p.
- Liza S. Comita (2017) How latitude affectts biotic interactions ; Science, 30 Juin 2017:Vol. 356, Issue 6345, pp. 1328-1329 ; DOI: 10.1126/science.aan6356 (2017)
- Roslin, T., Hardwick, B., Novotny, V., Petry, W. K., Andrew, N. R., Asmus, A., ... & Cameron, E. K. (2017). Higher predation risk for insect prey at low latitudes and elevations. Science, 356(6339), 742-744.
- Patrick J. Wolff, Christopher A. Taylor, Edward J. Heske, and Robert L. Schooley, "Predation risk for crayfish differs between drought and nondrought conditions," Freshwater Science 35, no. 1 (March 2016): 91-102. https://doi.org/10.1086/683333
- Lövei, G. L., & Ferrante, M. (2016). A review of the sentinel prey method as a way of quantifying invertebrate predation under field conditions. Insect science
- Birkhofer, K., Bylund, H., Dalin, P., Ferlian, O., Gagic, V., Hambäck, P. A., ... & Stenberg, J. A. (2017). Methods to identify the prey of invertebrate predators in terrestrial field studies. Ecology and Evolution.
- Bifolchi, A. (2007). Biologie et génétique des populations d'une espèce invasive: le cas du vison d'Amérique (Mustela vison Schreber, 1777) en Bretagne (Thèse de Doctorat, Université d'Angers).
Voir aussi
Bibliographie
- Benhammou Farid, 2007 - Crier au loup pour avoir la peau de l'ours. Une géopolitique locale de l'environnement à travers la gestion et la conservation des grands prédateurs en France. - Thèse de 3e cycle, Agro-Paris-Tech'- ENGREF, École Nationale du Génie Rural des Eaux des Forêts, Paris, 649 p.
- Benhammou Farid, 2003 - Les grands prédateurs contre l'environnement ? Faux enjeux pastoraux et débat sur l'aménagement des territoires de montagne. - Courrier de l'Environnement de l'INRA, févr. 2003, 48 : 5-12.
- Benhammou Farid, 2003 - Le loup (canis lupus) dans les Pyrénées, 1998-2003 : cas d'école pour anticiper le retour des prédateurs sauvages dans les territoires ruraux marginaux. - (en collab. avec O. Salvador), Sud-Ouest Européen, PUM, Toulouse, 16 : 85-93.
- Rémy E, Pellegrini P, 2006, Comment cohabiter avec une espèce prédatrice protégée en dehors des aires protégées ?, Colloque international GECOREV, Gestion concertée des ressources naturelles et de l’environnement, Université de Versailles Saint Quentin-en-Yvelines (UVSQ), 26-.
Articles connexes
- Équilibres prédateurs-proies
- Prédation intraguilde
- Chaîne alimentaire
- Réseau écologique
- Dynamique des populations
- Équilibre dynamique
- Écologie du paysage
- Arthropode prédateur des ravageurs
- Moyen naturel de défense des êtres vivants
- Réintroduction
- Hétérotrophie
- Modèle proie-prédateur
- Evolution des défenses anti-prédation
- Évolution des stratégies de prédation
Liens externes
- Base de données consacrée à la biologie de la conservation des carnivores
- Prédation : un des facteurs contrôlant les populations d'oiseaux
- Sur les épaules de Darwin, émission radio de France inter consacrée notamment au modèle prédateurs et proies de Vito Volterra.
- Les Auxiliaires, récits de l’oncle Paul sur les animaux utiles à l’agriculture par Jean-Henri Fabre [PDF]
- Portail de la zoologie
- Portail de l’écologie