Oiseau de mer
Le terme oiseau de mer (ou oiseau marin) renvoie à un ensemble aux limites assez mal définies : en réalité, la définition du groupe résulte plus d'une sorte de consensus, pour ne pas dire de tradition, sur les espèces à inclure et celles à exclure, que sur des règles taxonomiques, biologiques ou écologiques strictes. On classe habituellement dans ce groupe environ 305 espèces appartenant à huit familles, entretenant avec le milieu marin des relations de dépendance plus ou moins strictes pendant une partie importante de leur cycle annuel.
l'appellation « Oiseau de mer » s'applique en français à plusieurs taxons distincts.
.jpg.webp)
Taxons concernés
- Sphenisciformes
- Gaviiformes
- Procellariiformes
- Pelecaniformes pro parte
- Charadriiformes pro parte
Classification de Sibley-Ahlquist
- Anseriformes pro parte
- Ciconiiformes pro parte
Au-delà de l'extraordinaire variété des tailles, des structures ou des modes d'alimentation, les oiseaux marins partagent un certain nombre de caractéristiques communes imposées par la vie dans les milieux aquatiques salés, sous des conditions climatiques parfois rudes, sans qu'il leur soit souvent possible de s'y soustraire : structure particulière du plumage, aptitude au déplacement sur et dans l'eau, fécondité et maturité sexuelle tardive compensées par une longévité élevée, propension à former des colonies denses sur le littoral, etc.
Prédateurs situés en fin de chaîne alimentaire, ils héritent dans leur corps des polluants accumulés.
Certains de ces oiseaux sont considérés comme des bioindicateurs la qualité de leur environnement, et sont suivis comme tels[1].
Espèces concernées
Incertitude
L'incertitude sur le nombre total d'oiseaux de mer a deux origines.
- Des divergences sur le statut spécifique de telle ou telle forme. Par exemple, selon que l'on considère certains albatros comme des espèces à part entière ou comme des sous-espèces d'autres albatros (albatros hurleur, albatros royal, albatros à sourcils noirs, albatros à cape blanche et albatros à nez jaune de l'océan Atlantique), le nombre d'espèces dans cette seule famille varie de 13 à 21.
- L'intégration ou non de certains genres ou familles (phalaropes, canards marins, plongeons, etc.) dans la catégorie des oiseaux de mer.
La seule définition possible d'un oiseau de mer est la suivante : un oiseau qui tire tout ou partie de son alimentation de la mer. Une telle définition n'est toutefois pas universellement valide puisque certaines espèces classées dans le groupe ne s'alimentent en mer que de façon marginale ou pas du tout (certains Laridae notamment), alors que des oiseaux passant de longues périodes de leur cycle annuel en milieu marin n'y figurent pas (plongeons, canards marins).
Sur cette base, on constate que tous les oiseaux marins appartiennent aujourd'hui à l'ordre des ciconiiformes (Classification de Sibley-Ahlquist). Le degré de dépendance des différentes familles vis-à-vis des habitats océaniques est toutefois très variable.
- Les familles des Phaethontidae des Sulidae, des Fregatidae des Spheniscidae et des Procellariidae ne comportent que des espèces marines. Dans la famille des laridés, les labbes (Stercorariidae), les bec-en-ciseaux (Rynchopinae) et les alcidés sont eux aussi exclusivement marins.
- Trois familles comportent à la fois des espèces marines et continentales. Bien que fréquentant surtout les eaux douces (2 espèces seulement sont strictement marines), les pélicans sont intégrés aux oiseaux de mer. Les cormorans, eux, sont très majoritairement marins (28 espèces sur une quarantaine). Ce sont les laridés qui présentent la situation la plus complexe. Dans le groupe des goélands et des mouettes (Larinae), la plupart sont maritimes ou marins, au moins partiellement ou hors période de reproduction ; quelques espèces sont toutefois strictement continentales. Dans la sous-famille des Sterninae, les noddis sont strictement marins alors que les guifettes sont presque exclusivement continentales ; les sternes au sens strict comptent plus d'espèces marines que d'espèces cantonnées aux eaux douces.
| Famille | Subdivision | Représentants | Image | Espèces |
|---|---|---|---|---|
| Laridés | Stercorariidae | labbes ou skuas | 6/8 | |
| Rynchopinae | bec-en-ciseaux | 3 | ||
| Larinae | goélands, mouettes | recompter | ||
| Sterninae | sternes, guifettes, noddis | recompter | ||
| Alcidae | pingouins, guillemots/marmettes, macareux | 22/24 | ||
| Phaethontidés | phaethons/pailles-en-queue | 3 | ||
| Sulidés | fous | 7/9 | ||
| Phalacrocoracidés | cormorans | 27/38 | ||
| Pélécanidés | pélicans | 7/8 | ||
| Frégatidés | frégates | 5 | ||
| Sphéniscidés | manchots | 16/17 | ||
| Procellariidés | Procellariinae | pétrels, puffins, fulmars, | 59/79 | |
| Diomedeinae | albatros | 13/14 | ||
| Hydrobatinae | océanites | 20/21 |
Paradoxe océanique
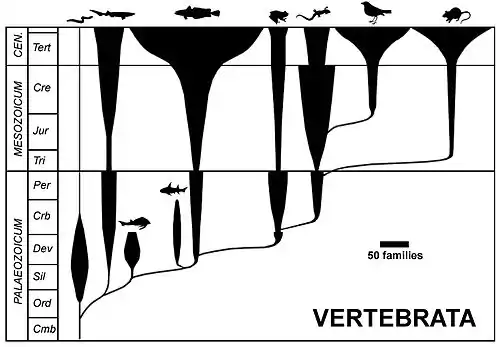
Sur les 10 000 espèces d'oiseaux recensées dans le monde, 305 sont des oiseaux marins. Alors que l'océan mondial abrite la majorité des espèces vivantes sur Terre (50 à 80 % selon les estimations)[4],[5], seulement 3 % des espèces d’oiseaux recensées sur la planète l'ont colonisé. Ce rapport paradoxal est imputable à l'action combinée de trois principaux facteurs limitants : uniformité du milieu marin qui offre une gamme limitée de niches écologiques (principe d'exclusion compétitive), manque de sites disponibles pour la nidification, grande mobilité de ces oiseaux, ce qui favorise leur dispersion à grande échelle et freine les processus de spéciation[6].
Distribution
La distribution des oiseaux marins est en grande partie conditionnée par la température de surface des océans : 191 espèces se répartissent dans les zones tempérées[7], 81 dans les zones tropicales et 29 dans les zones polaires[8]. Si l'écologie des oiseaux des zones arctiques et antarctiques explique leur faible biodiversité (éloignement des sources de nourriture dû à la banquise, climat rude imposant des adaptations spécifiques), les effectifs au sein de chaque espèce peuvent toutefois être importants : colonies de manchots qui peuvent atteindre le million de couples avec une population totale évaluée entre quarante et quatre-vingts millions d'individus, les Mergules nains sont les oiseaux marins les plus abondants de l'Arctique[9].
Histoire évolutive
Si les oiseaux fossiles sont relativement rares dans certaines formations géologiques, cela tient à leur mode de vie, à leur squelette doté d'os creux et délicats (« os pneumatisés »), à la tectonique ou l'érosion qui ont détruit ces fossiles au fil du temps. Par contre, les oiseaux aquatiques sont relativement bien représentés à l'état fossile, leurs ossements ayant pu se conserver assez facilement dans les sédiments marins[10].
Les fossiles d'oiseaux primitifs les plus anciens connus sont ceux d'oiseaux de mer inaptes au vol du Crétacé il y a 100 millions d'années. Faisant partie du clade des Hesperornithes, ils ont des mâchoires garnies de dents et sont sans doute la plupart des oiseaux plongeurs grâce à leurs ailes atrophiées comme les manchots actuels[11]
Une hypothèse spéculative propose que la technique du vol des oiseaux (en) aurait été inventée par un ancêtre marin, considérant ainsi que les oiseaux ont colonisé les océans avant même de maîtriser le vol aérien[12].
Au Miocène, à la suite de changements de facteurs environnementaux externes (température, oxygène), une radiation évolutive conduit à une explosion de biodiversité et à l'apparition de toutes les grandes familles d'oiseaux marins modernes il y a 20 millions d'années[13].
.jpg.webp) Dessin montrant Hesperornis regalis en plongée, par Nobu Tamura.
Dessin montrant Hesperornis regalis en plongée, par Nobu Tamura. Dessin de Pelagornis, par Diego Ortega.
Dessin de Pelagornis, par Diego Ortega.
Caractéristiques des oiseaux de mer
Quel que soit leur degré de dépendance vis-à-vis du milieu marin, les oiseaux de mer ne peuvent à proprement parler être considérés comme des organismes aquatiques. Ils font en effet partie des quelques groupes de vertébrés tétrapodes qui ont évolué pour prélever préférentiellement ou exclusivement leur alimentation en pleine eau. Aucun de ces animaux d'origine terrestre, tortues marines, serpents Hydrophiidae, oiseaux d'eau et mammifères marins, n'a en fait acquis la possibilité de respirer dans l'eau ; ils ont tous conservé leurs poumons, et dépendent donc de la surface pour leur respiration. Par ailleurs, parmi ces animaux, seuls les cétacés et les siréniens sont devenus totalement indépendants du milieu terrestre, ne sortant jamais de l'eau, même pour la parturition. Comme les phoques et comme les animaux ovipares (tortues, serpents), les oiseaux de mer doivent nécessairement regagner la terre ferme pour la ponte. Enfin, de tous ces animaux, ils sont ceux qui sont le plus dépendants du milieu terrestre puisque, contrairement aux serpents et aux tortues, ils doivent assurer eux-mêmes l'incubation des œufs et l'élevage des poussins jusqu'à leur indépendance. Pour cette raison, ils sont contraints de séjourner à terre pour des périodes souvent très longues.
Description
L'éventail des tailles des oiseaux marins est extrêmement étendu. Alors que le plus petit, l'océanite minute (Oceanodroma microsoma) mesure moins de 15 cm pour un poids légèrement inférieur à 20 g, l'albatros hurleur (Diomedea exulans) peut atteindre 1,30 m pour un poids dépassant 11 kg chez certains mâles ; cet oiseau détient également le record d'envergure pour les oiseaux actuels, avec plus de 3,50 m.
Coloration

.jpg.webp)
La caractéristique la plus évidente du plumage des oiseaux de mer est l'absence générale de couleurs vives et de dichromatisme sexuel[14]. Quelques espèces sont certes colorées, mais les couleurs vives sont des caractères sexuels secondaires (colorations céphaliques le plus souvent portées par le bec — macareux ou goélands —, des plumes ornementales ou une plaque orangée disposée de chaque côté de la mandibule inférieure chez le manchot royal et le manchot empereur ; les pattes chez les fous ou les mouettes)[15] ou des structures particulières comme la poche gulaire — dépourvue de plumes — des frégates. Le plumage proprement dit est presque systématiquement une combinaison de teintes blanches, noires, grises ou brunes (telles que l'on peut le voir sur les pingouins), présentant une dissymétrie (noir-gris sur le dos, blanc en dessous) qui résulte de convergences évolutives[16]. Les rares exceptions à cette règle concernent de petits toupets de plumes dorées sur la tête de certains manchots (gorfous) ou alcidés du Pacifique (macareux huppé).
On s'est longtemps interrogé sur la signification de ce contraste dorsi-ventral. L'interprétation la plus classique avance l'idée qu'il s'agirait là de colorations cryptiques permettant une sorte de camouflage par ombre inversée vis-à-vis à la fois de leurs prédateurs et de leurs proies. Dès 1936, l'ornithologue américain Robert Cushman Murphy fait remarquer, dans son livre Oceanic Birds of South America, que le prion de la Désolation se confondait parfaitement avec la mer, grâce à la teinte gris bleuté de son dos et du dessus de ses ailes. Il pensa que cette couleur « serait un parfait camouflage pour les navires militaires. Malheureusement, il ne fut pas pris au sérieux et ce n'est que plus tard que la peinture qui recouvre aujourd'hui les navires de l'US Navy fut spécialement élaborée en prenant pour modèle la teinte si particulière des prions[17] ». Cette teinte n'est d'ailleurs pas uniforme : une ligne plus noire (présente également chez des pétrels et des mouettes) a probablement pour fonction de renforcer le camouflage en « cassant » la silhouette de ces oiseaux[17]. La coloration noire est due à un pigment, la mélanine, utilisé de manière sélective chez les oiseaux pour créer des formes de coloration disruptives et cryptiques (taches grises ou noires permettant la formation de barres, rayures, tâches, intercalées avec des régions de plumes non colorées) leur permettant de se confondre avec les fonds marins. La présence de mélanines dans l'extrémité des rémiges primaires a quant à elle pour fonction de mieux protéger cette partie particulièrement exposée à l'abrasion mécanique[18]. Selon Simmons, la coloration uniforme noire des Phalacrocoracidae (cormorans) est un camouflage agressif, ces espèces chassant préférentiellement des poissons et invertébrés benthiques où la lumière est réduite par les macrophytes et les sédiments en suspension[19]. Par ailleurs, la coloration presque systématiquement blanche du ventre de ces oiseaux piscivores aurait une valeur adaptative, en les rendant moins visibles (confusion avec la lumière ambiante à travers la fenêtre de Snell) pour les poissons dont ils se nourrissent[20]. Ce scénario adaptatif doit être nuancé car s'il existe quelques cas de plumage blanc ayant un rôle dans le camouflage (Mouette ivoire, pétrel des neiges), la communication et la thermorégulation, les hypothèses relèvent parfois d'interprétations adaptationnistes du mimétisme. Enfin, le plumage blanc est le plumage par défaut chez les oiseaux qui minimisent ce coût de production de pigments qui ne sont pas essentiels pour le vol, la photoprotection ou l'étanchéité[21].
Étanchéité



Comme tous les oiseaux d'eau, mais plus que les espèces continentales en raison de leur présence sur toutes les mers du globe, y compris dans les régions polaires, les oiseaux marins, organismes homéothermes, sont soumis au fort pouvoir de refroidissement de l'eau. Ainsi, le plus petit oiseau de mer est l'Océanite tempête qui pèse 23 grammes, un poids inférieur étant incompatible avec la thermorégulation (règle de Bergmann)[22]. Leur capacité à coloniser les espaces océaniques, à y survivre et à s'alimenter sous l'eau dépend étroitement de leur aptitude à résister aux fortes contraintes thermiques que suppose la vie dans ces milieux. L'étanchéité du plumage leur est donc essentielle. Elle interdit à l'élément liquide d'entrer directement en contact avec la peau. Mieux, elle ménage entre la surface des plumes et le corps une couche d'air qui, avec le duvet, assure au mieux l'isolation thermique de l'animal en même temps qu'elle contribue de manière essentielle à sa flottabilité.
On s'est aperçu très tôt de l'exceptionnelle imperméabilité des plumes des oiseaux de mer. Dès le début du XXe siècle, elle a même servi de modèle pour la mise au point des premiers vêtements imperméables[23]. Le mécanisme de l'étanchéité fait toutefois débat. En dépit du constat que, conformément au modèle textile, le seul agencement des plumes (entrecroisement des barbes et barbules) pouvait suffire pour expliquer l'étanchéité[24], on a longtemps cru que celle-ci était due à la présence de la sécrétion uropygienne quotidiennement appliquée sur l'ensemble du plumage par les oiseaux au cours de leurs longues séances de toilettage. Cette idée, désormais largement abandonnée, perdure aujourd'hui dans nombre de publications à l'usage du public[25]. Lors des premières grandes marées noires, cette conception fut à l'origine d'erreurs radicales dans les techniques de nettoyage des oiseaux mazoutés ; cela a conduit à l'échec total de certaines tentatives de réhabilitation, notamment lors de l'incident du Torrey Canyon en 1967[26].
La question de l'imperméabilité du plumage des cormorans a longtemps été au cœur de ce débat. À l'issue de leurs séances de pêche, ces oiseaux aquatiques passent en effet de longs moments sur des reposoirs, les ailes étalées ; leur plumage est visiblement mouillé et ce comportement a par conséquent légitimement été interprété comme une phase de séchage. De nombreuses hypothèses ont été émises pour tenter d'expliquer cet apparent paradoxe que constitue un oiseau aquatique au plumage non étanche. Des erreurs aujourd'hui démenties[27] ont même été colportées à ce sujet — et restent répandues — comme la prétendue absence de glande uropygienne chez ces oiseaux ou son atrophie. Ce n'est qu'en 2005 que l'énigme a été résolue. Le plumage des cormorans est bien imperméable, ce qui est somme toute logique pour une espèce plongeuse. En revanche, les plumes sont constituées d'une couche externe mouillable, et d'une couche interne qui ne l'est pas. Le plumage n'est donc mouillé qu'en surface : pas plus que chez les autres oiseaux aquatiques, l'eau ne franchit la barrière du plumage ni n'envahit donc la couche d'air isolante[28].
Nage en surface
À un moment ou un autre de leur histoire évolutive, tous les oiseaux de mer ont développé des adaptations à la nage en surface. L'exceptionnelle étanchéité du plumage en est une, qui conditionne leur flottabilité. Mais en témoigne aussi l'existence universelle de palmures, y compris chez les plus marins des limicoles que sont les phalaropes.
Certains toutefois y ont peu recours, ou pas du tout, en raison d'un mode de vie essentiellement aérien, en particulier pour l'alimentation. C'est surtout le cas pour les frégates qui, en dépit d'habitudes très hauturières et de palmures spécialement développées, ne se posent jamais sur la mer. C'est également vrai, quoiqu'à un moindre degré, pour les labbes qui ne chassent guère qu'au vol, ou au sol en période de reproduction. Tous les autres groupes se posent volontiers sur l'eau et s'y déplacent aisément.
En fait, la plupart des espèces ne fréquentent que la surface ou une tranche d'eau ne dépassant que de peu la longueur de leur corps. Il s'agit d'oiseaux très légers, dont la flottabilité est très élevée : goélands, sternes, becs en ciseaux, océanites, fulmars, etc. La pénétration dans la masse d'eau pose en effet aux oiseaux des problèmes très particuliers en raison de leur légèreté intrinsèque. Celle-ci est liée à la fois à leur adaptation au vol et au matelas d'air situé sous les plumes qui assure leur isolation thermique et leur flottabilité. Plonger un tant soit peu profondément représente donc pour eux une véritable difficulté et une importante dépense énergétique pour vaincre les forces tendant à les ramener en surface.
Plongeon
Quelques espèces atteignent des profondeurs modérées (moins de 10 m) en plongeant en vol d'une certaine altitude. La vitesse acquise au cours du piqué suffit généralement, mais un complément de propulsion peut parfois être obtenu au moyen des pattes et des ailes. L'exemple le plus remarquable de cette technique est celui des fous. Le fou de Bassan plonge le plus souvent d'une hauteur d'une dizaine de mètres, percutant la surface de la mer à près de 100 km/h ; il atteint régulièrement des profondeurs inférieures à 5 m, mais pourrait occasionnellement descendre jusqu'à une quinzaine de mètres en nageant[29]. Les sternes, les pélicans et les phaethons utilisent aussi cette technique, mais atteignent des profondeurs moindres. Dans tous les cas, il s'agit plus de plongeons que de véritables plongées.
Plongée
La véritable plongée, celle qui permet l'exploitation régulière de zones situées au-delà de 20 m de profondeur, ne concerne en réalité qu'un petit nombre d'espèces appartenant pour l'essentiel à trois groupes : les manchots, les alcidés et les cormorans. On peut y adjoindre quelques procellariiformes : les puffins et les pétrels-plongeurs ou puffinures.
Soumis aux lois de l'hydrodynamique, leur évolution morphologique rejoint celle des mammifères marins : le corps profilé est devenu fusiforme et massif pour favoriser l'immersion, les ailes réduites et les pattes palmées sont projetées loin en arrière du corps, jouant avec la queue le rôle de gouvernail. Il semblerait que chez les manchots, « les plumes, en liaison avec plusieurs muscles antagonistes, soient animées d'oscillations sous l'eau, ce qui atténuerait les turbulences, permettant un écoulement optimal de l'eau le long du corps[30] ».
Performances
La connaissance des profondeurs de plongée est longtemps restée tributaire de techniques anecdotiques et peu précises :
- l'observation directe, occasionnelle, par des plongeurs ou à partir de submersibles ;
- les captures accidentelles dans des engins de pêche dont on connaissait les profondeurs d'immersion.
La deuxième méthode est celle qui a été la plus souvent employée, mais il était difficile de s'assurer que les oiseaux n'avaient pas été pris lors de la descente ou de la remontée des engins, plus près de la surface que la profondeur d'immersion.
Les perspectives ont changé de manière radicale dans les années 1980 du fait de l'utilisation d'enregistreurs fixés aux oiseaux eux-mêmes[31]. Le perfectionnement et la miniaturisation des appareils ont depuis lors provoqué une multiplication des études dédiées à ce sujet. En dépit des progrès réalisés, il subsiste toutefois un certain nombre de problèmes de précision des mesures, et certains auteurs ont souligné la nécessité éthique de prendre en compte la capacité des oiseaux manipulés à supporter sans dommage les appareillages dont on les équipe[32].
Le vol
_-swimming.jpg.webp)
« L’utilisation des ailes à la fois pour le vol et pour la nage soulève un conflit biomécanique du fait des pressions propres à chaque milieu s’exerçant sur une morphologie d’aile unique. En effet, un vol efficace en milieu marin semble s’accorder plutôt avec une aile relativement longue et pointue, de faible charge alaire et d’allongement élevé. La densité de l’eau est, elle, égale à 850 fois celle de l’air ; la production de force en est modifiée, la portance et la traînée atteignent des valeurs 4 fois plus élevées que dans les airs. Les contraintes biomécaniques s’exerçant sur l’ossature et les plumes sont augmentées, tout comme le coût énergétique de la contraction musculaire. Il est alors plus intéressant dans ce milieu de disposer d’une aile courte d’allongement élevé, alors plus favorable pour atteindre des vitesses de plongée élevée à moindre coût[33] ».
La forme générale des ailes des oiseaux de mer résulte ainsi d'un compromis biomécanique et se décline en quatre grands modèles avec des propriétés aérodynamiques spécifiques : des ailes longues et effilées adaptées au vol plané (albatros, pétrels, frégates, fous, phaethons, goélands, sternes et labbes) ; des ailes longues et larges adaptées au vol à voile par ascendance thermique (pélicans) ; des ailes courtes et larges adaptées à un vol battu bas sur l'eau mais puissant (cormorans) ; des ailes courtes et étroites adaptées au plongeon (Alcidés tels que les pingouins, macareux, et Procellariiformes tels que les puffinures)[34].
 Pétrel géant en vol plané.
Pétrel géant en vol plané. L'envergure du Pélican brun lui permet de planer en profitant d'une ascendance thermique.
L'envergure du Pélican brun lui permet de planer en profitant d'une ascendance thermique._(3).jpg.webp) Vol du Cormoran huppé au ras de l'eau.
Vol du Cormoran huppé au ras de l'eau. L'aile du Macareux moine lui permet de se déplacer dans les airs et de se propulser sous l’eau.
L'aile du Macareux moine lui permet de se déplacer dans les airs et de se propulser sous l’eau.
Régimes & modes d'alimentation


Les oiseaux marins sont tous zoophages mais montrent une diversité de régimes alimentaires (disparité géographique selon les zones polaires, tempérées et tropicales, disparité saisonnière…)[36]. « À eux seuls, ils consomment annuellement 70 millions de tonnes de poissons, céphalopodes et crustacés dans les océans du globe, chiffre comparable aux prises annuelles de l'ensemble des pêcheries mondiales ». En raison de leurs effectifs, les manchots et les Procellariiformes (pétrels et albatros) prélèvent près des deux tiers de ces 70 tonnes[37].
La distance de prospection variable permet de distinguer les espèces côtières (cormorans, pélicans, sternes, mouettes et goélands) qui s'approvisionnent à moins de 20 km du littoral ; les espèces néritiques (nombreux manchots, sternes, pingouins, stariques, fous) qui pêchent au-dessus du plateau continental (de largeur moyenne de 74 km) très riche en proies, pendant deux ou trois jours maximum avant de revenir dans leurs colonies à terre ; les espèces océaniques ou pélagiques (albatros, puffins et pétrels, manchot royal, phaéthons, frégates) qui prospectent en haute mer (au-delà du plateau continental) pendant plusieurs semaines[38].
La compétition intra et interspécifique peut induire des comportements de cleptoparasitisme. Véritables « pirates des mers », les frégates et les labbes harcèlent d'autres oiseaux de mer pour les faire régurgiter. Les goélands et sternes tente aussi de dérober les proies d'autres oiseaux. Cet opportunisme alimentaire joue un rôle de complément aux régimes alimentaires classiques[39]. Le Pétrel géant, le pétrel de Hall, les labbes et les goélands se font charognard à l'occasion[40]
Dépendance du milieu marin

Les oiseaux marins ingèrent de l'eau de mer[41] avec leurs proies mais leurs petits reins[42] ont une capacité insuffisante d'excrétion de cette eau salée. Ils disposent d'un deuxième système d'organes osmorégulateurs, les glandes à sel occipitales comme on en rencontre chez certains reptiles, iguanes ou tortues marines. Le sang passant au contact des cellules de ces glandes réniformes se trouve dessalé par un processus d'osmose inverse tout à fait comparable à celui qui préside au dessalage de la sueur, ce qui permet d'expulser les surplus de sel par les narines[43],[44].
Le degré de dépendance du milieu marin permet de distinguer les espèces côtières des espèces hauturières.
Reproduction


La reproduction sexuée chez les oiseaux marins est caractérisée notamment par :
- la monogamie liée à la nécessité du soin parental, la fidélité corrélée à la longévité en raison de grandes distances à parcourir[45]. Si la monogamie est la règle, les copulations extra-conjugales (en) sont fréquentes : chez l'Albatros des Galapagos, jusqu'à 25 % des familles ont des poussins illégitimes[46].
- la nécessité du retour à terre (oviparité)
- l'incubation effectuée par la femelle comme le mâle (l'exception notable étant le manchot empereur dont le mâle prend seul en charge l'incubation de l'œuf pendant plus de deux mois sur la banquise), généralement grâce à une plaque incubatrice, a des durées variables : un mois pour les petites espèces (goélands), 2 mois pour les moyennes (fous, frégates), jusqu'à 80 jours pour les espèces imposantes (albatros)[47]. L'élevage pour ces espèces varie de 2 mois à un an pour le manchot royal et la frégate du Pacifique[48]
- la reproduction coloniale (plus de 95 % des espèces des oiseaux marins se reproduisent au sein de colonies contre 13 % chez les oiseaux terrestres)[49]. Rolland et al ont montré que la colonialité[50] des oiseaux précède leur passage en milieu marin dont l'exploitation semble particulièrement difficile pour des individus solitaires[51]. Cette colonialité permet de diminuer la pression de prédation (dilution de la prédation sur un grand nombre d’individus, plus grande efficacité de la protection parentale par une défense collective)[52], bénéfice supérieur aux coûts liés à la compétition pour les ressources[53], au parasitisme de couvée[54], à une plus forte exposition aux épidémies et aux parasites[55] ainsi qu’au cannibalisme[56]. D'autres hypothèses suggèrent que les colonies sont un centre d'information (en) (échange d'informations pour la recherche de nourriture) et que l'évolution de la colonialité serait liée non pas directement aux bénéfices de la vie en colonie mais aux stratégies convergentes de sélection d'un habitat de qualité commun à tous les individus[51].
Profil démographique
Les principaux paramètres du profil démographique des oiseaux de mer découlent d'une stratégie de reproduction K et sont, comme les vautours, une maturité sexuelle différée (4 ans chez les strens, 9 ans chez les albatros)[57], une fécondité limitée (beaucoup d'espèces ne pondent qu'un seul œuf[58], parfois deux ou trois, la ponte pouvant exceptionnellement comporter quatre ou cinq œufs chez les cormorans)[59] associée à une faible fréquence de reproduction (reproduction généralement une seule fois par an, reproduction biennale chez certains albatros, chez le pétrel de Lesson et des frégates). Cette très faible fécondité et la maturité sexuelle tardive sont compensées par une longévité élevée, variant en moyenne entre 7 et 34 ans selon les espèces[60]. L'espérance de vie moyenne des sternes atteint 10 ans, celle des pétrels 26 ans et des albatros 34 ans)[61]. L'albatros hurleur a ainsi une longévité moyenne de 32 ans, mais il peut atteindre une espérance de vie théorique[62] de 80 ans[63]. Le record de longévité est détenu par une femelle albatros de Laysan, Wisdom, âgée de 70 ans en 2021 (record pour un oiseau dans la nature, certains perroquets en captivité dépassant 80 ans)[60].
Menaces et conservation
Les populations d'oiseaux marins ont diminué de 69,7% entre 1950 et 2010, en raison principalement de la dégradation des écosystèmes marins imputable à l'espèce humaine[64]. 46 % des espèces d'oiseaux marins sont en déclin (chasse[65], victimes de la pêche industrielle[66], de la pollution[67], des espèces introduites[68] et du changement climatique[69]), 28 % sont en danger (inscrites sur la liste rouge de l'UICN)[48].
Fluctuations naturelles
Les populations d’oiseaux d’eau (hivernants ou non) sont soumises à des fluctuations naturelles. Ces dernières sont difficiles à rapidement évaluer et parfois à expliquer, en raison des difficultés de comptage (brouillard, pluie, évaluation complexes des populations parfois très denses de limicoles ou des oiseaux de mer…), et de multiples facteurs qui les influencent ; mobilité des oiseaux qui peuvent déplacer certaines colonies, impact des aléas climatiques(vagues de froid, gel des étangs et plans d’eau, phénomènes El Nino), épidémies, pollutions (dont pollution lumineuse auquel plusieurs espèces sont particulièrement sensibles), et autres interactions avec l'Homme.
Les oiseaux de mer et l'homme
Les hommes utilisent depuis longtemps les oiseaux de mer pour connaitre la météo, et pour retrouver l'emplacement des terres. On pense que les Polynésiens ont ainsi pu trouver les îles du Pacifique qu'ils habitent actuellement. Les oiseaux de mer ont, comme leurs œufs, également servi de repas. À l'occasion ils ont pu servir d'appât pour la pêche au gros. Ils ont aussi été une source de nourriture pour l'homme (oiseaux ou leurs œufs). Au début du XXe siècle, le guano, riche engrais issu des fientes d'oiseaux marins, est devenue une ressource convoitée et importante pour certains pays, comme l'Argentine.
Vers la fin du XIXe siècle, la mode des plumes était telle que l'activité, connue sous le nom de « plumasserie », avait acquis un statut industriel. En Amérique cinq millions d'oiseaux étaient tués annuellement pour cet usage. Les plumes des oiseaux de mer étaient particulièrement prisées en raison de leur résistance ; de ce fait, l'industrie de la plume a été considérée comme l'un des facteurs responsables du déclin des populations d'oiseaux marins dans bon nombre de régions de l'Atlantique Nord à cette époque[70]. De tels chiffres mobilisèrent l'opinion publique et des mouvements anti-plume furent créés afin que seules les plumes d'oiseaux domestiques soient utilisées.
La relation avec les pêcheurs
Les pêcheurs utilisent depuis des siècles les espèces marines dont les oiseaux pour localiser les bancs de poissons et le potentiel d'une côte[71]. Les pratiques de pêche traditionnelle aux cormorans dans le sud-ouest de la Chine, où les hommes élèvent ces oiseaux pour qu'ils pêchent pour eux, est menacée de disparaitre et risque à l'avenir de n'être réduite, comme au Japon, qu'à une attraction touristique.
Les entreprises pratiquants l'aquaculture considèrent les oiseaux marins comme une nuisance, les oiseaux pouvant prélever une partie de leur stock[72]. C'est également le cas des pêcheurs à la palangre. Cependant ils sont des bien moindre prédateurs que les autres espèces de poissons ou de mammifères marins.
La relation des côtiers-pêcheurs avec les oiseaux de mer est complexe, en effet ils profitent de la présence des oiseaux, mais certaines espèces ont également su tirer parti de la présence humaine. En effet, par exemple, elles consomment les poissons et les abats rejetés par les pêcheurs. On estime que 30 % de la nourriture des oiseaux de mer vivant en mer du Nord est issue des rejets de pêche, ce qui peut représenter jusqu'à 70 % du total des produits alimentaires de certains populations d'oiseaux[73]. L'impact est positif sur certaines espèces d'oiseaux comme le Fulmar boréal qui vit plus au sud depuis quelques années[74], les fous de Bassan, les pétrels, mais se fait au détriment des espèces plongeuses comme les petits pingouins. Sur un long terme, on estime que la pêche est nuisible sur les espèces vivant particulièrement longtemps et à faible taux de reproduction, comme les Albatros.
Les prises accidentelles d'oiseaux marins par des lignes ou filets ont un impact important sur le nombre d'oiseaux de mer, par exemple, on estime que 100 000 albatros sont pris et noyés chaque année sur lignes de palangre aux thons[75],[76]. Plusieurs centaines de milliers d'oiseaux sont tués chaque année de cette manière, c'est problématique pour certaines espèces rares comme pour l'Albatros à queue courte dont il ne reste plus qu'environ 1000 spécimens connus.
Une influence humaine forte sur les populations
La plupart des oiseaux de mer sont aujourd'hui protégés, cependant de nombreuses espèces sont fortement menacées, à la fois par la destruction de leur habitat sur les côtes, par la pêche ainsi environ 300 000 oiseaux seraient accidentellement pêchés à la palangre, mais aussi par la famine, les parents ne parvenant plus à nourrir correctement leurs petits vraisemblablement à cause de la surpêche.
Les espèces de mouettes et les goélands comme le goéland argenté, menacés en Europe dans les années 1970, ont été protégées sur le territoire[77]. Aujourd'hui avec la multiplication des décharges à ciels ouvert plusieurs espèces opportunistes ne sont plus menacées et ont même étendu leur territoire à l'intérieur des terres en hiver, en suivant les cours d'eau[78]. À tel point que la population de certaines espèces comme le Goéland leucophée doit être limitée, notamment sur les côtes méditerranéennes pour diminuer l’impact de celle-ci sur l'environnement[79].
Le mode de nidification des oiseaux de mer (nids souvent posés à même le sol au sein de vastes colonies, sur des îles isolées) les rend très vulnérables aux intrusions humaines et à la prédation de leurs œufs par des espèces introduites par l'homme comme les rats, les chats harets ou les chiens marron. En effet, ces oiseaux ont perdu tout comportement instinctif de défense contre ce genre de prédation[80]. En sus, des herbivores comme les chèvres, les lapins, bovidés peuvent détruire également la végétation essentielle aux oiseaux ou au maintien des sols[81]. Les humains qui visitent les sites, perturbent également leur nidification, pouvant faire fuir les oiseaux qui laissent alors leurs nids sans protection.

L'influence exacte de la pollution de l'eau, contaminant le plancton puis les poissons est mal connue, mais les taux de produits chimiques dangereux accumulés dans leurs graisses, laissent penser que la santé des populations d'oiseaux marins en est fragilisée. Par exemple, le DDT crée des troubles du développement embryonnaire[82]. Les pollutions exceptionnelles telles que les marées noires et dégazages peuvent engluer les oiseaux, réduisant la capacité de leurs plumes à les protéger du froid, leur capacité de mouvement[83] et les empoisonnant par ingestion dès lors qu'ils tentent par réflexe de nettoyer leurs plumes. Ces oiseaux meurent alors entre autres de froid, d'insuffisance rénale, de déshydratation, d'hémolyse et d'hépatite[83].
Protection
La prise de conscience qu’il faut protéger les oiseaux est ancienne, puisqu'en 676 Cuthbert de Lindisfarne édicte ce qui pourrait bien être la première loi de protection des oiseaux sur les îles Farne. Alors que de nombreuses espèces sont disparues au XIXe siècle comme le Grand pingouin ou le Cormoran à lunette, le Canard du Labrador disparus dès 1875, c’est à la fin du siècle que sont apparues les premières lois sur la protection des oiseaux et la réglementation de la chasse ou du plomb de chasse (cause de saturnisme aviaire ayant tué de très nombreux oiseaux).
Ce n'est qu'à la fin du XXe siècle que la protection des oiseaux s'est accompagnée de celle d'une partie de leurs habitats (gestion conservatoire ou restauratoire des lagunes, estuaires, grandes vasières, sites d’hivernage, zones de reposoir[84]) et de leurs ressources alimentaires, avec une régulation du statut d'espèces chassables ou non sur des bases scientifiques ; avec différents accords ou conventions internationales
S'ajoute aussi à cela les zones Natura 2000 : Directives Habitat et directives Oiseaux visant à proteger les animaux et leurs habitats.
Notes et références
- « Fiche Indicateur Oiseau / Littoral »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), pages "indicateurs" (voir rubrique "nature et biodiversité" de l'observatoire du littoral
- Avec plusieurs clades : Agnathes (lamproies), Chondrichthyens (requins, raies), Placodermes (fossiles), Acanthodiens (fossiles), Osteichthyens (poissons osseux).
- « Systématique : ordonner la diversité du vivant », Rapport sur la Science et la technologie N°11, Académie des sciences, Lavoisier, 2010, p. 65
- (en) Camilo Mora, Derek P. Tittensor, Sina Adl, Alastair G. B. Simpson, Boris Worm, « How Many Species Are There on Earth and in the Ocean? », Plos Biology, vol. 9, no 8, (DOI 10.1371/journal.pbio.1001127).
- (en) Mark J. Costello , Philippe Bouchet, Geoff Boxshall, Kristian Fauchald, Dennis Gordon, Bert W. Hoeksema, Gary C. B. Poore, Rob W. M. van Soest, Sabine Stöhr, T. Chad Walter, Bart Vanhoorne, Wim Decock, Ward Appeltans, « Global Coordination and Standardisation in Marine Biodiversity through the World Register of Marine Species (WoRMS) and Related Databases », Plos One, vol. 8, no 1, (DOI 10.1371/journal.pone.0051629).
- Christophe Barbraud et Fabrice Genevois, Oiseaux marins. Entre ciel et mers, éditions Quæ, , p. 19-20.
- Les eaux tropicales sont les plus abondantes en nutriments en raison d'une teneur moins forte dioxyde de carbone dissous (base de la photosynthèse phytoplanctonique), et d'eaux fortement stratifiées.
- Christophe Barbraud, op. cit., p. 27-28
- Jacques Blondel, Oiseaux et changement global, Quae, (lire en ligne), p. 107.
- Delphine Angst & Eric Buffetau, « Les oiseaux fossiles », Géochronique, no 146, , p. 15-16 (lire en ligne).
- (en) Irby J. Lovette et John W. Fitzpatrick, Handbook of Bird Biology, John Wiley & Sons, (lire en ligne), p. 38-39.
- Christophe Barbraud, op. cit., p. 17
- Christophe Barbraud, op. cit., p. 19
- (en) Donald L. J. Quicke, Mimicry, Crypsis, Masquerade and other Adaptive Resemblances, John Wiley & Sons, (lire en ligne), p. 309.
- Christophe Barbraud, op. cit., p.76
- (en) R.W. Storer, Evolution in the diving birds. Proceedings of the XII International Ornithological Congress, (eds. G. Bergman, K.O. Donner and L.V. Haartman), 1958, p. 694-707
- Fabrice Genevois et Christophe Barbraud, Oiseaux marins. Entre ciel et mers, Editions Quae (lire en ligne), p. 74.
- (en) Edward H. Burtt, « Tips on wings and other things », dans E. H. Burtt, The Behavioral Significance of Colour, STPM Press, , p. 75-125
- (en) K. E. L. Simmon, « Some adaptive features of seabird plumage types », British Birds, vol. 65, , p. 465– 479.
- Tests expérimentaux par le photographe G. Phillips dès 1964. Cf (en) G. Phillips, « The coloration of sea birds », Triton Magazine, 1964.
- (en) W. L N. Tickell, « White Plumage », Waterbirdss: The International Journal of Waterbird Biology, vol. 26, no 1, , p. 1-12 (lire en ligne).
- Bernard Cadiou (2004).- Oiseaux marins nicheurs de Bretagne, 2001-2003. Rapport de Contrat Nature, Bretagne Vivante - SEPNB / Conseil Régional de Bretagne. 17 p
- Schwartz, F.F. (1939). Process for the production of waterproof fabrics permeable to air. United States Patent and Trademark Office, Patent number : 2149750.
- Rijke, A.M. (1967). The water repellency and feather structure of cormorants, Phalacrocoracidae. Ostrich 38: 163-165.
- Certains sites résument toutefois très correctement la question.
- Newman, S. H., Ziccardi, M.H., Berkner, A.B., Holcomb, J., Clumpner, C. & Mazet, J.A.K. (2003). A historical account of oiled wildlife care in California. Marine Ornithology 31: 59-64.
- (en) Montalti, D. & Salibián, A., « Uropygial gland size and avian habitat », Ornitología Neotropical, vol. 11, , p. 297–306 (lire en ligne)
- (en) Grémillet, D., Chauvin, C., Wilson, R.P., Le Maho, Y. & Wanless, S., « Unusual feather structure allows partial plumage wettability in diving great cormorants. », Journal of Avian Biology, vol. 36, , p. 57-63 (résumé).
- Nelson, J.B. (1978). The gannet. Poyser, Berkhamsted : p. 222.
- Charles-André Bost, Christophe Guinet, Dominique Guinet, Benoît Lequette, Henri Weimerskirch, Sous les quarantièmes rugissants. Un sanctuaire sauvage, éditions du Gerfaut, , p. 121.
- Burger A.E. & Simpson M. (1986). Diving depths of Atlantic puffins and common murres. Auk 103:828–830.
- Wilson, R.P., Grémillet, D., Syder, J., Kierspel, M.A.M., Garthe, S., Weimerskirch, H., Schäfer-Neth, C., Scolaro, J.A., Bost, C.-A., Plötz, J. & Nel, D. (2002). Remote-sensing systems and seabirds: their use, abuse and potential for measuring marine environmental variables. Marine Ecology Progress Series, 228 : 241–261.
- Vincent Roinac, Adaptation du vol à la prédation chez certains oiseaux chasseurs et pêcheurs, Thèse d'exercice, Ecole Nationale Vétérinaire de Toulouse - ENVT, 2004, p. 109.
- Christophe Barbraud, op. cit., p.63-64
- Ces fientes résultant d'un mélange d'urine et de fèces au niveau du cloaque, sont liées à l'absence de vessie urinaire chez les oiseaux, laquelle peut être interprétée comme une adaptation au vol (en) (les organes les plus lourds étant rassemblés au centre du corps). Elles sont composées d'urine liquide très concentrée (économie d'eau, adaptation à la conquête des airs), d'acides uriques (précipitant sous forme d'urates, sels d'acide urique qui protègent les tubules rénaux de la cristallisation de ces acides) et de fèces. Les urates forment cet enduit blanchâtre qui recouvre les excréments aviaires et correspondent aux déchets azotés chez ces animaux (ces déchets formant une substance pâteuse blanchâtre plus importante chez les oiseaux de mer dont le régime alimentaire est plus riche en protéines). Cf Paul Géroudet, Les passereaux et ordres apparentés, Delachaux & Niestlé, , p. 113, et (en) E. A. Schreiber, Joanna Burger, Biology of Marine Birds, CRC Press, (lire en ligne), p. 475
- Christophe Barbraud, op. cit., p.139
- Christophe Barbraud, op. cit., p.137
- La technologie utilisée pour étudier la migration des oiseaux (balise Argos, GPS, géolocateur) sert désormais à analyser le comportement en mer des oiseaux marins et permet d'obtenir des données impressionnantes. « Entre le début et la fin d'un cycle reproducteur qui s'étale sur près d'un an, un albatros hurleur passe 80 % de son temps en mer et effectue 70 voyages alimentaires à partir de la colonie, parcourant une distance cumulée de 155 000 km… à la fin de ses 50 années d'existence en moyenne, un albatros hurleur aura parcouru environ 8,5 millions de kilomètres, soit 22 fois la distance entre la Terre et la Lune ». Cf. Christophe Barbraud, op. cit., p.146
- (en) E. A. Schreiber, Joanna Burger, Biology of Marine Birds, CRC Press, , p. 160-161.
- Christophe Barbraud, op. cit., p.69 et 140
- « Longtemps les ornithologues se sont demandé si les oiseaux marins buvaient de l'eau de mer, et la réponse n'est pas certaine aujourd'hui ». Cf Luc Chazel, Muriel Chazel, Les oiseaux ont-ils du flair ?, Quæ, , p. 95.
- La taille réduite et la légèreté des organes internes est une adaptation qui accroît les capacités de vol des oiseaux.
- Antoine Morin, « Les Oiseaux », Université d'Ottawa
- (en) M. Peaker, J. L. Linzell, Salt glands in birds and reptiles, Cambridge University Press, , p. 1-4
- (en) DW. Mock, M. Fujioka, « Monogamy and long-term pair bonding in vertebrates », Trends in Ecology & Evolution, vol. 5, no 2, , p. 39-43 (DOI 10.1016/0169-5347(90)90045-F)
- (en) Kathryn P. Huyvaert & Patricia G. Parker, « Extra-pair paternity in waved albatrosses: genetic relationships among females, social mates and genetic sires », Behaviour, vol. 147, no 12, , p. 1591-1613.
- Christophe Barbraud, op. cit., p.115-116
- Christophe Barbraud, op. cit., p.95
- (en) David Lack, Ecological Adaptations for Breeding in Birds, Methuen, , p. 138.
- Trait de vie à travers lequel les individus forment des groupes larges et denses durant la période de reproduction et où le site de nidification est disjoint de la zone d’alimentation.
- (en) Cecile Rolland, Etienne Danchin and Michelle de Fraipont, « The evolution of coloniality in birds in relation to food, habitat, predation, and life-history traits: A comparative analysis », The American Naturalist, vol. 151, no 6, , p. 514-529 (DOI 10.1086/286137).
- (en) E. A. Schreiber, Joanna Burger, Biology of Marine Birds, CRC Press, , p. 93
- (en) Nicholas E. Collias et Elsie C. Collias, Nest Building and Bird Behavior, Princeton University Press, , p. 122-126.
- (en) Collias, p. 131-141
- (en) Charles R. Brown et Mary Bomberger Brown, « Empirical Measurement of Parasite Transmission Between Groups in a Colonial Bird », Ecology, vol. 85, no 6, , p. 1619-1926 (DOI 10.1890/03-0206).
- Etienne Danchin et Richard H. Wagner, « The Evolution of Coloniality: The Emergence of New Perspectives », Trends in Ecology & Evolution, vol. 12, no 9, , p. 342-347 (DOI 10.1016/S0169-5347(97)01124-5).
- Christophe Barbraud, op. cit., p.109
- Albatros et pétrels, frégates, phaethons, majorité des pingouins, deux manchots (manchot empereur et manchot royal, quelques sternes, certains goélands
- Christophe Barbraud, op. cit., p.46
- Fabrice Genevois, Oiseaux marins: Entre ciel et mers, Quæ, , p. 49
- Christophe Barbraud, op. cit., p.48-50
- Valeur théorique basée sur le calcul des taux de survie (en), c'est-à-dire la fraction d'une population adulte non affectée par la mortalité l'année suivante.
- (en) H. Resit Akcakaya, Mark A. Burgman, Oskar Kindvall, Chris C. Wood, Per Sjogren-Gulve, Jeff S. Hatfield, Michael A. McCarthy, Species Conservation and Management, Oxford University Press, , p. 421.
- http://www.seaaroundus.org/doc/publications/chapters/2014/Booth-et-al-Greenland.pdf
- Le Cormoran de Pallas et le Grand Pingouin sont ainsi deux espèces exterminées par l'homme.
- Captures lors de certaines pêches à la palangre.
- Marée noire, contamination du milieu marin par les plastiques responsable de la mortalité de poussins par occlusion intestinale, pollution chimique par les métaux lourds, les polluants organiques persistants.
- Introduction de chats et de souris qui déciment les nids de poussins.
- L'augmentation de la température des eaux de surface influe sur la disponibilité des proies, ce qui entraîne des déclins et parfois une expansion. Par exemple le réchauffement graduel de l'océan Atlantique Nord depuis les années 1930 perturbe la chaîne alimentaire, favorisant l'expansion du maquereau commun au détriment des lançons, ce qui favorise le fou de Bassan au détriment du macareux moine.
- Ratcliffe, N.. Causes of seabird population change. In Mitchell, P. et al. 2004. Seabird populations of Britain and Ireland. Poyser, London, p. 407-441
- (en) Au, D.W.K. & Pitman, R.L., « Seabird interactions with Dolphins and Tuna in the Eastern Tropical Pacific. », Condor, vol. 88, , p. 304–317 (lire en ligne)
- (en) Collis, K., Adamany, S. - Columbia River Inter-Tribal Fish Commission, Roby, D.D., Craig, D.P., Lyons, D.E., Avian Predation on Juvenile Salmonids in the Lower Columbia River, 1998 Annual Report to Bonneville Power Administration, Portland, Oregon, Oregon Cooperative Fish and Wildlife Research Unit, (lire en ligne)
- (en) Oro, D., Ruiz, X., Pedrocchi, V. & Gonzalez-Solis, J., « Diet and adult time budgets of Audouin's Gull Larus audouinii in response to changes in commercial fisheries », Ibis, vol. 139, , p. 631–637 (résumé)
- (en) Thompson, P.M., Identifying drivers of change; did fisheries play a role in the spread of North Atlantic fulmars?, Management of marine ecosystems: monitoring change in upper trophic levels, Cambridge, Cambridge University Press, (lire en ligne)
- (en) « the_problem.asp Save the Albatross: The Problem », (consulté le )
- (en) Brothers NP., « Albatross mortality and associated bait loss in the Japanese longline fishery in the southern ocean. », Biological Conservation, vol. 55, , p. 255–268
- (fr) « Au sujet des mouettes », sur meeuwenindestad.be
- Gilles Mourgaud, « Hivernage du Goéland brun Larus fuscus en Maine-et-Loire au cours des années quatre-vingt-dix. », LPO
- « La protection des espèces et des milieux », sur ilesdemarseille.fr (consulté le )
- (en) Moors, P.J.; Atkinson, I.A.E., Predation on seabirds by introduced animals, and factors affecting its severity., Status and Conservation of the World's Seabirds, Cambridge, ICBP, (ISBN 0-946888-03-5)
- (en) Carlile, N., Proiddel, D., Zino, F., Natividad, C. & Wingate, D.B., « A review of four successful recovery programmes for threatened sub-tropical petrels », Marine Ornithology, vol. 31, , p. 185–192
- (en) Fry, D. & Toone, C., « DDT-induced feminization of gull embryos », Science, vol. 213, no 4510, , p. 922–924
- (fr) Littoral 85, « Les Oiseaux de Vendée "Beauté et horreur" », sur futura-sciences.com,
- Site insulaire, haute mer.
Voir aussi
Bibliographie
- Christophe Barbraud et Fabrice Genevois, Oiseaux marins. Entre ciel et mers, éditions Quæ, , 200 p. (lire en ligne)
- Cadiou, B., Pons, J.M., Yésou, P., Oiseaux marins nicheurs de France métropolitaine (1960-2000), Éditions Biotope, 2004, 218 p.
- (en) E. A. Schreiber, Joanna Burger, Biology of Marine Birds, CRC Press, , 740 p. (lire en ligne)
- Pierre Darmangeat, Oiseaux de mer et de rivage, éditions Artemis, , 127 p. (lire en ligne)
Liens externes
- « Oiseaux marins : l'appel du large », La Méthode scientifique, France Culture, 16 novembre 2020.
- « Observer les mammifères et les oiseaux marins », sur ornithomedia.com
- « Observer et identifier les oiseaux dans le Golfe de Gascogne et dans la Manche », sur ornithomedia.com
Articles connexes
- Portail du monde maritime
- Portail de l'ornithologie
- Portail de la biologie marine