Prymnesium parvum
Prymnesium parvum est une espèce de microalgues (10µm de long environ pour 3 à 4 µm de large) unicellulaires, de l'embranchement des Haptophytes.
Cette algue est bi-flagellée, ce qui lui permet de se déplacer.
Elle est donc généralement trouvée en suspension dans la colonne d'eau.

| Empire | Eukaryota |
|---|---|
| Règne | Chromalveolata |
| Sous-règne | Haptophyta |
| Embranchement | Haptophyta |
| Classe | Coccolithophyceae |
| Sous-classe | Prymnesiophycidae |
| Ordre | Prymnesiales |
| Famille | Prymnesiaceae |
| Genre | Prymnesium |
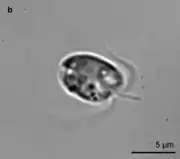
En raison de pigments qui lui donnent un éclat jaune-doré, elle est parfois nommée « algue dorée », ce qui peut être source de confusion avec d'autres espèces ou groupes (Chrysophyceae, Heterokontophyta). Cette dénomination est donc à éviter dans les textes juridiques et scientifiques.
Classification
Elle appartient au sous-règne des Haptophyta (=Prymnesiophyta) dont la plupart des espèces sont « marines » et plutôt tropicales.
Liste des formes
Selon NCBI (18 août 2013)[2] et World Register of Marine Species (18 août 2013)[3] :
- forme Prymnesium parvum f. patelliferum (J.C.Green, D.J.Hibberd & R.N.Pienaar) A.Larsen, 1999
Habitat
Cette espèce très commune dans les estuaires n'était supposée pouvoir vivre en milieu terrestre que dans des eaux saumâtres [4], mais elle est de plus en plus fréquemment trouvée pullulant dans les eaux douces, notamment aux États-Unis (par exemple au Texas depuis 1985) où elle est jugée préoccupante[5] notamment par les pêcheurs qui constatent des hécatombes de poissons dans certains lacs et cours d'eau.
On la trouve dans des environnements ouverts très lumineux, mais en laboratoire sa croissance peut être inhibée par une lumière excessive (photoinhibition)[6]. En Floride, dans les années 2000, on a récemment aussi observé des poissons tués par des efflorescences de cette algue dans des mares de jardins et de terrains de golfs, souvent dans des régions littorales.
C'est au Texas que cette algue semble avoir commencé à pulluler. L'économie texane (la seconde du pays en termes de revenus) présente comme caractéristique d'être très centrée sur l'exploitation pétrolière et du gaz naturel, et du gaz de schiste depuis peu.
Le lignite et le charbon bitumineux y ont aussi été très exploités. L'agriculture y est aussi très développée. Localement ces activités par leurs rejets ou le lessivage d'engrais ou de pesticides peuvent être sources de déséquilibres écologiques (dystrophisation, efflorescence algale).
Biologie, écologie
Description
Outre deux flagelles, chaque microalgue dispose d'un haptonème qui lui permet notamment de se fixer sur des objets ou d'autres êtres vivants.
La cellule contient un chloroplaste en forme de C, qui s'enroule en son milieu, et qui donne la couleur jaune-vert de la cellule. Le noyau est transparent. Il ne peut être vu au microscope optique s'il n'a pas été préalablement coloré. On distingue souvent des inclusions rondes dans l'algue, qui correspondent à des résidus de particules ou d'autres organismes qui ont été phagocytés (d'autres microalgues par exemple).
Elle se développe entre 2 et 30 °C.
P. parvum se multiplie le mieux dans une eau dont la salinité est comprise entre 0,3% et 6%, mais elle supporte des salinité de 0,1% et 10% et on en a trouvé des souches encore plus tolérantes vivant dans des milieux très minéralisés.
Elle supporte des eaux assez acides (jusqu'à un pH de 5,8 selon les observations disponibles), mais préfère des pH plus élevés.
Comportement
Cette espèce présente un comportement assez inhabituel chez les algues : un peu comme les plantes carnivores, quand elle manque de nutriment, ou qu'elle pullule, cette algue est capable de "manger" (par phagocytose) d'autres organismes. Le métabolisme de ce micro-organisme peut en effet basculer en mode hétérotrophe, le micro-organisme pouvant alors devenir "prédateur" (en phagocytant des proies ou des cellules mortes). Ceci lui permet de vivre dans l'obscurité, en présence de glycérol et en broutant des biofilms bactériens, surtout quand le phosphate est limité, ce qui a fait émettre l'hypothèse que P. parvum satisfait à son besoin en phosphates en consommant des bactéries.
Cette algue produit du diméthylsulfoniopropionate (DMSP) et d'autres polyols dont les fonctions sont encore inconnues mais qui pourraient être liés à des adaptations (osmorégulation) à des milieux inhabituellement salés ou minéralisés.
P. parvum peut utiliser une large gamme de sources d'azote, dont l'ammonium, les nitrates, les acides aminés (avec alors une certaine dépendance au pH), la créatine, mais est incapable d'utiliser l'urée.
Dans certaines conditions de concurrence, P. parvum réduit son activité et s'enkyste[7]. Le rôle de ses kystes fait l'objet d'une thèse, par Betty Scarborough (Université du Texas à Arlington). D'autres chercheurs tels que Ken Crane et James Harman travaillent sur la mixotrophie et son rôle chez cette algue. Selon leurs données, la mixotrophie aide cette algue à se développer, mais n'est pas suffisante pour expliquer son "succès" dans certaines conditions.
Les efflorescences algales
Elles surviennent généralement de la fin de l’hiver à l’été. Ils se traduisent par une eau devenant verte à jaunâtre, et la formation de mousse si l'eau est agitée (au niveau de seuils, barrages, berges).
L'augmentation récente de l'aire de répartition de cette espèce en Amérique du Nord pourrait avoir été favorisée d'une part par les déplacements de péniches et autres bateaux ou matériels de pêche d'un bassin versant à l'autre à partir de ports ou d'estuaires et d'autre part par des déséquilibres écologiques ou des apports en sels (à partir de rejets industriels, miniers notamment). Des apports massifs de sels de déneigement pourraient aussi localement et/ou temporairement la favoriser. C'est au Texas, que les premières pullulations ont été constatées et plutôt dans des plans d'eau ou cours d'eau riches ou enrichis en sels minéraux.
Écotoxicologie
Quand elle est stressée, l'algue P. parvum sécrète et libère dans l'eau au moins deux composés chimiques. Ils se combinent avec les cations (par exemple les ions magnésium Mg++ ou les ions calcium Ca++) dans l'eau et forment des toxines. Celles-ci sont donc fonction de la chimie de l'eau et habituellement, une combinaison de différentes toxines se forme.
Ces toxines pourraient normalement jouer le rôle d'un « venin »[8] ou d'un « poison » permettant à ces algues de manger d'autres organismes unicellulaires.
Mais si ces toxines sont massivement libérées dans l'eau par une grande quantité d'algues, elles sont d'abord actives sur les cellules qui sont mal protégées telles que celles présentes sur la surface des branchies des poissons ou celles des invertébrés aquatiques, ou des organes tels que les nageoires. Elles empêchent le bon fonctionnement de la régulation de l'eau dans la cellule (osmorégulation), qui meurt intoxiquée et/ou par excès d'eau. Après que la première couche de cellule soit détruite, les suivantes sont attaquées. Quand un vaisseau sanguin est atteint, il y a hémorragie. Par les branchies érodées, les toxines atteignent le système sanguin et circulatoire du poisson. Les organes internes sont alors endommagés. Les premiers symptômes visibles sont que le poisson se comporte comme si l'eau manquait d'oxygène ; il voyage entre la surface où il cherche à piper de l'air et le fond où il se repose puis meurt.
Ces toxines pourraient avoir comme fonction de ralentir ou immobiliser des proies ensuite « mangées » par cette algue.
Des éléments récents de preuves montrent que cette espèce ne produit des toxines qu'en cas de stress environnemental, par exemple en présence d'une surabondance de prédateurs planctoniques (zooplancton), qu'elle régule alors en ralentissant leur capacité d'ingestion/digestion [9]. De même, un manque d'azote ou de phosphore peut déclencher la production de toxines. Elle pourrait alors bénéficier des oligoéléments libérés par les cadavres des autres espèces ; ce qui pourrait constituer un moyen d'être plus compétitif dans un environnement.
Toxicité environnementale
Cette espèce pose en Amérique du Nord depuis quelques années des problèmes écologiques, toxicologiques et écotoxicologiques et économiques liées à la toxicité des molécules qu'elle produit (dont la prymnésine[10]).
Ces toxines sont des composés biochimiquement complexes et de poids moléculaire élevé[7]. Ces complexes sont hémolytiques[11], cytotoxiques[11] et ichtyotoxiques[11] à faible dose. Il est possible que toutes les toxines sécrétées par cette algue n'aient pas encore été identifiées[7].
Ces toxines tuent de nombreux vertébrés à sang froid et semi-aquatiques (ex : salamandres...) à faible dose, et elles affectent le reste de la communauté planctonique. Indirectement, tout l'écosystème est affecté. L'effet est allélopathique (l'algue inhibe la croissance des cyanobactéries, des dinoflagellés et tue les ciliés et diatomées[11]ce qui lui permet de pulluler[11]).
Cette algue peut aussi être présente dans certaines marées rouges littorales, où elle pourrait contribuer à des mortalités de poissons[12]. Selon une étude publiée par les scientifiques du Leibniz-Instituts für Gewässerökologie und Binnenfischerei (IGB), l'algue serait à l'origine de la mort de près de 100 tonnes de poissons dans le fleuve Oder en Pologne en août 2022[13],[14],[15].
Toxicité pour les mammifères et l'Homme ?
Ces toxines semblent sans effet sur les bovins buvant de l'eau contaminée par cette toxine[5], ou sur les charognards mangeant des poissons empoisonnés par les toxines. Ceci la distingue d'autres algues susceptibles de pulluler de la même manière (cyanophycées, algues responsables des marées rouges, plus toxiques pour l'homme que pour les poisons...).
Une hypothèse pour expliquer cela est que l'algue et ses toxines sont dépendantes de pH basiques ou peu acides, et qu'elles sont détruites par l'acidité de l'estomac. En outre, la peau et les muqueuses des animaux terrestres tels que les mammifères pourraient également mieux les protéger.
Ses effets sur l'Homme n'ont pas été réellement très étudiés. Selon le "Department of State Health Services" du Texas, on ne connaît pas de cas d'Ichtyosarcotoxisme induit à cette algue, mais il est recommandé de ne pas consommer les poissons morts ou mourants qui ont été exposés à une floraison planctonique de P. parvum[16].
Recherche
Cette algue a été découverte en Amérique du Nord en 1985.
On ignore cependant si elle y préexistait naturellement à l'arrivée des Occidentaux et au développement de l'industrie, ou si elle a été introduite par l'Homme (comme pour quelques autres espèces volontiers envahissantes voire invasives, et qui n'avaient jamais été repérées dans les inventaires précédents).
En eau douce, elle semble pouvoir être favorisée par les rejets acides et minéralisés d'activités minières voire de riverains (Autour du lac Lake Granbury touché par des épisodes de efflorescences algales écotoxiques, de nombreux riverains rejetaient leurs eaux usées directement dans le lac, sans passage par une fosse septique ou une station d'épuration.
Cette microalgue a fait l'objet de cultures in vitro ou en « réacteurs »[17], pour son étude, mais aussi pour des projets d'utilisation pour la production de "biocarburants" (en raison de son taux élevé de lipides et d'une relative facilité de culture).
Impacts économiques
Ils varient selon la taille des masses d'eau affectées, selon sa richesse en poisson, et selon les lieux où se produisent les pullulations qui peuvent être source d'un manque à gagner pour les activités de pêche (professionnelles ou amateur) ou pour le tourisme vert. Au Texas par exemple, les principaux effets économiques négatifs directs semblent concerner « les guides de pêche, les exploitants de camps de vacances, parcs, hôtels, motels, restaurants, magasins de vêtements, les stations d'essence, etc. ». Des effets indirects ou secondaires sont liés à la détérioration de l'image des zones touchées, et aux moindres revenus. Une évaluation économique a été faite pour le Possum Kingdom Lake (PKL) qui a été au Texas touché par une importante efflorescence algale à P. parvum, de janvier à , puis en 2003[18] ; L'efflorescence algale de 2001 a induit une perte financière de 2,8 millions de dollars aux communautés locales, rien que par le recul du nombre de visiteurs (57% en moins, correspondant à une moyenne de 4793 touristes en moins par mois dans le parc national) ; pour les commerçants, le manque à gagner a été de 9 658 dollars en 2001 et de 22 318 dollars en 2003[18].
Notes et références
- Guiry, M.D. & Guiry, G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway. https://www.algaebase.org, consulté le 18 août 2013
- NCBI, consulté le 18 août 2013
- World Register of Marine Species, consulté le 18 août 2013
- TpwdGolden Alga ; Management of Prymnesium parvum at Texas State Fish Hatcheries Current Bloom Status What is Golden Alga (Prymnesium parvum)? Management Data Series 236
- Eugenio Melotti, (2013), Alghe imbroglione, Aula di scienze (it), 2013-02-08, consulté 2013-02-08
- Reich K, Parnas I (1962) Effect of illumination on ichthyotoxin in axenic culture of Prymnesium parvum Carter. J Proto- zool 9:38–40
- Université du Texas à Arlington (Texas), Présentation des recherches de Dr. James P. Grover , Département "Biologie", consulté 2013-08-17
- Alasdair Wilkins (2013), Toxic algae species is full of freeloading cheaters... and why that makes them even deadlier, 1/20/13, consulté 2013-08-17
- U Tillmann (2003),Kill and eat your predator: a winning strategy of the planktonic flagellate Prymnesium parvum - Aquatic microbial ecology, (résumé avec Inist-CNRS
- Shilo M (1981) The toxic principles of Prymnesium parvum. In: Carmichael WW (ed) The water environment: algal toxins and health. Plenum Press, New York, p 37–47
- GO Fistarol, C Legrand, E Granéli (2003) Allelopathic effect of Prymnesium parvum on a natural plankton community ; Marine ecology progress series, PDF avec int-res
- Igarashi T, Satake M, Yasumoto T (1996) Prymnesin-2: a potent ichthyotoxic and hemolytic glycoside isolated from the red tide alga Prymnesium parvum . J Am Chem Soc 118:479–480
- Hélène Bienvenu, « Près de 100 tonnes de poissons morts dans le fleuve Oder en Pologne, un désastre écologique sans explication », Le Monde, (lire en ligne
 , consulté le )
, consulté le ) - (en) Reuters, « Rare toxic algae behind fish deaths in river Oder, say researchers », Reuters, (lire en ligne
 , consulté le )
, consulté le ) - (en) IGB, « Environmental disaster on the Oder: IGB researchers track potentially toxic algae | IGB »
 , sur Leibniz-Institute of Freshwater Ecology and Inland Fisheries, (consulté le )
, sur Leibniz-Institute of Freshwater Ecology and Inland Fisheries, (consulté le ) - Etat du Texas, Biology of Golden Alga, Prymnesium parvum What Is Prymnesium parvum?, Texas, parcs and wildlife, consulté 2013-08-17
- Reich, K. and Kahn, J. (1951), A bacteria-free culture of Prymnesium parvum (Chrysomonadina). Bull. Res. Council Israel. 4: 144-149
- Chi-Ok Oh & Robert B. Ditton (2005) [Estimating the Economic Impacts of Golden Algae (Prymnesium parvum) on Recreational Fishing at Possum Kingdom Lake media Estimating the Economic Impacts of Golden Alga ( Prymnesium parvum ) on Recreational Fishing at Possum Kingdom Lake, Texas] ; Report Prepared for the Texas Parks and Wildlife Department ref : PWD RP T3200-1168 ; 2005-10-01, consulté 2013-08-17 (PDF 34 p, 328 KB) ]
Voir aussi
Articles connexes
Bibliographie
- (en) Igarashi T, Satake M, Yasumoto T (1996) Prymnesin-2: a potent ichthyotoxic and hemolytic glycoside isolated from the red tide alga Prymnesium parvum . J Am Chem Soc 118:479–480
Liens externes
- (en) Référence AlgaeBase : espèce Prymnesium parvum N.Carter (consulté le )
- (fr+en) Référence ITIS : Prymnesium parvum (consulté le )
- (en) Référence NCBI : Prymnesium parvum (taxons inclus) (consulté le )
- (en) Référence uBio : Prymnesium parvum N. Carter ex J. C. Green, D. J. Hibberd & Pienaar (consulté le )
- (en) Référence World Register of Marine Species : espèce Prymnesium parvum N.Carter, 1937 (consulté le )
- (en) photographies et vidéos de P. parvum (microcopie) et photos d'efflorescences planctoniques impliquant cette espèce, et d'effets sur la faune (en)
- (en) « Removal of Prymnesium parvum (Haptophyceae) cells under different nutrient conditions by clay »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- (en) Literature review of the microalga Prymnesium parvum and its associated toxicity
- (en) Influence of different nutrient conditions on cell density, chemical composition and toxicity of Prymnesium parvum (Haptophyta) in semi-continuous cultures
- Portail de la biologie marine
- Portail de la phycologie