Signalisation cellulaire
La signalisation cellulaire est un système complexe de communication qui régit les processus fondamentaux des cellules et coordonne leur activité. La capacité des cellules à percevoir leur micro-environnement et à y répondre correctement est à la base de leur développement et de celui des organismes multicellulaires, de la cicatrisation et du système immunitaire, ainsi que de l'homéostasie tissulaire normale. Des dysfonctionnements dans le traitement de l'information cellulaire peuvent être responsables de maladies telles que le cancer, les maladies auto-immunes et le diabète. L'allostérie à grande distance est souvent un aspect important de ces processus[1].
L'approche traditionnelle de la biologie a mis l'accent sur l'étude des aspects spécifiques aux différentes voies de signalisation cellulaire, tandis que les recherches en biologie des systèmes visent à mieux comprendre la structure sous-jacente aux réseaux de signalisation cellulaire et l'impact des modifications de ces réseaux sur la transmission et le traitement de l'information. Ces réseaux constituent en effet des systèmes complexes faisant apparaître des propriétés émergentes telles que la bistabilité et l'ultrasensibilité.
Organismes unicellulaires et multicellulaires

La signalisation cellulaire a été essentiellement abordée dans le cadre des maladies humaines et de la signalisation entre les cellules d'un même organisme. Elle peut toutefois intervenir entre les cellules de deux organismes distincts. Chez la plupart des mammifères, l'embryon communique avec des cellules de l'utérus[2]. Dans l'appareil digestif humain, les bactéries échangent des signaux entre elles et avec les cellules épithéliales et du système immunitaire[3]. Lors de l'accouplement de Saccharomyces cerevisiae, certaines cellules envoient autour d'elles un signal peptidique au moyen de phéromones d'accouplement ; ces facteurs peptidiques se fixent à des récepteurs à la surface d'autres cellules de levure et les préparent à l'accouplement[4].
Types de signaux

Les cellules communiquent entre elles par contact direct (signalisation juxtacrine), sur de courtes distances (signalisation paracrine) et sur de grandes distances ou à grande échelle (système endocrinien).
Certaines communications intercellulaires requièrent un contact direct entre les cellules. Dans certains cas peuvent se former des jonctions communicantes qui mettent en relation le cytoplasme de cellules adjacentes. De telles jonctions permettent par exemple la propagation du potentiel d'action initié par la dépolarisation des cellules du nœud sinusal à l'ensemble du myocarde pour provoquer la contraction coordonnée du cœur.
La voie de signalisation Notch est un exemple de signalisation juxtacrine, également connue comme signalisation de contact, dans laquelle deux cellules adjacentes doivent établir un contact physique pour communiquer. Ceci permet un contrôle très précis de la différenciation cellulaire au cours du développement embryonnaire. Chez le nématode Caenorhabditis elegans, deux cellules de gonade en cours de développement ont une chance égale de terminer leur différenciation ou de devenir un blaste utérin qui poursuivra sa division. L'orientation vers la seconde option dépend de la résultante des signaux en compétition reçus à la surface de la cellule. Il arrivera ainsi qu'une cellule parvienne à produire en plus grandes quantités une certaine protéine membranaire qui active le récepteur Notch sur la cellule adjacente. Ceci active une boucle ou un système de rétroaction qui d'une part réduit l'expression de Notch dans les cellules devant se différencier et d'autre part accroît l'expression de Notch dans celles qui poursuivent leurs divisions comme cellules souche[5].
De nombreux signaux cellulaires sont véhiculés par des molécules qui sont libérées par une cellule et se déplacent jusqu'à entrer en contact avec une autre cellule. Ces signaux endocriniens sont appelés hormones. Les hormones sont produites par les cellules endocrines et sont transportées dans le sang pour atteindre toutes les parties de l'organisme. La spécificité de la signalisation dépend du fait que seules quelques cellules sont susceptibles de répondre à une hormone particulière.
Les signaux paracrines, tels que ceux véhiculés par l'acide rétinoïque, ciblent uniquement les cellules voisines de la cellule émettrice[6]. Les neurotransmetteurs offrent un autre exemple de signaux paracrines.
Certaines molécules peuvent fonctionner à la fois comme hormones et comme neurotransmetteurs. Ainsi, l'adrénaline et la noradrénaline fonctionnent comme des hormones lorsqu'elles sont libérées par les glandes surrénales et sont transportées vers le cœur par voie sanguine. La noradrénaline peut également être produite par les neurones et fonctionner comme un neurotransmetteur dans le cerveau[7]. Les œstrogènes peuvent être libérés par l'ovaire et fonctionner comme des hormones ou agir localement par communication autocrine ou paracrine[8].
Les dérivés réactifs de l'oxygène et du monoxyde d'azote peuvent également agir comme messagers cellulaires. Ce processus est qualifié de signalisation redox.
Récepteurs de la motilité et de la différenciation cellulaires
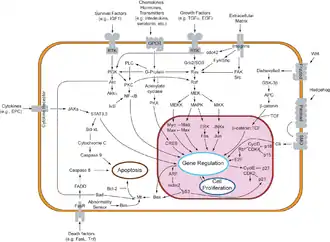
Les cellules reçoivent des informations de leurs voisines à travers une classe de protéines appelées récepteurs. La protéine Notch est une protéine de la surface cellulaire qui fonctionne comme un récepteur. Les animaux ont un ensemble restreint de gènes qui codent des protéines de signalisation interagissant spécifiquement avec les récepteurs Notch et induisant une réponse dans les cellules qui expriment Notch à leur surface. Les molécules qui activent (ou, dans certains cas, inhibent) les récepteurs peuvent être classées en hormones, neurotransmetteurs, cytokines et facteurs de croissance, mais tous ces éléments sont appelés ligands du récepteur.
La protéine Notch agit comme un récepteur pour des ligands qui sont exprimés sur les cellules adjacentes. Alors que certains récepteurs sont des protéines situées en surface des cellules, d'autres se trouvent à l'intérieur de ces dernières. Ainsi, les œstrogènes sont des composés hydrophobes qui peuvent franchir la bicouche lipidique de la membrane cellulaire. Faisant partie du système endocrinien, les récepteurs des œstrogènes sont des récepteurs nucléaires qui peuvent activer de nombreux types de cellules sous l'effet des œstrogènes produits par les ovaires.
Il existe un certain nombre de récepteurs transmembranaires[9],[10] pour les petites molécules et les hormones peptidiques[11] ainsi que pour les récepteurs intracellulaires des hormones stéroïdiennes, donnant aux cellules la capacité à répondre à une large variété de stimuli hormonaux et pharmacologiques. De nombreuses maladies résultent de l'activation aberrante de récepteurs par des protéines qui interagissent avec eux, provoquant en aval l'activation sans cause de certains signaux, de façon constitutive[12].
Plusieurs types de molécules véhiculant des signaux destinés à des récepteurs intracellulaires sont de nature hydrophile et ne peuvent par conséquent franchir la membrane cellulaire, qui est de nature lipidique, et donc hydrophobe ; dans ce cas, ces vecteurs hydrophiles activent d'abord des récepteurs membranaires en surface de la cellule qui produisent un messager secondaire, typiquement l'AMPc[13],[14], lequel diffuse ensuite dans le cytoplasme pour atteindre des récepteurs intracellulaires.
Voies de signalisation
Dans certains cas, l'activation du récepteur provoquée par la liaison du ligand à un récepteur est directement couplée à la réponse de la cellule au ligand. Ainsi, l'acide γ-aminobutyrique (GABA), un neurotransmetteur, peut activer à la surface de la cellule un récepteur faisant partie d'un canal ionique. Lorsqu'il se lie aux récepteurs GABAA, l'acide γ-aminobutyrique ouvre un canal ionique spécifique aux ions chlorure Cl− au sein de ce récepteur, ce qui permet à ces ions de pénétrer à l'intérieur du neurone et bloque sa capacité à générer un potentiel d'action.
Cependant, pour de nombreux récepteurs situés à la surface de la cellule, les interactions ligand-récepteur ne sont pas directement couplées à la réponse de la cellule. Le récepteur activé doit tout d'abord interagir avec d'autres protéines au sein de la cellule avant que l'effet physiologique du ligand sur le comportement de la cellule ne se manifeste. Il arrive fréquemment que le fonctionnement d'une chaîne de plusieurs protéines cellulaires en interaction soit modifié à la suite de l'activation du récepteur. L'ensemble des modifications cellulaires induites par l'activation du récepteur est appelé voie ou mécanisme de transduction du signal[15].
Dans le cas de la voie de signalisation Notch, le mécanisme de transduction du signal peut être relativement simple. L'activation du récepteur Notch peut provoquer son altération par une peptidase : un fragment du récepteur se détache alors de la membrane cellulaire et intervient dans la régulation de l'expression de certains gènes[réf. nécessaire].
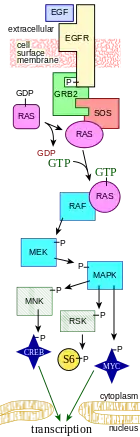
Dans le cas de la voie de signalisation ERK/MAP kinase, c'est l'interaction entre protéines à l'intérieur de la cellule qui est modifiée sous l'effet d'un signal extérieur. De nombreux facteurs de croissance se lient à des récepteurs de la membrane cellulaire et poussent les cellules à progresser le long du cycle cellulaire et à se diviser. Plusieurs de ces récepteurs sont des kinases dont l'activité de phosphorylation dépend de leur liaison à un ligand. Cette phosphorylation peut former un site de liaison pour une autre protéine et ainsi permettre une interaction de protéine à protéine. Dans la voie de signalisation ERK/MAP kinase, un ligand, appelé facteur de croissance épidermique (EGF), se lie au récepteur de l'EGF, ce qui conduit ce dernier à se phosphoryler lui-même et à se lier à la protéine Grb2, une protéine adaptatrice qui couple ce signal à d'autres processus de signalisation en aval. L'une des voies de transduction du signal ainsi activées est la voie de signalisation dite ERK/MAP kinase, ainsi appelée en référence aux protéine kinases activées par mitogène (MAP kinases, autrefois appelées ERK). Ces protéine kinases sont des kinases phosphorylant spécifiquement certaines protéines telles que le facteur de transcription Myc, altérant ainsi la transcription génétique et, en fin de compte, la progression du cycle cellulaire[réf. nécessaire].
Certaines voies de transduction de signal répondent différemment selon l'intensité du message reçu par la cellule. C'est le cas de la protéine Hedgehog, qui active différents gènes en fonction de sa concentration[réf. nécessaire].
Classification des modes de communication entre cellules
Parmi les différents modes de communication entre cellules, on distingue traditionnellement la communication :
1. entre cellules voisines :
- contact direct : jonctions ouvertes pour les cellules animales et plasmodesmes chez les végétaux permettant à des molécules de passer directement d'une cellule à une autre qui lui est reliée, ceci sans traverser la membrane plasmique.
- régulateurs locaux : facteurs de croissance et neurotransmetteurs
2. à distance :
- endocrine, relative à la réception de signaux à grande distance de la cellule émettrice ; c'est notamment le cas des hormones, qui sont produites par les glandes endocrines et sont véhiculées dans le sang à travers tout l'organisme vers des cellules cibles auxquelles elles se fixent via des récepteurs membranaires.
Chez les animaux on observe aussi d'autres types de communication :
- paracrine, relative à la réception de signaux à proximité de la cellule émettrice: la cellule qui désire interagir avec d'autres cellules proches dite sécrétrice va libérer par des vésicules de sécrétion, des molécules d'un régulateur local dans le fluide extracellulaire ;
- autocrine, on dit qu'une communication est autocrine lorsqu'elle est paracrine et que les molécules produites agissent en retour à la surface de la cellule émettrice ; elle peut éventuellement concerner des échanges de signaux entre cellules voisines de même type qui n'établissent pas de contact physique entre elles, comme c'est par exemple le cas des leucocytes ou des cellules tumorales ;
- juxtacrine, relative à la réception de signaux par une cellule ayant établi un contact physique avec la cellule émettrice ; ces signaux se propagent le long de la membrane cellulaire à travers ses constituants lipidiques ou protéiques et sont susceptibles d'affecter ou bien la cellule émettrice ou bien les cellules adjacentes ;
- synaptique, relative à la transmission de l'information par voie nerveuse: un potentiel électrique propagé le long d'un neurone déclenche la sécrétion d'un type de messager chimique (les neurotransmetteurs) dans la fente synaptique, stimulant ainsi la cellule cible ;
- intracrine, relative à la réception de signaux à l'intérieur même des cellules, par exemple au niveau du noyau de cellules eucaryotes.
Il est important de noter que la capacité d'une cellule à répondre à ces différents types de signaux va dépendre de la présence ou de l'absence de récepteurs spécifiques qui auront la capacité de se lier à la molécule de signalisation aussi appelée ligand.
Notes et références
- (en) Zimei Bu et David J.E. Callaway, « Chapter 5 – Proteins MOVE! Protein dynamics and long-range allostery in cell signaling », Advances in Protein Chemistry and Structural Biology, vol. 83, , p. 163–221 (lire en ligne) DOI:10.1016/B978-0-12-381262-9.00005-7
- (en) Othman A. Mohamed, Maud Jonnaert, Cassandre Labelle-Dumais, Kazuki Kuroda, Hugh J. Clarke et Daniel Dufort, « Uterine Wnt/β-catenin signaling is required for implantation », Proceedings of the National Academy of Sciences of the United States of America, vol. 102, no 24, , p. 8579-8584 (lire en ligne) DOI:10.1073/pnas.0500612102
- (en) Marcie B. Clarke et Vanessa Sperandio, « Events at the Host-Microbial Interface of the Gastrointestinal Tract III. Cell-to-cell signaling among microbial flora, host, and pathogens: there is a whole lot of talking going on », Gastrointestinal and Liver Physiology, vol. 288, no 6, , G1105-G1109 (lire en ligne) DOI:10.1152/ajpgi.00572.2004
- (en) Jennifer C. Lin, Ken Duell et James B. Konopka, « A Microdomain Formed by the Extracellular Ends of the Transmembrane Domains Promotes Activation of the G Protein-Coupled α-Factor Receptor », Molecular and Cellular Biology, vol. 24, no 5, , p. 2041-2051 (lire en ligne) DOI:10.1128/MCB.24.5.2041-2051.2004
- (en) Iva Greenwald, « LIN-12/Notch signaling: lessons from worms and flies », Genes & Development, vol. 12, , p. 1751-1762 (lire en ligne) DOI:10.1101/gad.12.12.1751
- (en) Gregg Duester, « Retinoic Acid Synthesis and Signaling during Early Organogenesis », Cell, vol. 134, no 6, , p. 921-931 (lire en ligne) DOI:10.1016/j.cell.2008.09.002
- (en) M. Claire Cartford, Amy Samec, Mathew Fister et Paula C. Bickford, « Cerebellar norepinephrine modulates learning of delay classical eyeblink conditioning: Evidence for post-synaptic signaling via PKA », Learning Memory, vol. 11, , p. 732-737 (lire en ligne) DOI:10.1101/lm.83104
- (en) S Jesmin, C N Mowa, I Sakuma, N Matsuda, H Togashi, M Yoshioka, Y Hattori et A Kitabatake, « Aromatase is abundantly expressed by neonatal rat penis but downregulated in adulthood », Journal of Molecular Endocrinology, vol. 33, , p. 343-359 (lire en ligne) DOI:10.1677/jme.1.01548
- (en) Ivana Domazet, Brian J. Holleran, Stéphane S. Martin, Pierre Lavigne, Richard Leduc, Emanuel Escher et Gaétan Guillemette, « The Second Transmembrane Domain of the Human Type 1 Angiotensin II Receptor Participates in the Formation of the Ligand Binding Pocket and Undergoes Integral Pivoting Movement during the Process of Receptor Activation », Journal of Biological Chemistry, vol. 284, no 18, , p. 11922-11929 (lire en ligne) DOI:10.1074/jbc.M808113200
- (en) James N. Hislop, Anastasia G. Henry, Adriano Marchese et Mark von Zastrow, « Ubiquitination Regulates Proteolytic Processing of G Protein-coupled Receptors after Their Sorting to Lysosomes », Journal of Biological Chemistry, vol. 284, no 29, , p. 19361-19370 (lire en ligne) DOI:10.1074/jbc.M109.001644
- (en) He Meng, Xiaojie Zhang, Kurt D. Hankenson et Michael M. Wang, « Thrombospondin 2 Potentiates Notch3/Jagged1 Signaling », Journal of Biological Chemistry, vol. 284, no 12, , p. 7866-7874 (lire en ligne) DOI:10.1074/jbc.M803650200
- (en) John A. Copland, Melinda Sheffield-Moore, Nina Koldzic-Zivanovic, Sean Gentry, George Lamprou, Fotini Tzortzatou- Stathopoulou, Vassilis Zoumpourlis, Randall J. Urban et Spiros A. Vlahopoulos, « Sex steroid receptors in skeletal differentiation and epithelial neoplasia: is tissue-specific intervention possible? », BioEssays, vol. 31, no 6, , p. 629-641 (lire en ligne) DOI:10.1002/bies.200800138
- (en) Siew-Lee Goh, Yvonne Looi, Hui Shen, Jun Fang, Caroline Bodner, Martin Houle, Andy Cheuk-Him Ng, Robert A. Screaton et Mark Featherstone, « Transcriptional Activation by MEIS1A in Response to Protein Kinase A Signaling Requires the Transducers of Regulated CREB Family of CREB Co-activators », Journal of Biological Chemistry, vol. 284, no 28, , p. 18904-18912 (lire en ligne) DOI:10.1074/jbc.M109.005090
- (en) Kacper A. Wojtal, Dick Hoekstra et Sven C.D. van IJzendoorn, « cAMP-dependent protein kinase A and the dynamics of epithelial cell surface domains: Moving membranes to keep in shape », BioEssays, vol. 30, no 2, , p. 146-155 (lire en ligne) DOI:10.1002/bies.20705
- (en) Ashok Reddy Dinasarapu, Brian Saunders, Iley Ozerlat, Kenan Azam et Shankar Subramaniam, « Signaling gateway molecule pages—a data model perspective », Bioinformatics, vol. 27, no 12, , p. 1736-1738 (lire en ligne) DOI:10.1093/bioinformatics/btr190
Voir aussi
Bibliographie
- Joël Bockaert, La Communication du vivant. De la bactérie à Internet, Odile Jacob, , 208 p. (lire en ligne)
Articles connexes
- Portail de la biologie cellulaire et moléculaire
- Portail de la biochimie