Tomographie par émission de positons
La tomographie par émission de positons[1] (TEP), dénommée PET ou PET scan pour « positron emission tomography » en anglais, est une méthode d'imagerie médicale pratiquée par les spécialistes en médecine nucléaire qui permet de mesurer en trois dimensions une activité métabolique ou moléculaire d'un organe grâce aux émissions produites par les positons (positrons en anglais) issus d'un produit radioactif injecté au préalable.
Pour les articles homonymes, voir TEP.
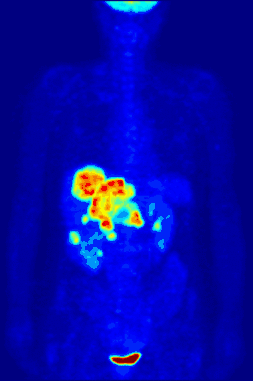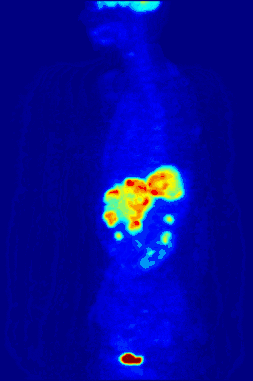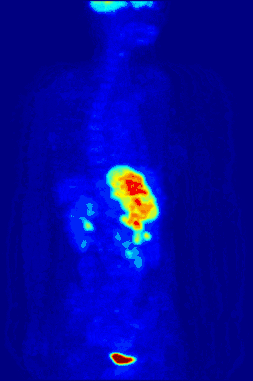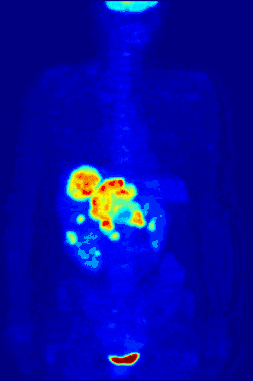
La TEP repose sur le principe général de la scintigraphie qui consiste à injecter un traceur dont on connaît le comportement et les propriétés biologiques pour obtenir une image du fonctionnement d'un organe ou la présence d'une cible moléculaire. Ce traceur est marqué par un atome radioactif (carbone, fluor, azote, oxygène…) qui émet des positons dont l'annihilation produit deux photons. C'est la détection en coïncidence de ces photons qui permet la localisation du lieu de leur émission et donc la concentration du traceur en chaque point de l'organe. C'est cette information quantitative que l'on représente sous la forme d'une image faisant apparaître en couleurs les zones de forte concentration du traceur.
Ainsi, la TEP permet de visualiser les activités du métabolisme des cellules : on parle d'imagerie fonctionnelle par opposition aux techniques d'imagerie dite structurelle comme celles basées sur les rayons X (radiologie ou CT-scan scanner) qui réalisent des images de l'anatomie. Par conséquent, la tomographie par émission de positons est un outil diagnostique qui permet de déceler certaines pathologies qui se traduisent par une altération de la physiologie normale comme les cancers, mais aussi les démences par exemple.
De plus en plus l'expression d'« imagerie moléculaire » est employée, puisque les traceurs permettent de réaliser des images de cibles moléculaires : cibler un récepteur particulier, marquer le dépôt de plaques amyloïdes, acquérir des images de processus hypoxiques, de récepteurs hormonaux…
La TEP est aussi utilisée en recherche biomédicale.
Histoire
Le principe de la TEP en imagerie médicale voit le jour dès les années 1950, avec la première machine construite au Laboratoire de recherche en physique au Massachusetts General Hospital (MGH), utilisée dans le cadre de la localisation de tumeurs cérébrales[2]. Il s'agit alors d'un simple dispositif utilisant deux détecteurs opposés d'iodure de sodium[3]. Après plusieurs versions de ce premier modèle, un scanner « hybride » fut développé dans les années 1960[4]. Ce modèle possédait deux rangées de neuf détecteurs, chacun en coïncidence avec trois autres détecteurs de la rangée opposée, permettant d'obtenir une image bidimensionnelle (2D). Puis les premiers modèles commerciaux à anneaux furent développés avec par exemple l'ECATI d'ORTEC en 1978[réf. souhaitée]. Parallèlement à ces développements techniques, les radiopharmaceutiques (ou traceurs) furent également développés. Après celle de l'oxygène 15, l'utilisation du carbone 11, du fluor 18 ou de l'azote 13 se répandit à partir des années 1970.
Ce n'est qu'à partir des années 2000 que les premiers scanners multi modalité TEP/TDM couplant au sein du même statif un scanner à rayons X (tomodensitométrie, TDM) avec un scanner TEP sont construits puis commercialisés[5]. Ces machines sont dorénavant le standard de référence, les grands constructeurs (Philips, Siemens et GE) ne fabriquent plus que ce type de machine et la quasi-totalité des services cliniques utilisent des machines multi-modalité TEP/TDM.
Définition et principe
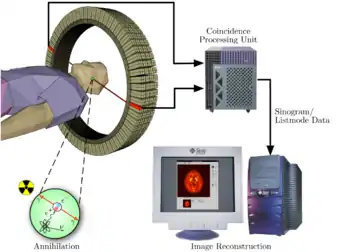
Une tomographie par émission de positons (TEP) est un examen d’imagerie médicale par scintigraphie réalisé dans un service de médecine nucléaire.
La scintigraphie en TEP est obtenue par injection d’un traceur faiblement radioactif par voie intraveineuse. Le marqueur est le plus souvent le fluor 18 (18F) incorporé dans une molécule de glucose formant le 18F-fluorodésoxyglucose (en abrégé 18F-FDG). Ce traceur est semblable au glucose : il se fixe au niveau des tissus qui consomment de grandes quantités de ce sucre, comme les tissus cancéreux, le muscle cardiaque ou encore le cerveau. Le fluor 18, dont la demi-vie est inférieure à deux heures, émet ensuite de façon temporaire des rayonnements que l’on peut suivre dans l’organisme du patient grâce à une caméra spéciale, une caméra TEP. Le fluor 18 ainsi que les autres isotopes pouvant être utilisés (oxygène 15 (15O), azote 13 (13N), carbone 11 (11C)) ont une courte demi-vie, jusqu’à 110 minutes pour le fluor[réf. souhaitée]. Ces isotopes de courte durée nécessitent pour leur production un cyclotron.
Une caméra TEP est un appareil qui a l’aspect d’un scanner mais son principe de fonctionnement est différent. En effet, l'atome radioactif (par exemple, le fluor 18) se désintègre en émettant un positon. Celui-ci va s'annihiler avec un électron du milieu, après un très court parcours de l'ordre du millimètre (0,6 mm dans l'eau pour le positon du 18F). Cette annihilation produit deux photons gamma de 511 keV qui partent sur une même direction mais dans un sens opposé, ce qui rend possible le traitement tomographique des données. En effet, les capteurs situés tout autour du patient détectent les photons d'annihilation en coïncidence (c’est-à-dire ceux qui arrivent en même temps), ce qui permet d'identifier la ligne sur laquelle se situe l'émission des photons. Un système informatique reconstitue ensuite à l'aide d'un algorithme de reconstruction les images de la répartition du traceur au niveau d’une partie ou de la totalité du corps sous la forme d'une image 2D ou d'un objet 3D. Les images ainsi obtenues sont dites « d’émission » (la radioactivité provient du traceur injecté au patient). La résolution spatiale de l'image ainsi obtenue est comprise entre 4 et 7 mm en imagerie clinique (pour l'homme) et inférieure à 1,5 mm en imagerie préclinique (destinée au rat ou à la souris)[6].
Il est possible d’améliorer la qualité des images en utilisant le principe de correction d’atténuation. Lors de la traversée du corps, de nombreux photons gamma subissent une atténuation liée aux structures traversées et à leur épaisseur. En effet, un foyer hyperfixant situé en profondeur sera moins visible qu'un même foyer situé en surface. Pour effectuer cette correction, on utilisait initialement des images de transmission obtenues grâce à une source radioactive qui tourne rapidement autour du patient. Cependant la plupart des caméras TEP sont aujourd'hui couplées à un tomodensitomètre à rayons X (système TEP/TDM ou PET/CT en anglais), ce qui permet de superposer l'image fonctionnelle (image TEP) à sa localisation anatomique précise dans le corps (image CT). La correction d’atténuation ainsi réalisée permet d'effectuer l'examen beaucoup plus rapidement et d'obtenir des images de meilleure qualité.
Exposition aux radiations et radioprotection
Au cours d'une tomographie par émission de positons, le patient reçoit une dose équivalente inférieure à 10 mSv ce qui correspond à la dose reçue au cours d'un scanner thoraco-abdominal. Avec le FDG, on injecte en général au patient de l'ordre de 3 à 5 MBq/kg (5 millions de désintégrations par seconde) soit de 150 à 400 MBq pour un adulte. L’activité injectée varie en fonction du poids et de l’âge du patient. La période radioactive (le temps pour que la radioactivité diminue de moitié) du produit le plus utilisé en TEP (le fluor 18, 18F) est de l'ordre de 110 minutes. Donc en 12 heures la quasi-totalité de la radioactivité a disparu. En réalité, la radioactivité disparaît encore plus rapidement car le FDG non fixé est naturellement éliminé avec les urines. L'examen lui-même dure en général près d'une demi-heure. La réalisation de cet examen ne présente pas de danger pour les patients ni pour leur entourage. Cependant, quelques précautions sont à prendre pour éviter une exposition inutile de l'entourage aux radiations : en raison de la radioactivité des radiopharmaceutiques injectés, cet examen est contre-indiqué chez les femmes enceintes, comme tous les examens utilisant des radiations ionisantes. Les mères allaitant devront suspendre l’allaitement durant dix à douze heures après l’injection car une partie du traceur radioactif peut se retrouver dans le lait maternel. Les contacts avec les jeunes enfants et les femmes enceintes sont à éviter la journée suivant l’examen. De légères précautions (tel que le stockage des urines après l'examen, pendant 24 heures pour le FDG) sont donc à prendre vis-à-vis du milieu familial, professionnel ou hospitalier pendant environ 12 heures, temps moyen pour que la plus grande partie de la radioactivité ait disparu. De plus, des précautions supplémentaires sont à prendre pour les patients incontinents ou porteurs d’une sonde urinaire du fait de l’élimination du traceur par les urines.
Principaux traceurs utilisés
Le 18F FDG
Le 18F-FDG (fluorodesoxyglucose marqué au fluor 18) est un sucre semblable au glucose, rendu radioactif. C’est la radioactivité de cet atome de fluor particulier « accroché » au glucose qui permet sa détection par la caméra TEP. Pour vivre, fonctionner et se reproduire, les cellules ont besoin d’énergie sous forme de glucose, sucre assimilable par l’organisme. Cette source énergétique est essentielle aux nombreuses cellules de l’organisme et elle se trouve naturellement dans le sang. Plus l’activité des cellules est importante, plus leur consommation de glucose augmente.
Les cellules cancéreuses se multiplient sans cesse. Ces nombreuses multiplications nécessitent beaucoup d’énergie ; elles ont donc une consommation anormalement élevée de glucose par rapport aux cellules normales. C’est grâce à cette consommation excessive de glucose que l’on peut repérer le tissu cancéreux avec la caméra TEP.
Le 18F-FDG se comporte comme le glucose, mais contrairement à celui-ci, il n’est pas une source d’énergie utilisable par la cellule cancéreuse. La molécule de 18F-FDG est phosphorylée par la cellule après son entrée ce qui l'empêche de ressortir de la cellule. Ensuite le FDG phosphorylé s'accumule dans le cytoplasme de la cellule car il n'est pas reconnu par les enzymes du cycle de dégradation du glucose normal. En devenant ainsi radioactive, la cellule émet des rayonnements qui peuvent être détectés par la caméra TEP. Le tissu cancéreux est ainsi repéré grâce à l’accumulation du produit radioactif sous la forme d’une image d’hyperfixation.
Toutes les informations recueillies par la caméra TEP reposent sur la radioactivité repérée dans les tissus après l'injection du 18F-FDG au patient. Le système informatique relié à la caméra TEP produit des images en coupe et en trois dimensions des endroits du corps où le 18F-FDG s'est accumulé.
Ses autres indications en dehors de la cancérologie sont les TEP cérébrales (étude du métabolisme cérébral régional) et myocardiques (étude de la viabilité du myocarde).
La F-Choline
Petite molécule précurseur des phospholipides membranaires, elle est disponible commercialement depuis 2010. Elle est indiquée dans l'évaluation du cancer prostatique[7] (bilan d'extension initial de certaines formes localement avancées et surtout localisation des récidives occultes) et celle du carcinome hépatocellulaire (CHC)[8].
Le F-Na et la F-DOPA
L'utilisation du radiotraceur 18FNa, combinée au scanner X, permet d'explorer le squelette en moins d'une heure sans irradier excessivement l'organisme[9]. Il peut contribuer à la détection de fractures d'âges variés chez des enfants battus[10].
En neurologie l'utilisation de la F-DOPA peut notamment aider à distinguer une paralysie supranucléaire progressive (syndrome de Steele-Richardson-Olszewski), d'une atrophie multisystématisée ou d'une maladie de Parkinson au diagnostic ambigu[11].
Déroulement d'un examen TEP

Pour que l’examen se déroule dans des conditions optimales, il convient de respecter certaines indications. Une éventuelle grossesse est à préciser, tout retard de règles sera donc signalé. Selon le traceur utilisé, la préparation, le délai d'attente et la durée de l'examen peuvent varier substantiellement.
Avec le traceur le plus utilisé en TEP, le FDG, il est nécessaire de rester à jeun 6 à 8 heures avant l’examen. Il faut également éviter tout exercice physique depuis la veille de l’examen (ce qui inclut la conduite automobile le jour-même de l’examen) pour ne pas stimuler la consommation de glucose par les fibres musculaires. Dans la plupart des cas, il n’est pas nécessaire d’arrêter ou de modifier son traitement médical. Dans certaines situations, il est demandé que la prise de médicament soit effectuée au plus tard 6 h avant l’examen. De plus, il convient de respecter un certain délai après une chimiothérapie (2 à 3 semaines), une radiothérapie (2 à 3 mois), une chirurgie (2 mois) et après l’injection de facteurs de croissance hématopoïétiques (1 semaine) avant l’examen TEP. En effet, ces traitements peuvent modifier la répartition du traceur au sein du corps. Le diabète qui entraine une augmentation de la concentration de glucose dans le sang peut modifier les résultats de la TEP, c’est pourquoi le patient doit signaler son diabète au praticien pour qu’il prenne les dispositions adéquates afin de le contrôler au mieux avant l'examen avec un objectif de glycémie à jeun quasi normale.
L’examen se déroule en deux temps. À son arrivée, le patient est installé sur un lit et doit se reposer. Un technicien spécialement formé injecte dans une veine du bras ou dans une perfusion posée au préalable, une dose de traceur radioactif (par exemple, le 18F-FDG) diluée dans une solution de sérum physiologique. Le patient reste au repos une heure au moins. Ce temps permet au produit de bien se répartir dans l’organisme et d’être capté par les tissus (comme les tumeurs).
À partir de l’injection, toutes les activités qui peuvent perturber la diffusion du traceur sont à éviter. Il faut rester le plus immobile possible (en évitant de bouger, de parler ou de mâcher un chewing-gum) afin de ne pas stimuler les muscles. De même, il est déconseillé de lire car cela fait travailler le cerveau et donc augmente la consommation de glucose, ce qui risque de modifier les résultats de l’examen. Avant de s’installer sur le lit d’examen de la machine TEP, le patient se rend aux toilettes afin de vider au maximum la vessie qui est la voie d'élimination normale du produit non fixé.
Lors de l’examen, le patient est allongé sur un lit qui se déplace à l’intérieur d’un anneau détecteur. Seule une partie du corps se trouve à l’intérieur de l’appareil. De ce fait, les patients claustrophobes ne ressentent en général aucune gêne particulière au cours de l'examen. De plus, la machine est silencieuse, contrairement à l'IRM. L’enregistrement des images dure de 20 à 40 minutes selon les machines ou l'indication de l'examen. Au total, le patient doit prévoir de rester dans le service environ 2 à 3 heures pour l’ensemble de la procédure. Un premier avis peut être donné par l’équipe médicale sur place mais le compte rendu détaillé de l’examen nécessite un délai plus long. Après l’examen, il est recommandé de bien boire afin d’éliminer le plus rapidement possible le traceur et ne pas se retenir avant d’uriner.
Il est possible qu'une injection de produit de contraste iodé soit réalisée au cours de l'examen en l'absence de contre-indication. Cette injection est utile au diagnostic avec un TEP couplé à un scanner multi-barrettes (meilleure qualité d'image). Ainsi, l'acquisition scanner ne sert pas seulement à établir une cartographie anatomique et une carte d'atténuation, mais également à réaliser un examen scanner (standard avec temps portal/parenchymateux) si le bilan nécessite de le faire. On évite une acquisition « en plus » optimisant la radioprotection du patient. Cette injection peut être réalisée pour comparer les endroits de fixation du FDG et les prises de contraste.
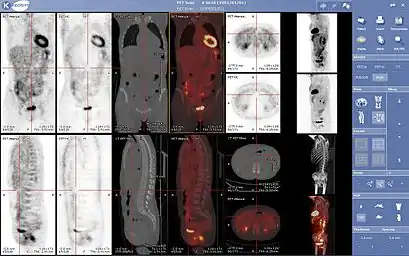
Applications
Historiquement, la TEP était utilisée surtout en recherche en neurologie. Aujourd'hui, la TEP utilise très majoritairement le FDG pour des examens en cancérologie. D'autres utilisations minoritaires du FDG incluent la recherche de pathologies inflammatoires ou infectieuses en utilisant la grande sensibilité de ce traceur, qui se concentre aussi dans les cellules inflammatoires activées. On l'utilise aussi pour étudier le métabolisme régional du cerveau ; c'est la technique de référence pour typer les démences (après une IRM).
Depuis 2010 plusieurs autres traceurs sont disponibles en TEP et disposent d'une autorisation de mise sur le marché (AMM) et d'indications reconnues :
- la F-choline (précurseur des membranes cellulaires) pour des indications autorisées dans le cancer prostatique et le carcinome hépatocelullaire ;
- le F-Na (ou NaF, fluorure de sodium) pour des tomoscintigraphies osseuses par émission de positons avec les mêmes indications que la scintigraphie osseuse classique mais avec les performances de la TEP ;
- la F-DOPA (fluoro-dihydroxyphénylalanine) pour des indications en cancérologie (certaines tumeurs endocrines) ou en neurologie (syndromes Parkinsoniens).
En 2014, de nouveaux traceurs TEP fluorés seront mis sur le marché pour détecter la présence de plaques amyloïdes. On pourra réaliser des TEP « amyloïdes » cérébrales pour mieux diagnostiquer certaines démences, en particulier la maladie d'Alzheimer. Le premier traceur sur le marché sera le florbétapir[Quand ?], deux ou trois autres suivront quelques mois plus tard.[réf. nécessaire]
Cancérologie
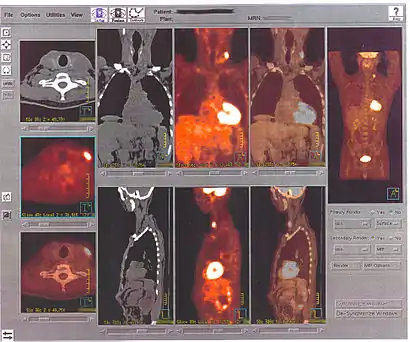
La TEP associée avec l'injection d'un traceur, ici le fluorodésoxyglucose (FDG, FDG-PET), est utilisée en cancérologie. Ce traceur est très proche chimiquement du glucose et va donc aller se fixer sur les tissus possédant un métabolisme élevé, notamment le cœur, le cerveau et les cellules tumorales. Les cellules tumorales malignes présentent un hypermétabolisme glucidique et une surexpression des transporteurs de glucose (GLUT-1). Le traceur (glucose transformé) ne peut pas subir d’hydrolyse (glycolyse) et il s’accumule donc dans les cellules décrites ci-dessus. C’est pour cela que la TEP est particulièrement indiquée dans la recherche des tumeurs malignes. Il existe aussi une accumulation du FDG dans les cellules inflammatoires activées (notamment les granulomes).
Cet examen se révèle utile à différentes étapes d’un cancer :
- lors du diagnostic pour l’identification d’une anomalie détectée lors d’un précédent examen (échographie, radiographie) et pour préciser sa nature (tumeur maligne ou bénigne) ;
- lors du bilan d’extension pour la recherche précise de l’étendue du cancer et d’éventuelles métastases ;
- lors du traitement, il permet de juger de l’efficacité d’une thérapie ;
- lors de la surveillance pour la détection d’une éventuelle récidive.
Les appareils les plus performants permettent actuellement de détecter des structures tumorales de petites tailles de l’ordre de 5 mm. La TEP est un outil puissant en oncologie, surpassant en sensibilité et en spécificité (toutes deux supérieures à 90 %) les examens de radiologie conventionnels (IRM, scanner X, échographie) dans de nombreux cancers. On peut citer par exemple, de façon non exhaustive, les lymphomes, les cancers et les nodules pulmonaires, les tumeurs des voies aérodigestives supérieures (bouche, larynx, pharynx), les localisations hépatiques des cancers digestifs, les mélanomes, les cancers du sein (en récidive) ou les cancers gynécologiques qui sont les principales indications de la TEP au FDG aujourd'hui[Quand ?].
Il est à noter que, du fait de la fixation physiologique du FDG sur le tissu cérébral, la TEP au FDG ne permet en général pas de rechercher les métastases cérébrales. En revanche, on peut utiliser cette caractéristique pour étudier le métabolisme cérébral régional ce qui est très utile en neurologie pour le diagnostic différentiel des démences.
Imagerie cérébrale TEP en neurologie
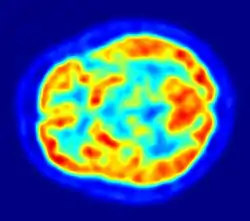
Le principe de l'utilisation de la TEP en imagerie cérébrale (neurologie et neurosciences cognitives) repose sur le lien entre activité des neurones dans une région donnée et la mesure de la radioactivité. Ce lien est indirect puisqu'au travers de la TEP, on mesure l'accumulation d'un radiotraceur. Le radiotraceur le plus couramment utilisé est le FDG qui mesure la consommation de glucose des neurones. En recherche on a aussi pu utiliser l'oxygène 15 dont l'accumulation est due à la réponse hémodynamique, c'est-à-dire une augmentation locale du débit sanguin cérébral qui se produit lorsqu'une région du cerveau voit son activité augmenter. L'imagerie cérébrale TEP reflète donc l'apport d'énergie régionale mais elle est très liée à l'activité cérébrale proprement dite.
L'avantage de la TEP en imagerie cérébrale tient aussi au fait qu'il est possible d'utiliser des radioligands (traceurs radioactifs) spécifiques de certains neurorécepteurs afin d'étudier des mécanismes très spécifiques de l'activité cérébrale. Par exemple, le raclopride, radiotraceur marqué au carbone 11 permet de visualiser l'activité synaptique liée au récepteur D2 de la dopamine. Cette méthodologie fait l'objet de développements dans le domaine de la neuropsychiatrie.
Aujourd'hui la TEP au FDG peut-être utilisée en routine clinique pour le diagnostic des maladies cérébrales dégénératives comme la maladie d'Alzheimer. De nombreuses études récentes ont démontré l’intérêt de l’utilisation de la TEP pour un diagnostic précoce de la maladie d’Alzheimer et pour le diagnostic différentiel d'une démence ou d'un déficit cognitif léger (MCI). On observe des réductions du métabolisme glucidique au niveau de régions spécifiques selon les pathologies en cause.
L'arrivée des traceurs de la plaque amyloïde va apporter une nouvelle information supplémentaire pour affiner de façon précoce ces diagnostics parfois difficiles.
TEP en cardiologie
En cardiologie, la principale indication de la TEP au FDG est la recherche de viabilité du muscle cardiaque après un infarctus[12] : on parle alors de myocarde « hibernant ». Cet examen permet de déterminer si les zones du cœur qui souffrent d’une diminution de leur fonction après un infarctus sont viables ou nécrotiques. Une diminution du métabolisme au FDG confirme que le tissu myocardique est non viable alors qu’un métabolisme normal indique sa viabilité et que la fonction cardiaque pourra être améliorée par le rétablissement d’un flux sanguin adéquat grâce à une intervention (pontage coronarien ou angioplastie).
Il existe d'autres traceurs utilisables en cardiologie, mais pas encore disponibles en dehors de la recherche en France en 2014. Notamment le rubidium (82Rb) et l'ammoniac (13NH3) ou l'eau (15OH2). Le 82Rb se comporte comme un analogue du potassium et permet d'étudier la perfusion myocardique avec une efficacité supérieure à celle de la technique « classique » qu'est la scintigraphie myocardique de perfusion. Le couplage de la TEP avec un scanner X (tomodensitométrie) permet une amélioration de la qualité des images par rapport à la scintigraphie (correction d'atténuation) et on peut réaliser une quantification absolue de la perfusion. De plus, cela laisse entrevoir la possibilité de coupler deux techniques en une : l'angioscanner des coronaires et la TEP de perfusion en un seul examen de moins de 30 minutes. La TEP permet aussi la quantification du débit sanguin myocardique et de la réserve de flux myocardique par l'intermédiaire d'une analyse compartimentale de la distribution des radiotraceurs dans le temps notamment avec la TEP à l'eau marquée[13]. Il est probable que, dans quelques années, ce traceur sera utilisé à côté des techniques de scintigraphie dites « classiques ».
Limites
La principale contrainte d’utilisation de la TEP est due à la courte demi-vie des isotopes radioactifs qui nécessitent donc la présence d’un cyclotron à proximité du centre d’examen. Néanmoins, le recours à une production d'isotope directement dans le service de médecine nucléaire par l'intermédiaire d'un générateur comme pour le rubidium 82 (82Sr/82Rb) ou le gallium 68 (68Ge/68Ga) permet de s'en affranchir.
Il existe un certain nombre de causes de faux positifs et de faux négatifs qui peuvent conduire à une mauvaise interprétation de l’examen. En cancérologie, les faux positifs (examen positif alors qu’absence d’anomalie) sont essentiellement dus à des causes inflammatoires (granulome, anthracose, chirurgie et radiothérapie récentes, fracture récente…) ou à des infections (pneumopathie, tuberculose, ostéomyélite…). Les faux négatifs (examen négatif alors que présence d’anomalies) sont essentiellement liés à la taille de la lésion (trop petite pour être détectée), à la localisation (proximité d’une région de fixation naturelle : cerveau, cœur, vessie…), à la nature de l’anomalie (certaines tumeurs présentent moins d’avidité au traceur : tumeurs mucineuses, certains adénocarcinomes…), à une glycémie élevée ou à une chimiothérapie trop récente.
Avenir de la TEP, R&D
L’évolution actuelle de la TEP passe par
- l'arrivée de nouveaux traceurs avec de nouvelles indications.
Dès 2014 arrivent les traceurs de la plaque amyloïde permettant de réaliser des TEP cérébrales en neurologie pour le diagnostic différentiel des démences.
On espère ensuite de nouvelles molécules pour la cancérologie et la cardiologie (F-MISO, FLT, FES, Rubidium, flurpiridaz…) pour de nouvelles applications « imageant » de nouveaux processus métaboliques[Lesquels ?] ; - l'évolution technique des machines ; les TEP couplées au scanner sont aujourd'hui[Quand ?] le standard, elles progressent en termes de rapidité, de sensibilité et de résolution ;
- un appareil « corps entier » (1er prototype attendu pour la fin 2018, capable de traiter de grandes masses de données)[14] ;
- une diminution des doses (jusqu'à 40 fois moins dans un projet de scanner "corps entier"[14] ;
- une baisse des coûts et des équipements combinant l’examen IRM et la TEP (pour des applications en cours d'évaluation).
Notes et références
- (en + fr) Commission Électrotechnique Internationale (IEC), International Electrotechnical Vocabulary (IEV) (lire en ligne), Voir Positon, Ref 393-11-08
- (en) W. H. Sweet, « The Uses of Nuclear Disintegration in the Diagnosis and Treatment of Brain Tumor », N Engl J Med, vol. 245, , p. 875-878 (DOI 10.1056/NEJM195112062452301, présentation en ligne).
- (en) G. L. Brownell et W. H. Sweet, « Localization of brain tumors with positron emitters », Nucleonics, vol. 11, , p. 40-45.
- (en) G. L. Brownell, C. A. Burnham, S. Wilensky, S. Aranow, H. Kazemi et D. Strieder, « New developments in positron scintigraphy and the application of cyclotron-produced positron emitters », Proceedings of the Symposium on Medical Radioisotope Scintigraphy, , p. 163-176.
- (en) T. Beyer, D. W. Townsend, T. Brun, P. E. Kinahan, M. Charron, R. Roddy, J. Jerin, J. Young, L. Byars et R. Nutt, « A combined PET/CT scanner for clinical oncology », J Nucl Med., vol. 41, no 8, , p. 1369-1379 (PMID 10945530).
- (en) P. J. Pichler, « Latest advances in molecular imaging instrumentation », J Nucl Med., vol. 49, no Suppl 2, , p. 5S–23S (DOI 10.2967/jnumed.108.045880, lire en ligne).
- (en) Hodolic M, Michaud L, Huchet V, Balogova S, Nataf V, Kerrou K, Vereb M, Fettich J, Talbot JN, « Consequence of the introduction of routine FCH PET/CT imaging for patients with prostate cancer: a dual centre survey », Radiol Oncol, vol. 48, no 1, , p. 20-8. (PMID 24587775, PMCID PMC3908843, DOI 10.2478/raon-2013-0049, lire en ligne [html]).
- (en) Lin CY, Chen JH, Liang JA, Lin CC, Jeng LB, Kao CH, « 18F-FDG PET or PET/CT for detecting extrahepatic metastases or recurrent hepatocellular carcinoma: a systematic review and meta-analysis », Eur J Radiol, vol. 81, no 9, , p. 2417-22. (PMID 21899970, DOI 10.1016/j.ejrad.2011.08.004).
- (en) Grant FD, Fahey FH, Packard AB, Davis RT, Alavi A, Treves ST, « Skeletal PET with 18F-fluoride: applying new technology to an old tracer », J Nucl Med, vol. 49, no 1, , p. 68-78. (PMID 18077529, lire en ligne [html]).
- (en) Drubach LA, Johnston PR, Newton AW, Perez-Rossello JM, Grant FD, Kleinman PK, « Skeletal trauma in child abuse: detection with 18F-NaF PET », Radiology, vol. 255, no 1, , p. 173-81. (PMID 20308455, DOI 10.1148/radiol.09091368).
- (en) Burn DJ, Sawle GV, Brooks DJ, « Differential diagnosis of Parkinson's disease, multiple system atrophy, and Steele-Richardson-Olszewski syndrome: discriminant analysis of striatal 18F-dopa PET data », J Neurol Neurosurg Psychiatry, vol. 57, no 3, , p. 278-84. (PMID 8158173, PMCID PMC1072814, lire en ligne [PDF]).
- (en) F. M. Bengel, T. Higuchi, M. S. Javadi et R. Lautamäki, « Cardiac positron emission tomography », J Am Coll Cardiol., vol. 54, , p. 1-15 (PMID 19555834, DOI 10.1016/j.jacc.2009.02.065, présentation en ligne, lire en ligne).
- Stéphane Tuffier, Damien Legallois, Annette Belin et Michael Joubert, « Assessment of endothelial function and myocardial flow reserve using (15)O-water PET without attenuation correction », European Journal of Nuclear Medicine and Molecular Imaging, vol. 43, no 2, , p. 288–295 (ISSN 1619-7089, PMID 26280980, DOI 10.1007/s00259-015-3163-x, lire en ligne, consulté le )
- Wessel L (2017) World’s first full-body PET scanner could aid drug development, monitor environmental toxins, 17 mars 2017.