Tricyclobutabenzène
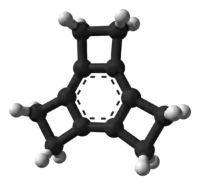
Le tricyclobutabenzène est un hydrocarbure aromatique tétracyclique qui consiste en un noyau benzénique entouré de trois cycles cyclobutane. Ce composé et d'autres apparentés sont étudiés au laboratoire du fait qu'ils ont souvent une conformation inusuelle et en raison de leur réactivité inhabituelle. Le tricyclobutabenzène est un isomère du [6]radialène et l'interconversion de l'un en l'autre est possible.
| Tricyclobutabenzène | |
| |
| Identification | |
|---|---|
| Synonymes |
tétracyclo[8.2.0.02,5.06,9]dodéca-1,5,9-triène |
| No CAS | |
| PubChem | 143698 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C12H12 [Isomères] |
| Masse molaire[1] | 156,223 7 ± 0,010 4 g/mol C 92,26 %, H 7,74 %, |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 8,15 ± 0,05 eV[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Le tricyclobutabenzène est stable jusqu'à 250 °C.
Synthèse
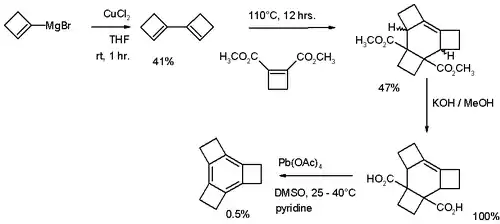
Le tricyclobutabenzène (C12H12) fut synthétisé pour la première fois en 1979[3] via un protocole décrit dans le schéma ci-dessous :
Une réaction de couplage du cyclobutène via un réactif de Grignard est suivie d'une réaction de Diels-Alder avec le cyclobutène-1,2-dicarboxylate de diméthyle puis les esters sont hydrolysés en leur forme acide carboxylique par de l'hydroxyde de potassium (KOH) dans le méthanol. Une décarboxylation et une aromatisation sont réalisées avec le tétraacétate de plomb et permettent d'obtenir le tricyclobutabenzène.
Dérivés
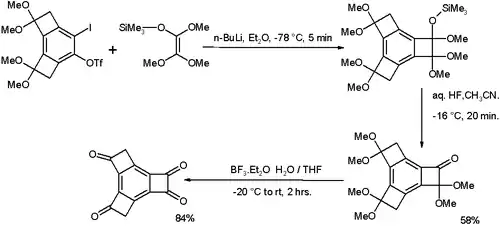
Un dérivé polyoxygéné du tricyclobutabenzène avec une liaison carbone-carbone connectant deux groupes carbonyle d'une longueur exceptionnelle de 160 pm a été synthétisé[4] suivant le schéma ci-dessous:
L'étape clé de cette synthèse est la cycloaddition 2+2 entre un aryne issu du iodotriflate par action du n-butyllithium et le di-cétal triméthyle silyle de l'éthènedione. Le tétra-cétal silylé obtenu est alors converti en cétone par l'acide fluorhydrique dans l'acétonitrile et les autres groupes cétal sont traités avec du trifluorure de bore.
Une liaison ordinaire entre deux atomes de carbone sp2 mesure 148 pm et par comparaison, la liaison C-C entre les deux carbonyles de l'isatine fait 154 pm. D'autre part, aucun changement n'est enregistré dans les longueurs des liaisons aromatiques.
Des réactions chimiques similaires ont donné l'hexacétone, hexaoxotricyclobutabenzène (C12O6) qui est un oxyde de carbone[5].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Tricyclobutabenzene » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- par UPS in Heilbronner, E.; Kovac, B.; Nutakul, W.; Taggart, A.D.; Thummel, R.P., Trisannelated benzenes. Preparation, properties, and photoelectron spectra, J. Org. Chem., 1981, vol. 46, p. 5279.
- Wutichai Nutakul, Randolph P. Thummel, Austin D. Taggart ,Tricyclobutabenzene, J. Am. Chem. Soc., 1979, vol. 101(3), pp. 770-771. DOI:10.1021/ja00497a064.
- Toshiyuki Hamura, Yousuke Ibusuki, Hidehiro Uekusa, Takashi Matsumoto, and Keisuke Suzuki, Poly-Oxygenated Tricyclobutabenzenes via Repeated [2 + 2] Cycloaddition of Benzyne and Ketene Silyl Acetal, J. Am. Chem. Soc., 2006, vol. 128(11), pp. 3534-3535. DOI:10.1021/ja0602647.
- Toshiyuki Hamura, Yousuke Ibusuki, Hidehiro Uekusa, Takashi Matsumoto, Jay S. Siegel, Kim K. Baldridge, and Keisuke Suzuki, Dodecamethoxy- and Hexaoxotricyclobutabenzene: Synthesis and Characterization, J. Am. Chem. Soc., 2006, vol. 128(31), pp. 10032-10033. DOI:10.1021/ja064063e.
- Portail de la chimie