Coronavirus félin
Coronavirus

- Espèce : Alphacoronavirus 1
- Coronavirus de la gastro-entérite transmissible porcine (TGEV, porc)
- Coronavirus félin (FCoV, chat)
- Coronavirus félin (FECV et FIPV), type I
- Coronavirus félin (FECV et FIPV), type II
- Coronavirus canin (CCoV, chien)
Le coronavirus félin FCoV est un virus à ARN qui infecte le chat. Ce virus présente 2 formes :
- une forme entérique (intestinale) FECV (Feline Enteric CoronaVirus) ;
- une forme responsable de la péritonite infectieuse féline FIPV (Feline Infectious Peritonitis Virus).
Il fait partie du genre Alphacoronavirus, comme le coronavirus de la gastro-entérite porcine (TGEV), le coronavirus canin (CCoV) et certains coronavirus humains (HCoV-229E, HCoV-NL63).
Les coronaviroses du chat
La forme digestive à FECV
Le virus FECV est responsable d’une infection des cellules épithéliales digestives du chat (les cellules du revêtement intestinal : voir aussi entérocyte, bordure en brosse, microvillosités, villosités intestinales, etc.) : cette infection présente peu de signes, elle est le plus souvent chronique. Le virus est alors excrété dans les selles de l'animal porteur sain. Ce portage peut être mis en évidence par prélèvement rectal (écouvillonnage) et détection par PCR : Polymerase Chain Reaction ou Réaction en chaîne par polymérase.
Les chats vivant en groupe se contaminent les uns les autres lors de leurs passages au bac à litière. Certains chats sont résistants au virus et n'auront aucune infection (pas de portage digestif). Les autres vont être porteurs du FECV un certain temps. Ils peuvent guérir spontanément, mais l'immunité acquise étant courte, ils risquent de se recontaminer au bout de quelques semaines s'ils vivent dans un groupe où persistent des excréteurs (porteurs sains). Certains chats ne guérissent jamais et restent excréteurs définitivement.
Passage du FECV au FIPV
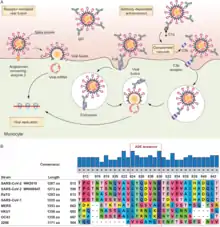
Une FIPV est une réinfection aggravée du FCoV. Le FCoV a normalement un tropisme pour les cellules intestinales et provoque une FECV (Feline Enteric CoronaVirus), une maladie relativement bégnine. En présence d'anticorps facilitants, le FECV se transforme en péritonite infectieuse féline (PIF) ou FIPV en anglais (Feline Infectious Peritonitis Virus). La PIF est une maladie mortelle.
En temps normal, les anticorps contre la protéine S ou spike du virus neutralisent le FCoV. Une fois opsonisés (c'est-à-dire « enrobés ») par des anticorps, les résidus de virus sont gobés par des globules blancs (les macrophages) via les récepteurs Fc. Un récepteur Fc est une protéine transmembranaire présente à la surface des globules blancs.
Les anticorps ciblant la séquence d’acides aminés IVGAITAVN du FCoV, située aux codons 767-776 de la protéine S, ne sont pas neutralisants mais facilitants. Une fois opsonisés par des anticorps facilitants, les FCoV non neutralisés sont absorbés par les globules blancs. Le problème est que le FCoV est un coronavirus capable de se reproduire dans les macrophages. En présence d’anticorps facilitants, le FCoV perd son tropisme intestinal et développe un tropisme pour les macrophages où il se réplique activement. Ce qui dégénère en péritonite infectieuse féline (PIF)[1],[2],[3],[4].
Pour contracter une FIPV, il faut que le chat soit réinfecté par le FCoV ou qu'il ait été vacciné contre le FCoV avec un virus inactivé ou un vaccin ciblant la seule protéine S. Si le taux d'anticorps est très élevé, les anticorps sont neutralisants. Lorsque le taux d'anticorps baisse, la balance entre anticorps neutralisants et facilitants s'inverse, et le chat risque une réinfection aggravée[5].
À l'état naturel, le chat est un animal solitaire et partage peu ses aires de vie (aire de chasse, aire de repos, aire de défécation...). A contrario, le chat domestique qui vit en groupe est dans une situation de grand risque épidémiologique car en passant au bac à litière, les chats se recontaminent en permanence. A noter que le chat peut contracter une FIPV après avoir contracté le coronavirus canin (CCoV)[5]. Les anticorps facilitants du CCoV correspondent à la séquence IVGAMTSIN située aux codons 753-762 de la protéine S. La séquence IVGAMTSIN du CCoV reconnaît la séquence IVGAITAVN du FCoV, et génère donc des anticorps facilitants chez le chat.
La péritonite infectieuse féline, FIPV
La surpopulation et le risque de mutation FECV en FIPV sont des facteurs de risque de voir se développer des cas de péritonite infectieuse féline (PIF) dans un groupe de chat. Cependant, la PIF va surtout se développer chez les sujets dont l'immunité est plus faible (jeunes chatons, vieux chats, immunodépression de cause virale - FIV (virus de l'immunodéficience féline) et/ou FELV (virus de la leucose féline) - stress notamment stress de la séparation et de l'adoption).
L’infection des macrophages par le FIPV est alors responsable d’une vascularite granulomateuse mortelle, la PIF (cf granulome).
La PIF surviendrait donc en présence de 2 facteurs : (la Mutation) ET (le Terrain)
- la mutation du virus : facteur virologique lié au nombre de réplication ;
- le terrain du chat : lié à son âge, à sa génétique, à son niveau de stress, ce qui conditionne son statut immunitaire et donc sa capacité (ou pas) à contenir l'infection à un bas niveau.
On distingue 2 formes cliniques de PIF (péritonite infectieuse féline):
- une forme dite humide avec épanchement liquidien péritonéal (= ascite), pleural et péricardiques,
- et une forme dite sèche.
L'issue est généralement fatale, hormis quelques cas rapportés de guérison par l'interféron oméga félin.
Aspects moléculaires de la fusion du virus à la cellule hôte
Les 2 formes de FCoV, entérique (FECV) et de la PIF (FIPV) présentent toutes deux, 2 sérotypes différents (présentant des antigènes différents qui entrainent la production de différents types d’anticorps : sérogroupage).
FCoV de sérotype I (ou type I) sont les plus fréquents : 80 % des infections sont dues à FECV de type I pouvant muter et donner FIPV de type I.
La culture des FCoV de sérotype I est difficile, les études sur ce sérotype sont donc peu nombreuses.
FCoV de sérotype II (ou type II) sont moins fréquents : FECV de type II pouvant muter et donner FIPV de type II.
Le type II est un recombinant du type I avec remplacement des gènes des spikes du FCoV (protéine S) par le gène des spikes du coronavirus entérique canine (CCoV)[6].
La culture de ce type II étant plus facile, nous disposons de nombreuses études sur ce type II (pourtant le moins fréquent).
La fusion
Les coronavirus sont des virus à ARN ; les coronavirus du groupe 1 sont recouverts de plusieurs types de protéines dont les protéines S (ou E2) formant une couronne de spicules à la surface du virus. Les coronavirus tirent leur nom de l'observation, au microscope électronique, de cette couronne de spicules.
Ces spicules des Cov (du groupe 1 et de sérotype II) sont responsables du pouvoir d’infection du virus en se liant à un récepteur membranaire de la cellule hôte : la Féline Aminopeptidase N (fAPN)[7],[8],[9].
Le récepteur viral : l'aminopeptidase N (APN)
fAPN (féline), hAPN (humaine) et pAPN (porcine) se différencient par certaines zones de N-glycosylation, ceci conditionne ce qui suit :
- toutes les souches de coronavirus du groupe 1 étudiées (félin, humain et porcin) peuvent se lier à l'aminopeptidase N féline fAPN mais :
- le coronavirus humain peut se lier à l'APN humaine (hAPN) mais pas à la forme porcine du récepteur (pAPN),
- le coronavirus porcin peut se lier à l'APN porcin (pAPN) mais pas à la forme humaine du récepteur (hAPN).
À l'échelle cellulaire ceci explique pourquoi le niveau de glycosylation du APN des entérocytes est important pour la liaison du virus au récepteur[10],[11].
Concernant les spicules viraux
Les spicules du FECV ont une affinité pour les fAPN des entérocytes, alors que les spicules homologues mutant du FIPV ont une forte affinité pour les macrophages.
Lors de la réplication des protéines virales, les spicules subissent une maturation, dans l’appareil de Golgi de la cellule hôte, par glycosylation de molécules de mannose.
Cette étape de manno-glycosylation des protéines S est indispensable à l’acquisition du pouvoir infectant des coronavirus[12],[13].
Le récepteur ?
En 2007, il est établi que le sérotype I du FCoV n'utilise pas la fAPN comme récepteur. Le récepteur des FCoV type I n'est toujours pas connu[14].
Les récepteurs connus
- Le CoV humain du SRAS, SARS-CoV, se lie à l'enzyme de conversion de l'angiotensine ACE. Cette ACE est également nommée L-SIGN.
- Les Coronavirus se lient aux macrophages par la voie "DC-SIGN". DC-Sign est un acronyme pour "Dendritic Cell" (c'est-à-dire macrophage) et pour "SIGNalisation". Il s'agit d'un récepteur au mannose impliqué dans la pathogénie de plusieurs virus : hépatite C[15], hépatite B, HIV[16], HTLV[17]...
Au total : ACE et DC-SIGN sont deux récepteurs trans-membranaires (des récepteurs au mannose) où peuvent se fixer les lectines végétales de type C liant du mannose. DC-SIGN et ACE servent de récepteurs aux rétrovirus[18].
- L'aminopeptidase N a les mêmes capacités à interagir avec les lectines végétales de type C liant le mannose et sert également de récepteur à des rétrovirus.
- L'enzyme de conversion ACE, l'aminopetidase A et l'aminopeptidase N ont des actions en cascade dans le système Rénine-Angiotensine-Aldostérone , suggérant une origine phylogénétique commune entre ces molécules.
- Des études poussées ont montré une grande homologie entre l'Aminopeptidase N et l'enzyme de conversion de l'angiotensine[19].
Conclusion : le récepteur du sérotype I du FCoV
Il est probable que le récepteur inconnu du FCoV de sérotype I soit également de cette famille de récepteur inter-agissant avec les lectines liant le mannose.
Remarques générales sur les lectines
Une lectine est une glyco-protéine : une protéine "décorée" de différents sucres. Les premières lectines découvertes appartenaient au règne animal. Plus tard ont été découvertes les lectines d'origine végétale (Phytohémagglutinines des légumineuse notamment).
Classification des Lectines :[20],[21]
- Lectines animales de type C
- Lectines animales de type S
- Lectines végétales de type C
- Lectines végétales de type S
Les lectines de types C vont être liée à différents sucres dont certaines au mannose.
Il apparait que l'affinité de liaison des lectines végétales liant le mannose définit "un processus osidique de reconnaissance particulier" (commun et répandu)[22],[23].
À partir de cette famille de lectines de type C liant le mannose, on distingue le groupe fonctionnel de récepteurs membranaires pouvant s'y lier (des récepteurs au mannose). C'est à cette famille qu'appartiennent les récepteurs déjà connus des coronavirus.
Rôle du mucus : le glycocalix - Interactions entre les virus et l'Acide sialique
L'acide sialique est un sucre complexe composant du glycocalix, c'est-à-dire du mucus protégeant les muqueuses notamment digestives (mais aussi respiratoires...). L'acide sialique est un facteur important facilitant la fusion de certains virus à la cellule hôte. Ceci est très bien détaillé pour la grippe.
De nombreuses données montrent également que des processus utilisant l'acide sialique participent directement à l'interaction avec des récepteurs des lectines[24].
Au sujet du coronavirus entérique porcin (du groupe 1), il vient d'être démontrer que la fusion à l'entérocyte se faisait par la liaison à l'APN en présence d'acide sialique, les 2 éléments étant nécessaire[25],[26],[27].
Chez le chat il semble bien que l'infection au FCoV soit liée (dépendante) à l'acide sialique[28],[29],[30].
Inhibition de la fusion : quelques études (in vitro)
De nouvelles stratégies anti-virales ayant pour cible ce processus de reconnaissance lié au mannose (common sugar recognition process) sont en cours de développement[31]. Ainsi pour inhiber la fusion du virus à la cellule, plusieurs solutions sont possibles :
- déglycosyler les spikes viraux,
- modifier le niveau de glycosylation du récepteur (fAPN),
- entrer en compétition avec les spikes, grâce à des molécules qui vont se lier aux récpeteur (occupation du site de liaison),
- inhiber la liaison dépendant de l'acide sialique du mucus.
- Expérimentalement la liaison du FIPV (spike) aux macrophages (fAPN) est fortement inhibé par le(s) mannane(s) (sucre complexe composé de plusieurs molécules de mannose - voire aussi polyoside, glycan, manno-oligosaccharide, MOS, oligosaccharide) : effet de compétition avec la fAPN[13]. L'inhibition est beaucoup moins importante avec le mannose qu'avec les oligosaccharides de mannose (mannanes).
- Les molécules inhibant la glycosylation des spikes (Monensine, Tunicamycine …) diminuent ou annulent le pouvoir infestant du CoV (action au niveau de l'appareil de Golgi): non glycosylation des spikes. Il en est de même pour les mannanases (ou mannosidase = enzymes) déglycosylant le mannose les spikes.
- La mise en compétition des spikes par d’autres molécules ayant une affinité pour fAPN diminuent ou annulent le pouvoir infestant du CoV :
- Lectine liée au mannose (Mannan binding Lectin) :
- Lectine végétale (plant Lectin)[32]
- Allium agglutinines
- Urtica dioica agglutinines[33]
- Concanavaline A
- Lectine animale et humorale (humoral lectin)
- Ficoline
- Collectines .../...
- Manno-Oligosaccharides (MOS) :
en quantité abondante dans les parois de levures (saccharomyces cerevisiae = levure de bière ou levure de boulanger)
- Pradimicine A (un antibiotique non-peptidique liant du mannose)[33]
L'inhibition de l'acide sialique diminue le pouvoir infectant des coronavirus aviaires et humains[34].
Chatons protégés en période d'allaitement
Les chatons nés d'une mère excrétant du FECV ne développent pas d'infection lors de leurs premières semaines de vie (jusqu'au sevrage). Le Dr Addie[35] préconise un sevrage précoce et une séparation des chatons de leur mère avant que ces derniers ne perdent cette résistance et ne se contaminent (vers 5 à 6 semaines). Les chatons échappent alors à la contamination (mais sont privés du contact de leur mère durant leur 2e mois de vie : importante période éducative).
Cette absence d'infection des nouveau-nés est si efficace qu'elle donne à réfléchir : la protection est-elle uniquement transmise par la mère ou une résistance due à un facteur dépendant des chatons existe-t-elle ?
Facteurs de protection du colostrum et du lait?
Le colostrum et le lait de chatte contiennent 22 g de résidu sec pour 100 ml de lait[36].
Les immunoglobulines du colostrum et du lait
Chez les primates (dont l'homme), les anticorps (ou immunoglobulines) sont transmis lors de la grossesse par le placenta.
Chez le chat (et le chien) la placentation est différente et le passage d'anticorps pendant la grossesse est minime. C'est le colostrum de la chatte qui va transmettre les anticorps aux nouveau-nés. Elle confère à ses chatons les anticorps qu'elle possède. Il existe un phénomène particulier dit « perméabilité intestinale » permettant au chaton d'absorber les anticorps du colostrum. Pendant 16 à 24 heures après la naissance, le taux d'enzymes digestives digérant les protéines (dont les anticorps) est faible et les entérocytes permettent directement le passage des anticorps maternels dans le sang du chaton. Puis ce phénomène cesse et les anticorps absorbés seront alors digérés ou exerceront une action locale.
Il est communément admis que cette protection passive anti-coronavirus est supportée par les immunoglobulines maternelles (les anticorps) transmises par le colostrum et le lait de la chatte., mais plusieurs questions se posent :
- Si cette protection n'est supportée que par les anticorps maternels, alors pourquoi ces mêmes anticorps ne protègent-ils pas mieux la mère ?
- Les chatons privés du colostrum pendant leur premier jour de vie n'ont quasiment pas de passage d'anticorps maternels dans leur sang (c'est ce que l'on fait à des chatons nés d'une mère de groupe sanguin B pour prévenir la maladie hémolytique du nouveau-né. Pourquoi n'est il pas décrit d'infection à FCoV chez ces chatons dès leurs premiers jours de vie ?
Les autres actifs "classiques" du colostrum et du lait
D’autres molécules du colostrum et du lait de la chatte, pourraient supporter également cette protection :
- La Lactoferrine : elle présente de nombreuses propriétés qui en font un très bon candidat à cette protection anti-coronavirus :
- Elle a une activité anti-virale connue contre des virus utilisant "la voie du mannose" comme le HIV, l'hépatite C, mais aussi contre le rotavirus, le calicivrus, l'herpès...
- Comme les CoV du groupe I, elle se lie aux APN[37],
- Elle se lie aux enzymes de conversions de l'angiotensine[38],
- Elle se lie au récepteur au mannose des macrophages (le DC-sign)[39], et inhibe efficacement la liaison du HIV au macrophage (Schéma ),
- La lactoferrine présente une affinité de liaison pour des lectines[40],
- Son activité anti-virale est dépendante de l'acide sialique.
- La Lactoferrine semble chez la femelle du rat remplacé par la transferrine[41]
La structure de la chaîne glyco-polypeptidique de la lactoferrine (bovine) connue : elle se compose d'un polypeptide de 689 acides aminés, chaîne à laquelle se complexent des glycan riche en mannose (Pierce et al., 1991). Sa concentration dans le colostrum humain est de 5,3 +/- 1,9 mg/ml et de 1 mg/ml après 1 mois de lactation. Sa concentration est plus basse dans le lait de vache (1,5 mg/ml pour le colostrum et moins dans le lait)[42]. Il est déterminé que son taux diminue au cours de la lactation de la chatte[43]. Un chaton âgé d'une semaine de 150 g tétant 7 repas de 5 ml pourrait ingérer 175 mg de lactoferrine / jour.
- Lactoperoxidase,
- Lysozyme,
- Polypeptide riche en Proline – PRP,
- alpha-lactalbumine,
- .../...
Les autres composants du colostrum et du lait
Le colostrum et le lait maternel contiennent également :
- différents types d'oligosaccharides (glycans) responsables d’une protection anti-virale[44], (majoritairement des oligosaccharides fucosylés (fucosyloligosaccharides), c'est-à-dire des polymères de fucose, un sucre à 6 carbones). Certains de ces glycans (dont le sucre Lewis X) sont donnés pour responsables de la protection anti-virale des nouveau-nés humains allaités par des mères séropositives HIV. La majorité des nourrissons allaités ne sont pas infectés par le VIH, malgré une exposition continue au virus par le biais de leur lait maternel pendant de nombreux mois. La gp 120 du VIH-1 est une glycoprotéine de surface qui se fixe aux macrophages par les DC-SIGN, en utilisant cette fameuse voie du mannose. Il est démontré que ces oligosaccharides du lait maternel inhibe de 80 % la fixation du HIV aux DC-SIGN[45].
- des composés glycosylés ayant déjà été étudiée (chez l'homme) pour leur rôle anti-viral[46], notamment : une glycoprotéine (la lactadherine), un glycopeptide mannosylé (glycosylé avec du mannose), un glycosaminoglycane, une mucine, un ganglioside (GM1), un glycosphingolipid (Gb3)...
- des cellules immunitaires maternelles,
- des cytokines (interferon...); dont le rôle par voie oro-mucosale semble très important[47],[48],[49].
- de l'Acide sialique (AS). L'AS du colostrum et du lait n'est pas libre mais lié à d'autres molécules dites "sialocionguées" (oligosaccharides, glycoprotéines...). Au cours de la lactation, il apparait que le taux d'oligosaccharides sialoconjugés diminue alors que le taux de glycoprotéines sialoconjugées augmente[50]. Ces sialoconjugués jouent un rôle d'inhibiteur de fusion des agents infectieux. La lactoferrine est inhibée par l'AS libre[51], l'absence d'AS libre dans le lait n'inhibe donc pas l'effet anti-viral de la lactoferrine du lait.
- des lectines liant le mannose (MBL : mannan binding lectin)[52].
- .../...
Facteurs de résistance des chatons ?
D'autres hypothèses pourraient participer à cette résistance des chatons au FCoV.
- Dans les premières semaines de vie, les ANP pourraient être immatures car hautement manno-glycosylée[53]. Les spikes du CoV ne pourraient alors pas s'y lier.
- Des facteurs du lait maternel pourraient inhiber la synthèse de l'fANP par les entérocytes, comme cela est déjà décrit avec le fructose ou le saccharose[54],[55],[56].
Voir aussi
Notes et références
- (en) W. Huisman, « Vaccine-induced enhancement of viral infections », Vaccine, (lire en ligne, consulté le ).
- (en) Niels C. Pedersen, « An update on feline infectious peritonitis: Virology and immunopathogenesis », The Veterinary Journal, (lire en ligne, consulté le ).
- (en) Wen Shi Lee, « Antibody-dependent enhancement and SARS-CoV-2 vaccines and therapies », Nature Microbiology, (lire en ligne, consulté le ).
- Acquisition of macrophage tropism during the pathogenesis of feline infectious peritonitis is determined by mutations in the feline coronavirus spike protein
- (en) Fred W. Scott, « Evaluation of Risks and Benefits Associated with Vaccination against Coronavirus Infections in Cats », Adv Vet Med., (lire en ligne, consulté le ).
- [https://www.ncbi.nlm.nih.gov/pubmed/9557750?ordinalpos=2&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumFeline+coronavirus+type+II+strains+79-1683+and+79-1146+originate+from+a+double+recombination+between+feline+coronavirus+type+I+and+canine+coronavirus.]
- Feline aminopeptidase N is a receptor for all group I coronaviruses
- [https://www.ncbi.nlm.nih.gov/pubmed/8970993?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_Discovery_RA&linkpos=1&log$=relatedarticles&logdbfrom=pubmedFeline+aminopeptidase+N+serves+as+a+receptor+for+feline,+canine,+porcine,+and+human+coronaviruses+in+serogroup+I]
- [https://www.ncbi.nlm.nih.gov/pubmed/9192004?ordinalpos=13&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumVirus-receptor+interactions+in+the+enteric+tract.+Virus-receptor+interactions]
- [http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=11559807Molecular+determinants+of+species+specificity+in+the+coronavirus+receptor+aminopeptidase+N+(CD13):+influence+of+N-linked+glycosylation.]
- [https://www.ncbi.nlm.nih.gov/pubmed/19057868?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumIdentification+of+sugar+residues+involved+in+the+binding+of+TGEV+to+porcine+brush+border+membranes]
- [https://www.ncbi.nlm.nih.gov/pubmed/16254347?ordinalpos=6&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumAcquisition+of+macrophage+tropism+during+the+pathogenesis+of+feline+infectious+peritonitis+is+determined+by+mutations+in+the+feline+coronavirus+spike+protein.]
- [https://www.ncbi.nlm.nih.gov/pubmed/18799586?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumUtilization+of+DC-SIGN+for+entry+of+feline+coronaviruses+into+host+cells.]
- Type I feline coronavirus spike glycoprotein fails to recognize aminopeptidase N as a functional receptor on feline cell lines
- [https://www.ncbi.nlm.nih.gov/pubmed/17498767?ordinalpos=8&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumEntry+of+hepatitis+C+virus+and+human+immunodeficiency+virus+is+selectively+inhibited+by+carbohydrate-binding+agents+but+not+by+polyanions.]
- [https://www.ncbi.nlm.nih.gov/pubmed/12797442?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_Discovery_RA&linkpos=5&log$=relatedreviews&logdbfrom=pubmedDC-SIGN:+a+novel+HIV+receptor+on+DCs+that+mediates+HIV-1+transmission.]
- [http://aac.asm.org/cgi/content/full/52/8/2771?view=long&pmid=18505856Inhibition+of+Cell-to-Cell+Transmission+of+Human+T-Cell+Lymphotropic+Virus+Type+1+In+Vitro+by+Carbohydrate-Binding+Agents]
- [https://www.ncbi.nlm.nih.gov/pubmed/17502670?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_Discovery_RA&linkpos=4&log$=relatedreviews&logdbfrom=pubmedThe+C+type+lectins+DC-SIGN+and+L-SIGN:+receptors+for+viral+glycoproteins.]
- [http://cat.inist.fr/?aModele=afficheN&cpsidt=163816Analyse+structurale+du+site+actif+de+trois+métallopeptidases+à+zinc:+Endopeptidase+Neutre-24.+II,+Aminopeptidase+N+et+Enzyme+de+Conversion+de+l'Angiotensine]
- [http://www.jbc.org/cgi/content/full/282/5/2753#TOPLectins:+Carbohydrate-specific+Reagents+and+Biological+Recognition+Molecules]
- [http://www.jbc.org/cgi/reprint/263/20/9557?ijkey=d3b3879115ad24240d8f0b8eabf1e8e0793959bb&keytype2=tf_ipsecshaTwo+distinct+classes+of+carbohydrate+recognition+domains+in+animal+lectins]
- [https://www.ncbi.nlm.nih.gov/pubmed/9433125?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_Discovery_RA&linkpos=4&log$=relatedreviews&logdbfrom=pubmedLectin-carbohydrate+interactions:+different+folds,+common+recognition+principles.]
- [https://www.ncbi.nlm.nih.gov/pubmed/11522393?ordinalpos=5&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumMannose-binding+plant+lectins:+different+structural+scaffolds+for+a+common+sugar-recognition+process.]
- [https://www.ncbi.nlm.nih.gov/pubmed/16596337?ordinalpos=38&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumSialic+acid-specific+lectins:+occurrence,+specificity+and+function.]
- [https://www.ncbi.nlm.nih.gov/pubmed/12021336?ordinalpos=7&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumBinding+of+transmissible+gastroenteritis+coronavirus+to+cell+surface+sialoglycoproteins.]
- [https://www.ncbi.nlm.nih.gov/pubmed/19057868?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumIdentification+of+sugar+residues+involved+in+the+binding+of+TGEV+to+porcine+brush+border+membranes.]
- [https://www.ncbi.nlm.nih.gov/pubmed/14557669?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_Discovery_RA&linkpos=1&log$=relatedarticles&logdbfrom=pubmedBinding+of+transmissible+gastroenteritis+coronavirus+to+brush+border+membrane+sialoglycoproteins.]
- [https://www.ncbi.nlm.nih.gov/pubmed/18701332?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumAssociation+between+faecal+shedding+of+feline+coronavirus+and+serum+alpha1-acid+glycoprotein+sialylation.]
- [https://www.ncbi.nlm.nih.gov/pubmed/17344083?ordinalpos=3&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumSerum+alpha1-acid+glycoprotein+(AGP)+concentration+in+non-symptomatic+cats+with+feline+coronavirus+(FCoV)+infection.]
- [https://www.ncbi.nlm.nih.gov/pubmed/19436584?ordinalpos=11&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumTotal+sialic+acid:+an+acute+phase+reactant+in+cats+with+a+possible+role+in+feline+coronavirus+infection.]
- [https://www.ncbi.nlm.nih.gov/pubmed/17632570?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_Discovery_RA&linkpos=5&log$=relatedreviews&logdbfrom=pubmedTargeting+the+glycans+of+glycoproteins:+a+novel+paradigm+for+antiviral+therapy.]
- [https://www.ncbi.nlm.nih.gov/pubmed/17428553?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_Discovery_RA&linkpos=2&log$=relatedarticles&logdbfrom=pubmedPlant+lectins+are+potent+inhibitors+of+coronaviruses+by+interfering+with+two+targets+in+the+viral+replication+cycle.]
- [https://www.ncbi.nlm.nih.gov/pubmed/17704516?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumThe+carbohydrate-binding+plant+lectins+and+the+non-peptidic+antibiotic+pradimicin+A+target+the+glycans+of+the+coronavirus+envelope+glycoproteins.]
- [https://www.ncbi.nlm.nih.gov/pubmed/18396435?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumInfection+of+the+tracheal+epithelium+by+infectious+bronchitis+virus+is+sialic+acid+dependent.]
- (en) « Cats and Feline Infectious Peritonitis », sur Dr Addie (consulté le ).
- [http://jn.nutrition.org/cgi/content/full/128/12/2618SInvestigations+on+Milk+Composition+and+Milk+Yield+in+Queens]
- [https://www.ncbi.nlm.nih.gov/pubmed/8767485?ordinalpos=4&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumRecognition+of+lactoferrin+and+aminopeptidase+M-modified+lactoferrin+by+the+liver:+involvement+of+the+remnant+receptor.]
- [https://www.ncbi.nlm.nih.gov/pubmed/16848512?ordinalpos=4&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumLactoferricin-related+peptides+with+inhibitory+effects+on+ACE-dependent+vasoconstriction.]
- [https://www.ncbi.nlm.nih.gov/pubmed/15709021?ordinalpos=3&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumLactoferrin+prevents+dendritic+cell-mediated+human+immunodeficiency+virus+type+1+transmission+by+blocking+the+DC-SIGN--gp120+interaction.]
- [https://www.ncbi.nlm.nih.gov/pubmed/18670097?ordinalpos=6&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumRecombinant+human+intelectin+binds+bovine+lactoferrin+and+its+peptides.]
- Pierce, A., Escriva, H., Coddeville, B., Benaïssa, M., Leger, D.,Spik, G., & Pamblanco, M. (1997). Lactoferrin Almost Absent From Lactating Rat Mammary Gland Is Replaced by Transferrin. In Lactoferrin (pp. 125-134). Humana Press.
- [http://www.pubmedcentral.nih.gov/articlerender.fcgi?tool=pubmed&pubmedid=18472012#R11Effect+of+lactoferrin+on+enteric+pathogens]
- [https://www.ncbi.nlm.nih.gov/pubmed/9099381?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumChanges+in+nutrient+and+protein+composition+of+cat+milk+during+lactation.]
- [https://www.ncbi.nlm.nih.gov/pubmed/16011458?ordinalpos=11&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumHuman+milk+glycans+protect+infants+against+enteric+pathogens.]
- [https://www.ncbi.nlm.nih.gov/pubmed/19230080?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumHuman+milk+oligosaccharides+reduce+HIV-1-gp120+binding+to+dendritic+cell-specific+ICAM3-grabbing+non-integrin+(DC-SIGN).]
- [https://www.ncbi.nlm.nih.gov/pubmed/9927761?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_Discovery_RA&linkpos=4&log$=relatedreviews&logdbfrom=pubmedHuman+milk+glycoconjugates+that+inhibit+pathogens.]
- [https://www.ncbi.nlm.nih.gov/pubmed/18683548?ordinalpos=2&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumUse+of+oromucosally+administered+interferon-alpha+in+the+prevention+and+treatment+of+animal+diseases.]
- [https://www.ncbi.nlm.nih.gov/pubmed/12499797?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_Discovery_RA&linkpos=3&log$=relatedreviews&logdbfrom=pubmedOromucosal+cytokine+therapy:+mechanism(s)+of+action.]
- [https://www.ncbi.nlm.nih.gov/pubmed/11559435?ordinalpos=1&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DiscoveryPanel.Pubmed_Discovery_RA&linkpos=3&log$=relatedarticles&logdbfrom=pubmedOromucosal+interferon+therapy:+relationship+between+antiviral+activity+and+viral+load.]
- [https://www.ncbi.nlm.nih.gov/pubmed/11384055?ordinalpos=8&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumDistribution+of+bovine+milk+sialoglycoconjugates+during+lactation.]
- [https://www.ncbi.nlm.nih.gov/pubmed/11687297?ordinalpos=12&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumInvolvement+of+bovine+lactoferrin+metal+saturation,+sialic+acid+and+protein+fragments+in+the+inhibition+of+rotavirus+infection.]
- [https://www.ncbi.nlm.nih.gov/pubmed/12424804?ordinalpos=13&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumChanges+in+the+mannan+binding+lectin+(MBL)+concentration+in+human+milk+during+lactation.]
- [https://www.ncbi.nlm.nih.gov/pubmed/7557068?ordinalpos=4&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumLocalization+and+biosynthesis+of+aminopeptidase+N+in+pig+fetal+small+intestine.]
- [https://www.ncbi.nlm.nih.gov/pubmed/1347233?ordinalpos=18&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumFolding+of+intestinal+brush+border+enzymes.+Evidence+that+high-mannose+glycosylation+is+an+essential+early+event.]
- [https://www.ncbi.nlm.nih.gov/pubmed/1684104?ordinalpos=19&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumMorphological+and+functional+changes+in+the+enterocyte+induced+by+fructose.]
- [https://www.ncbi.nlm.nih.gov/pubmed/2569463?ordinalpos=23&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_DefaultReportPanel.Pubmed_RVDocSumPost-translational+suppression+of+expression+of+intestinal+brush+border+enzymes+by+fructose.]
Liens internes
- Porcine Circovirus 2 (PCV-2) (lien non établi avec le H7N9)