Cet article a été coécrit par Bess Ruff, MA. Bess Ruff est doctorante en géographie à l'université d'État de Floride. Elle a obtenu un master en sciences et gestion de l'environnement à l'université de Californie, Santa Barbara, en 2016. Elle a aussi mené des enquêtes pour des projets de planification des espaces marins dans les Caraïbes et a contribué à la recherche en tant que boursière d'études supérieures pour Sustainable Fisheries Group.
Il y a 14 références citées dans cet article, elles se trouvent au bas de la page.
Cet article a été consulté 84 299 fois.
La configuration électronique d'un atome, quel qu'il soit, est la répartition de ses électrons dans ses couches et sous-couches (niveaux d'énergie). Elle est définie par les nombres quantiques. Depuis Niels Bohr, l'on sait que les électrons ne peuvent se situer, autour du noyau, que sur certains niveaux d'énergies (couches), jamais entre deux niveaux. Cette façon d'écrire les électrons ne dit rien sur l'emplacement local des électrons, mais permet de savoir comment sont remplies les différentes couches (et sous-couches). À première vue, la configuration électronique d'un atome semble relever d'un code bien mystérieux avec ces lettres et ces chiffres, mais en fait, tout est d'une logique implacable.
Étapes
Méthode 1
Méthode 1 sur 4:Maitriser la terminologie
-
1Sachez ce qu'est une configuration électronique. Elle permet de connaitre la répartition autour du noyau des électrons d'un atome ou d'une molécule. Son écriture est simplifiée et c'est pour cela qu'elle parait incompréhensible à quelqu'un qui n'aurait pas les codes. La configuration permet de connaitre le nombre d'électrons, ainsi que leur répartition sur les différentes orbitales [1] .
- Le tableau périodique des éléments est basé sur les configurations électroniques de ces mêmes éléments.
- Ainsi, celle du phosphore () se présente de la façon suivante :
-
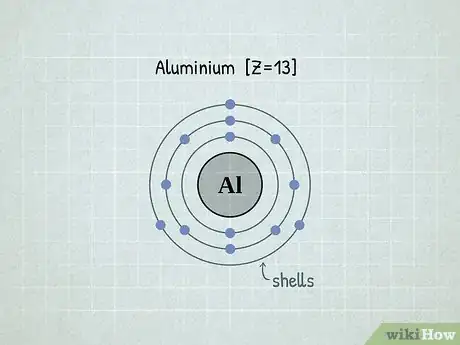
2Sachez ce que sont les couches électroniques. Les électrons sont présents autour du noyau de l'atome, et même s'il y a longtemps Niels Bohr a établi que les électrons n'avaient pas de position particulière tant qu'ils n'étaient pas observés, il a aussi établi qu'ils ne pouvaient être que sur certains niveaux d'énergie (et passer de l'un à l'autre instantanément !), mais jamais entre deux. Ces niveaux d'énergie sont des couches électroniques. Cette répartition des électrons sur les couches de différents niveaux d'énergie est la configuration électronique. Tous les électrons d'une même couche ont le même niveau d'énergie [2] .
- Les couches électroniques sont aussi appelées niveaux d'énergie, surtout en mécanique quantique.
-
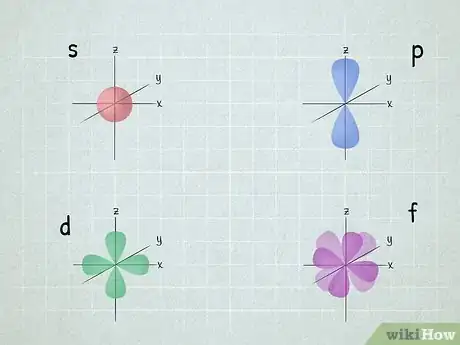
3Sachez ce que sont les orbitales atomiques (OA). Appelées à tort « sous-couches », elles décrivent l'espace où l'électron a une forte probabilité de se situer. Si lors d'une réaction chimique, un atome récupère des électrons, ils vont venir remplir une orbitale particulière et quand cette dernière est pleine, ils se retrouvent sur une autre orbitale. Dans le tableau périodique, les éléments sont classés en blocs selon ces orbitales [3] .
- Dans le bloc tous les éléments chimiques (14 connus) ont comme dernière sous-couche occupée une sous-couche laquelle selon le principe d'exclusion de Pauli ne peut contenir plus de 2 électrons.
- Le bloc (6 colonnes) groupe des éléments ayant tous comme dernière sous-couche occupée une sous-couche qui ne peut contenir plus de 6 électrons (3 OA).
- Le bloc groupe des éléments ayant tous comme dernière sous-couche occupée une sous-couche qui ne peut contenir plus de 10 électrons (5 OA).
- Le bloc groupe des éléments ayant tous comme dernière sous-couche occupée une sous-couche qui ne peut contenir plus de 14 électrons (7 OA).
- Les blocs et sont à ce jour purement théoriques. Pour l'instant, aucun atome connu. Assez logiquement, ceux du bloc ont au maximum 18 électrons sur la dernière sous-couche (9 OA). Pour le bloc 11 orbitales et un maximum de 22 électrons, pour le bloc 13 orbitales et un maximum de 26 électrons et enfin le bloc avec 15 orbitales et un maximum de 30 électrons.
- Avec la pratique, vous devriez retenir aisément les trois premières sous-couches ( et ), les suivantes sont quand même moins fréquentes [4] .
-
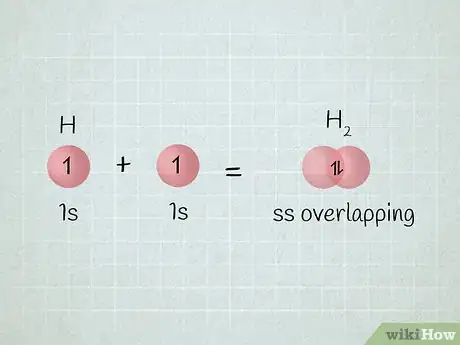
4Sachez ce qu'est le recouvrement d'orbitales. Il arrive que lorsque 2 atomes se rapprochent, certaines orbitales se recouvrent, ont un espace commun en quelque sorte. C'est, par exemple, le cas de la molécule d'hydrogène
(). Pour cette molécule, une orbitale moléculaire est obtenue par combinaison des orbitales atomiques des deux atomes Si les fonctions d'onde sont en phase, comme c'est le cas pour l'hydrogène, le recouvrement est dit constructif [5] .- À l'intérieur d'un même atome, ce phénomène est visible avec une sous-couche remplie totalement ou partiellement, au détriment de la sous-couche suivante. C'est ainsi que le germanium ( avec Z = 32) dont la configuration théorique devrait être est en fait
Cette exception à la règle de remplissage des orbitales (règle de Klechkowski) est due à un recouvrement orbital [6] .
- À l'intérieur d'un même atome, ce phénomène est visible avec une sous-couche remplie totalement ou partiellement, au détriment de la sous-couche suivante. C'est ainsi que le germanium ( avec Z = 32) dont la configuration théorique devrait être est en fait
-
5Sachez vous servir d'un tableau de configuration électronique. Aussi appelé « diagramme de Klechkowski », il permet de bien visualiser les couches et les sous-couches. Les lignes figurent de haut en bas, les nombres quantiques principaux () croissants, soit les couches, de à tandis que les colonnes de la gauche vers la droite correspondent aux nombres quantiques azimutaux (), de à Le remplissage des orbitales se fait à croissant et en cas d'égalité, c'est l'orbitale du plus petit qui est remplie. D'où une lecture (ou une application) en diagonale du haut à droite vers le bas à gauche, avec décalage à chaque fois (si toutes les couches précédentes sont remplies) vers la ligne du bas suivante [7] .
- Vous devez établir la configuration électronique du béryllium(). L'atome de béryllium renferme 4 électrons : vous commencez par remplir la sous-couche (2 ), puis la sous-couche (2 aussi), ce qui donne :
Publicité
Méthode 2
Méthode 2 sur 4:Distribuer les électrons grâce au tableau périodique
-
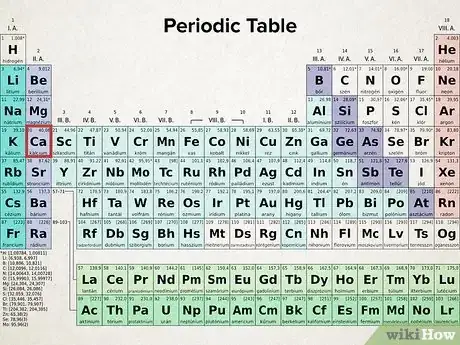
1Retrouvez le numéro atomique de votre atome. Chaque atome a un nombre déterminé d'électrons. Sur le tableau périodique, repérez votre atome par son symbole. Les éléments sont classés par numéros atomiques croissants de la gauche vers la droite et du haut vers le bas : c'est le nombre en gras dans chaque case (hydrogène = 1, tantale = 73, etc.) Le numéro atomique est le nombre de protons du noyau d'un atome et partant, c'est aussi son nombre d'électrons, en précisant que l'atome doit être électriquement neutre [8] .
- Le tableau périodique des éléments est basé sur les diverses configurations électroniques, c'est ce qui va vous permettre d'établir les vôtres.
-
2Déterminez la charge de l'atome. Les atomes neutres ont autant d'électrons que l'indique le numéro atomique. Par contre, les ions (anions et cations) ont plus ou moins d'électrons que l'atome à l'état fondamental. Un atome ayant un ou deux électrons de plus est chargé négativement, avec un ou deux électrons en moins, il est chargé positivement [9] .
- Ainsi, un atome de sodium (11 électrons à l'état neutre) qui aurait perdu un électron devient l'ion calcium de formule qui ne compte donc que 10 électrons.
- De même, un atome de chlore () qui aurait gagné lors d'une réaction un électron deviendrait un ion négatif () qui aurait non pas 17 électrons, mais 18.
-
3Comprenez la notation d'une configuration. Au premier abord, cette écriture des configurations semble obscure, mais elle décrit parfaitement la répartition des électrons sur les différentes sous-couches. Dans une configuration, chaque orbitale est figurée avec trois caractères (une lettre et 2 chiffres : la lettre est la sous-couche ( …), le chiffre devant le numéro de la couche () et le chiffre après la lettre est, en exposant, le nombre d'électrons sur la sous-couche en question. Exemple : figure la sous-couche de la deuxième couche et est occupé par 1 électron [10] .
- Prenons la configuration électronique suivante : Comprenez que cet atome a 2 électrons sur la première couche (et sous-couche), 2 autres électrons sur la deuxième sous-couche et 6 électrons sur la troisième sous-couche, soit 10 électrons (2 + 2 + 6 = 10). Cette configuration électronique est celle de l'atome neutre de néon (de numéro atomique 10).
-
4Retenez l'ordre des couches électroniques. Sachez que les sous-couches sont numérotées par couches d’électrons, mais ordonnées par niveau d’énergie. Par exemple, une sous-couche remplie possède une énergie plus faible (potentiellement plus stable) qu’une sous-couche partiellement remplie. C'est pourquoi la sous-couche apparait en premier dans la liste. Il faut connaitre cet ordre des sous-couches pour pouvoir distribuer correctement les électrons sur les diverses sous-couches. L’ordre de remplissage des sous-couches s'établit, en théorie, comme suit :
[11] .- La configuration électronique d'un atome pour lequel toutes les couches sont remplies est la suivante :
- Cet élément existe ! Jusqu'à sa création en laboratoire en 2002, il était appelé arbitrairement ununoctium. Depuis, c'est l'oganesson, de numéro atomique 118. C'est l'élément de masse atomique et de numéro atomique le plus élevé jamais synthétisé. Sa configuration électronique est donc la plus longue réelle connue.
- La configuration électronique d'un atome pour lequel toutes les couches sont remplies est la suivante :
-
5Remplissez les orbitales en fonction du nombre d'électrons. Supposons que vous ayez à établir la configuration électronique à l'état fondamental de l'atome de calcium. Jetez un coup d’œil au tableau périodique afin de trouver son numéro atomique : c'est 20. Vous allez donc répartir ces 20 électrons en couches et sous-couches autour du noyau [12] .
- Remplissez les couches selon la règle de remplissage des orbitales. La première couche () est occupée en priorité avec 2 électrons. Huit autres électrons occupent la couche immédiatement supérieure avec 2 électrons sur la sous-couche et 6 sur la Nous en sommes à 10 électrons, il en reste 10. Huit autres électrons vont se trouver sur la troisième couche avec 2 électrons sur la sous-couche et 6 sur la sous-couche Ne restent plus que 2 électrons qui vont être sur la sous-couche laquelle est pleine. La configuration électronique du calcium se note alors ainsi :
- Nota bene : les orbitales se présentent par ordre croissant d'énergie, ce qui dans certains cas aboutit à ce que l'on appelle une « inversion des orbitales », car certaines sous-couches voient leur énergie devenir supérieure à celle d'une sous-couche de la couche supérieure. À titre d'exemple, pour des éléments comme le potassium ou le calcium, la sous-couche s'inscrit après la sous-couche cette dernière est remplie avant la première. Cela ne se produit qu'après le troisième niveau d'énergie.
- Remplissez les couches selon la règle de remplissage des orbitales. La première couche () est occupée en priorité avec 2 électrons. Huit autres électrons occupent la couche immédiatement supérieure avec 2 électrons sur la sous-couche et 6 sur la Nous en sommes à 10 électrons, il en reste 10. Huit autres électrons vont se trouver sur la troisième couche avec 2 électrons sur la sous-couche et 6 sur la sous-couche Ne restent plus que 2 électrons qui vont être sur la sous-couche laquelle est pleine. La configuration électronique du calcium se note alors ainsi :
-
6Appuyez-vous sur le tableau périodique pour éviter les erreurs. Ce tableau n'est pas vraiment rectangulaire, chaque colonne correspond à des éléments dont la configuration se termine par le même type d'orbitale occupée par le même nombre d'électrons. C'est ainsi que tous les atomes de la deuxième colonne de gauche ont une configuration qui se termine par ( étant le numéro de la couche), et les configurations des éléments de la dernière colonne du bloc par etc. Avec de la pratique, vous pourrez ainsi vérifier vos configurations établies par ailleurs de façon théorique [13] .
- Les 2 colonnes les plus à gauche du tableau périodique contiennent les atomes dont les configurations électroniques se terminent par une orbitale ceux du bloc de droite se terminent par une orbitale ceux du milieu par une orbitale et enfin, ceux du cadre du bas, par une orbitale
- Vous devez écrire la configuration électronique du chlore. Cet élément se trouve sur la troisième ligne (période) du tableau périodique et dans la cinquième colonne. Il est dans le bloc : sa configuration électronique se termine par…
- Faites attention : tout n'est pas systématique dans ce tableau, en particulier concernant les blocs et Pour certains éléments, il n'y a pas adéquation entre période et dernière orbitale. Ainsi, les éléments de la première ligne du bloc (4e période) ont pour dernière orbitale une orbitale de même que la majorité des éléments de la première ligne du bloc (6e période) ont pour dernière orbitale une orbitale
-
7Utilisez l'écriture simplifiée des configurations. Tous les éléments de la dernière colonne du tableau périodique appartiennent à la même catégorie de gaz : les gaz nobles ou rares, éléments chimiquement très stables. Dans certains contextes, il est plus pratique (plus rapide !) d'utiliser l'écriture adossée au gaz rare le plus proche et antécédent à l'élément concerné. En pratique, au lieu de dérouler toutes les sous-couches, l'on part directement du gaz précédent et l'on complète par la dernière couche de valence [14] .
- Pour bien comprendre, prenons un exemple concret : le cas du zinc. Son numéro atomique est de 30. Sa configuration électronique est la suivante : Long, n'est-ce pas ? Il est possible de l'écrire autrement en utilisant la configuration électronique de l'argon, un gaz noble. Sa configuration est la suivante : : vous le voyez, c'est le début de la configuration du zinc. Nous allons donc procéder au remplacement en mettant le symbole de l'argon entre crochets :
- La configuration électronique du zinc peut s'écrire alors ainsi :
- L'argon a été pris ici, car dans le tableau il est le gaz noble le plus proche, mais placé avant le zinc. Aussi, en fonction de l'élément traité, vous prendrez toujours le gaz noble situé sur la ligne supérieure et tout à droite. Pour l'or (), vous prendrez comme gaz noble de référence le xénon ().
Publicité
Méthode 3
Méthode 3 sur 4:Utiliser le tableau périodique ADOMAH
-
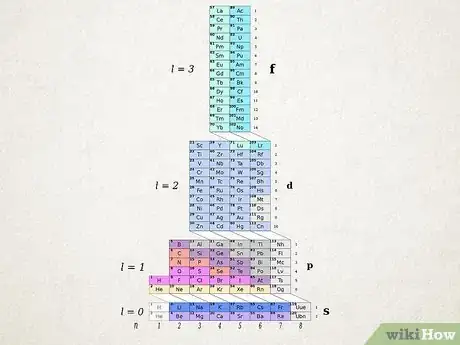
1Comprenez ce qu'est le tableau périodique ADOMAH. Aussi appelée « tableau sous forme de tour », cette autre façon de présenter les atomes est bien plus intéressante que le tableau de Mendeleïev pour ce qui est de l'établissement des configurations électroniques. Sont en particulier éliminés ici ces problèmes précédemment évoqués des blocs et S'il est moins facile à retenir, ce tableau ADOMAH est plus logique et sa lecture est finalement (assez) simple. Il fut mis au point en 2006 par Valery Tsimmerman. Recherchez un tel tableau sur Internet [15] .
- Sur un tel tableau, il y a 3 structures à repérer. D'abord, les lignes horizontales qui représentent les groupes d'éléments (halogènes, gaz nobles, métaux alcalins, métaux de transition…) Viennent ensuite les colonnes qui regroupent des éléments ayant le même nombre quantique principal (). Des traits en diagonale entre les niveaux d'énergie aux couches électroniques : ils permettent de repérer les éventuelles inversions d'orbitales.
- L'hélium se retrouve ainsi près de l'hydrogène, puisqu'ils ont le même nombre quantique principal soit un seul niveau d'énergie (), soit une seule couche électronique (). Le nombre de couches des différents éléments est indiqué en bas de la tour avec le nombre quantique principal. Les sous-couches ( et
) sont mentionnées à droite, dans cet ordre de bas en haut. Les éléments sont comme chez Mendeleïev présentés dans des rectangles, numérotés de 1 à 120 ( à ). On retrouve là les numéros atomiques, soit le nombre d'électrons (et de protons dans le noyau !) des atomes à l'état fondamental.
-
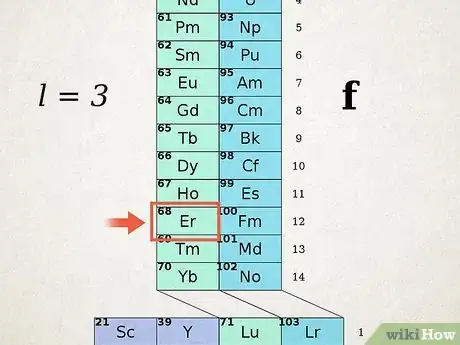
2Repérez votre atome dans le tableau ADOMAH. Pour établir la configuration électronique d'un élément, repérez son symbole et surtout son numéro atomique dans le tableau périodique ADOMAH. Allez à la base de la tour et observez le niveau Sur ce tableau, barrez tous les éléments ayant un numéro atomique supérieur à celui de votre élément. Pour l'erbium (de numéro atomique 68), barrez tous les éléments du numéro 69 à 120.
- Regardez les valeurs à la base du tableau. représente le nombre de couches d’énergie. Ignorez les colonnes dont tous les éléments ont été barrés. Pour l’erbium, est égal à 6 : il a 6 couches électroniques.
-
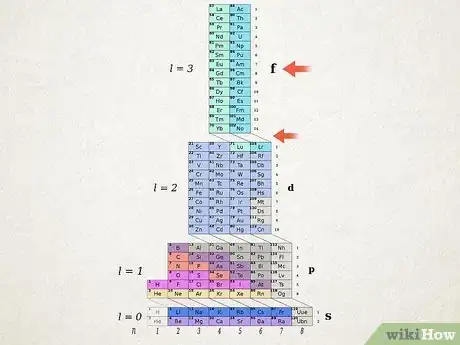
3Établissez les orbitales de l'élément. Vous allez lire, colonne après colonne, le tableau de la gauche vers la droite, du bas vers le haut. Associez (= 1, 2, 3, 4…) et les blocs ( et ) et chaque fois que vous rencontrez un élément barré, vous arrêtez la lecture pour la reprendre en bas avec une nouvelle valeur de . Ne tenez pas compte des lignes diagonales. Dans l'exemple de l'erbium, l'ossature orbitale est la suivante : [16] .
-
Nota bene : la configuration électronique précédente, celle de l'erbium est présentée selon l'ordre (que l'on qualifiera de théorique) des couches. Elle peut également être présentée dans l'ordre de remplissage des orbitales. Pour cela, il faut partir du haut et suivre les diagonales, ce qui donne :
-
Nota bene : la configuration électronique précédente, celle de l'erbium est présentée selon l'ordre (que l'on qualifiera de théorique) des couches. Elle peut également être présentée dans l'ordre de remplissage des orbitales. Pour cela, il faut partir du haut et suivre les diagonales, ce qui donne :
-
4Comptez les électrons dans chacun des blocs. Vous compterez dans chaque bloc le nombre d'électrons (cases verticales non barrées). Ce décompte, pour l'erbium, notre exemple, va nous donner :
[17] . -
5Retenez les configurations électroniques irrégulières. Il existe actuellement 18 atomes dont la configuration est irrégulière dans leur niveau d'énergie le plus bas (état fondamental). Ils ont une structure qui fait exception aux différentes règles de remplissage des couches (Klechkowski, Hund, Pauli), certains électrons, pour des raisons de meilleure stabilité ne sont pas sur la sous-couche attendue. Ils se situent sur une sous-couche de plus basse énergie pour avoir la stabilité la plus grande (état fondamental). Les atomes irréguliers sont les suivants (le gaz noble a été omis) :
- ; ; ; ; ; ; ; ; ; ; ; ; ; ; ; ; et )
Publicité
Méthode 4
Méthode 4 sur 4:Établir des configurations électroniques particulières
-
1Sachez écrire la configuration des cations. Les règles de remplissage (KPE) se doivent d'être respectées. Avec un cation (ion positif), ont été arrachés un ou plusieurs électrons les moins liés au noyau. Si le nombre d'électrons arrachés est supérieur à celui de la sous-couche la plus externe, vous puiserez dans la sous-couche juste inférieure en énergie [18] .
- Prenons l'exemple du calcium (de numéro atomique 20). À l'état fondamental, sa configuration est la suivante : L'ion calcium a 2 électrons de moins, cela tombe bien, puisqu'il y a deux électrons sur la couche la plus externe : la configuration de l'ion calcium est :
-
2Sachez écrire la configuration des anions. Les règles de remplissage (KPE) se doivent d'être respectées. Avec un anion (ion négatif), partez de la configuration électronique de l'atome à l'état fondamental. Si la dernière sous-couche, la plus haute en énergie, n'est pas entièrement remplie, ajoutez-lui simplement un électron [19] .
- L'atome neutre de chlore (de numéro atomique 17) possède donc 17 électrons et sa configuration est : L'ion chlore ( a un électron de plus (soit 18) qui est situé sur la sous-couche la plus externe En conséquence, la configuration électronique de l'ion chlore est la suivante :
-
3Sachez qu'il y a des exceptions. Que serait une règle sans exceptions ? C'est le cas avec le chrome et le cuivre. La règle empirique de Klechkowski est applicable dans tous les cas… sauf dans certains cas ! En effet, certains électrons ne s'installent pas sur la sous-couche la plus externe, mais sur la sous-couche immédiatement inférieure, rendant ainsi l'élément plus stable (spin maximal). À défaut de retenir d'autres cas de ce genre, soyez toujours en alerte quand vous rencontrez ces 2 éléments que sont le chrome et le cuivre [20] .
- La configuration théorique du chrome serait mais elle est
- La configuration théorique du cuivre serait mais elle est
Publicité
Conseils
- Les configurations électroniques longues à écrire sont écrites en simplifié à partir du gaz noble. N'apparait alors que la couche de valence (la plus externe). La couche de valence de l'antimoine (Z = 51) est sa 5e, dont la configuration en sous-couches est
- Il existe des convertisseurs de configurations, mais ils présentent l'inconvénient de ne rien expliquer, ils vous donnent la conversion brute (configuration/élément ou l'inverse).
Références
- ↑ https://www.chem.fsu.edu/chemlab/chm1045/e_config.html
- ↑ https://www.goodscience.com.au/year-9-chemistry/electron-configuration-elements-1-20/
- ↑ https://chem.libretexts.org/Bookshelves/Organic_Chemistry/Map%3A_Organic_Chemistry_(McMurry)/01%3A_Structure_and_Bonding/1.03%3A_Atomic_Structure_-_Orbitals
- ↑ https://www.mnemonic-device.com/chemistry/sober-physicists-dont-find-giraffes-hiding-in-kitchens/
- ↑ https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_-_The_Central_Science_(Brown_et_al.)/09._Molecular_Geometry_and_Bonding_Theories/9.4%3A_Covalent_Bonding_and_Orbital_Overlap
- ↑ https://sciencing.com/determine-valence-orbital-element-8415138.html
- ↑ https://fr.khanacademy.org/science/chemistry/electronic-structure-of-atoms/electron-configurations-jay-sal/v/orbitals
- ↑ https://brilliant.org/discussions/thread/periodic-table-ii-chemistry/
- ↑ https://chem.libretexts.org/Courses/Nassau_Community_College/Organic_Chemistry_I_and_II/01%3A_Introduction_and_Review/1.04%3A_Electron_Configurations
- ↑ https://chem.libretexts.org/Courses/Nassau_Community_College/Organic_Chemistry_I_and_II/01%3A_Introduction_and_Review/1.04%3A_Electron_Configurations
- ↑ https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Quantum_Mechanics/10%3A_Multi-electron_Atoms/Electron_Configuration
- ↑ https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Quantum_Mechanics/10%3A_Multi-electron_Atoms/Electron_Configuration
- ↑ https://chem.libretexts.org/Courses/Nassau_Community_College/Organic_Chemistry_I_and_II/01%3A_Introduction_and_Review/1.04%3A_Electron_Configurations
- ↑ http://www.1728.org/shells.htm
- ↑ https://perfectperiodictable.com/
- ↑ https://perfectperiodictable.com/userguide.html
- ↑ https://perfectperiodictable.com/userguide.html
- ↑ https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_Chemistry_(Zumdahl_and_Decoste)/08%3A_Bonding_General_Concepts/13.04_Ions%3A_Electron_Configurations_and_Sizes
- ↑ https://www.chem.fsu.edu/chemlab/chm1045/e_config.html
- ↑ https://www.chem.fsu.edu/chemlab/chm1045/e_config.html
































































![{\displaystyle {[Ar]}.}](./images/1742020458-62820b75ab5a545ecba2a40d673069367c17af3b.webp)
![{\displaystyle {[Ar]4s^{2}3d^{10}}.}](./images/2060001304-bec669aa99a6489f2e31c32c860deee2622ffd90.webp)

![{\displaystyle {[Xe]}}](./images/1799364462-8a40d8b056ee508af245a815fb6143e44413fd2b.webp)




































![{\displaystyle {[Ar]}3d^{4}4s^{2},}](./images/1498291828-289d798c17020764ed47a3a58d4897248194f053.webp)
![{\displaystyle {[Ar]}3d^{5}4s^{1}.}](./images/1766268660-7ea851c0c2efb196235635566e490dd5409b4891.webp)
![{\displaystyle {[Ar]}3d^{9}4s^{2},}](./images/1990664204-f050e2b046fce81cb6ca9689ee4119a2a6d875cc.webp)
![{\displaystyle {[Ar]}3d^{10}4s^{1}.}](./images/1876434777-70cd83a20dce86678ba85a949a2a64693ff41627.webp)