X
wikiHow est un wiki, ce qui veut dire que de nombreux articles sont rédigés par plusieurs auteurs(es). Pour créer cet article, des auteur.e.s volontaires ont participé à l'édition et à l'amélioration.
Cet article a été consulté 124 864 fois.
La molarité est la relation entre le nombre de moles d'un soluté et le volume d'une solution. Voici des détails sur la façon de trouver la molarité quand vous possédez le nombre de moles, de litres, de grammes ou de millimètres.
Étapes
Méthode 1
Méthode 1 sur 4:Calculer la molarité à partir des moles et du volume
Méthode 1
-
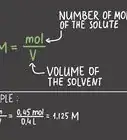
1Vous devez connaitre la formule de base pour calculer la molarité. La molarité est égale au nombre de moles d'un soluté divisé par le volume de la solution en litres. La formule est donc la suivante : molarité = moles d'un soluté / litres d'une solution.
- Exemple : quelle est la molarité d'une solution de 4,2 litres contenant 0,75 mol de NaCl ?
-
2Examinez l'énoncé de plus près. Pour calculer la molarité, vous devez avoir le nombre de moles et le nombre de litres. Si ces données sont fournies dans l'énoncé, vous n'avez pas besoin d'effectuer des calculs préliminaires.
- Exemple de problème :
- moles = 0,75 mol NaCl
- volume = 4,2 l
- Exemple de problème :
-
3Divisez le nombre de moles par le nombre de litres. Ce quotient vous donnera le nombre de moles par litre de solution, c'est-à-dire la molarité.
- Exemple : molarité = moles de soluté / litres de solution = 0,75 / 4,2 l = 0,1785742
-
4Notez votre réponse. Arrondissez le nombre de décimales après la virgule au dixième ou au centième, selon les indications de votre professeur. Au moment d'écrire votre réponse, utilisez l'abréviation « M » pour « molarité » et utilisez l'abréviation chimique du soluté en question.
- Exemple : 0,179 M NaCl
Publicité
Méthode 2
Méthode 2 sur 4:Calculer la molarité à partir de la masse et du volume
Méthode 2
-
1Vous devez connaitre la formule de base pour calculer la molarité. La molarité est égale au nombre de moles d'un soluté divisé par le volume de la solution en litres. La formule est donc la suivante : molarité = moles d'un soluté/litres d'une solution.
- Exemple : quelle est la molarité d'une solution issue de la dissolution de 3,4 g de KMnO4 dans 5,2 litres d'eau ?
-
2Examinez l'énoncé de plus près. Pour calculer la molarité, vous devez avoir le nombre de moles et le nombre de litres. Si ces données ne sont pas fournies dans l'énoncé, mais que vous avez le volume et la masse de la solution, vous aurez besoin d'utiliser ces deux données pour calculer le nombre de moles avant de continuer.
- Exemple :
- masse = 3,4 g KMnO4
- volume = 5,2 l
- Exemple :
-
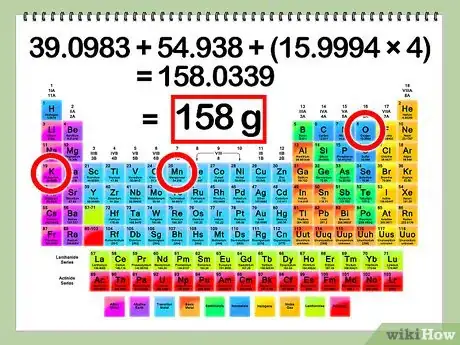
3Trouvez la masse molaire du soluté. Dans le but de calculer le nombre de moles à partir de la masse en grammes du soluté utilisé, vous devez d'abord déterminer la masse molaire du soluté. Pour cela vous devez additionner les masses molaires de chaque élément trouvé dans la solution. Trouvez les masses molaires de chaque élément dans la table périodique des éléments.
- Exemple :
- masse molaire de K = 39,1 g
- masse molaire de Mn = 54,9 g
- masse molaire d’O = 16,0 g
- masse molaire totale = K + Mn + O + O + O + O = 39,1 + 54,9 + 16 + 16 + 16 + 16 = 158 g
- Exemple :
-
4Convertissez les grammes en moles. À présent que vous avez les masses molaires du soluté, vous avez besoin de multiplier le nombre de grammes de soluté présent dans la solution par un facteur de conversion de 1 mole divisée par la formule de la masse (masse molaire) du soluté. Vous obtiendrez alors le nombre de moles de soluté pour cette équation.
- Exemple : grammes de soluté*(1 / masse molaire du soluté) = 3,4 g*(1 mol / 158 g) = 0,0215 mol.
-
5Divisez le nombre de moles par le nombre de litres. À présent que vous avez le nombre de moles, vous pouvez diviser cette valeur par le nombre de litres de solution afin de trouver la molarité.
- Exemple : molarité = moles de soluté / litres de solution = 0,0215 mol / 5,2 l= 0,004134615
-
6Notez votre réponse. Vous devriez arrondir le nombre de décimales après la virgule selon les indications de votre professeur. Généralement, on laisse deux ou trois chiffres après la virgule. De plus, au moment d'écrire votre réponse, utilisez l'abréviation « M » pour « molarité » et nommez le composé en question.
- Exemple : 0,004 M KMnO4
Publicité
Méthode 3
Méthode 3 sur 4:Calculer la molarité à partir de moles et de millilitres
Méthode 3
-
1Vous devez connaitre la formule de base pour calculer la molarité. La molarité est égale au nombre de moles d'un soluté divisé par le volume de la solution en litres. La formule est donc la suivante : molarité = moles d'un soluté / litres d'une solution.
- Exemple : quelle est la molarité de 2 905 millilitres de solution contenant 1,2 mole de CaCl2 ?
-
2Examinez l'énoncé de plus près. Pour calculer la molarité, vous devez avoir le nombre de moles et le nombre de litres. Si on vous a donné le volume en millilitres au lieu de lires, vous aurez besoin de convertir le volume en litres avant de continuer.
- Exemple :
- moles = 1,2 mol CaCl2
- volume = 2 905 ml
- Exemple :
-
3Convertissez les millilitres en litres. Trouvez le nombre de litres en divisant le nombre de millimètres par 1 000, puisqu'il y a 1 000 millilitres dans un litre. Vous pourriez aussi déplacer la virgule de 3 chiffres sur la droite.
- Exemple : 2 905 ml*(1 l/ 1 000 ml) = 2,905 l
-
4Divisez le nombre de moles par le nombre de litres. À présent que vous avez le nombre de litres, vous pouvez diviser le nombre de moles de soluté par cette valeur afin de trouver la molarité de la solution.
- Exemple : molarité = moles de soluté / litres de solution = 1,2 mol CaCl2 / 2,905 l = 0,413080895
-
5Notez votre réponse. Vous devriez arrondir le nombre de décimales après la virgule selon les indications de votre professeur (généralement deux ou trois chiffres après la virgule). De plus, au moment d'écrire votre réponse, utilisez l'abréviation « M » pour « molarité » et nommé le soluté en question.
- Exemple : 0,413 M CaCl2
Publicité
Méthode 4
Méthode 4 sur 4:Exercice pratique supplémentaire
Méthode 4
-
1Trouvez la molarité d'une solution issue de la dissolution de 5,2 g de NaCl dans 800 ml d'eau. Identifiez les données fournies dans l'énoncé : la masse en grammes et le volume en millilitres.
- Masse = 5,2 g NaCl
- Volume = 800 ml d'eau
-
2Trouvez la masse molaire du NaCl. Pour cela, additionnez les masses molaires du sodium Na et celle du chlore Cl.
- Masse molaire du Na = 22,99 g
- Masse molaire du Cl = 35,45 g
- Masse molaire du NaCl = 22,99 + 35,45 = 58,44 g
-
3Multipliez la masse du soluté par le facteur de conversion de sa masse molaire. En l'occurrence, la masse molaire du NaCl est de 58,44 g, donc le facteur de conversion est de 1 mol / 58,44 g.
- Moles de NaCl = 5,2 g NaCl*(1 mol / 58,44 g) = 0,08898 mol = 0,09 mol
-
4Divisez 8 000 ml d'eau par 1 000. Puisqu'il y a 1 000 millilitres d'eau par litre, vous devrez diviser le nombre de millilitres par 1 000 pour obtenir le nombre de litres.
- Une autre façon de faire serait de multiplier 800 ml par un facteur de conversion de 1 l / 1 000 mL.
- Pour aller plus vite, vous pouvez aussi simplement déplacer la virgule de 3 chiffres sur la droite plutôt que de faire une multiplication ou une division.
- Volume = 800 ml*(1 l / 1 000 ml) = 800 ml / 1 000 ml = 0,8 l
-
5Divisez le nombre de moles de soluté par le nombre de litres de solution. Pour obtenir la molarité, vous devez diviser 0,09 mol -- soit le nombre de moles du soluté NaCl -- par 0,8 l -- soit le volume de la solution en litres.
- molarité = moles de soluté / litres de solution = 0,09 mol / 0,8 l = 0,1125 mol/L
-
6Notez : utilisez l'abréviation « M » pour « molarité ».
- Résultat : 0,11 M NaCl
Publicité
À propos de ce wikiHow
Publicité