Cet article a été coécrit par Bess Ruff, MA. Bess Ruff est doctorante en géographie à l'université d'État de Floride. Elle a obtenu un master en sciences et gestion de l'environnement à l'université de Californie, Santa Barbara, en 2016. Elle a aussi mené des enquêtes pour des projets de planification des espaces marins dans les Caraïbes et a contribué à la recherche en tant que boursière d'études supérieures pour Sustainable Fisheries Group.
Cet article a été consulté 35 717 fois.
Il est souvent indispensable de savoir comment la concentration des substances chimiques influence la vitesse d’une réaction pour comprendre divers processus chimiques. « L’ordre de réaction » s’intéresse à la façon dont la concentration d’un ou de plusieurs réactifs modifie la vitesse de réaction. L’ordre global d’une réaction chimique correspond à la somme des ordres de réaction de tous les réactifs présents. Il ne vous suffira certes pas d’observer l’équation bilan d’une réaction pour déterminer quel est son ordre, mais vous pourrez déduire cette information à partir de sa vitesse de réaction ou du graphique qui la représente.
Étapes
Méthode 1
Méthode 1 sur 3:Analyser la vitesse de réaction
-
1Analysez l’équation de la vitesse. L’équation de vitesse de la réaction peut vous aider à déterminer l’ordre de réaction. Cette équation sert à mettre en évidence l’augmentation ou la diminution de l’une des substances chimiques en fonction du temps écoulé. Aucun autre type d’équation lié à cette réaction ne vous permettra d’identifier son ordre de réaction [1] .
-
2Identifiez l’ordre des réactifs. Chacun des réactifs apparaissant dans l’équation de vitesse possèdera un exposant de 0, 1 ou 2 (il est extrêmement rare de rencontrer des exposants supérieurs à 2). Il vous suffira alors de tenir compte de la valeur de cet exposant qui vous indiquera l’ordre de chaque réactif [2] .
- Si l’exposant est égal à zéro, la concentration du réactif en question n’influence pas la vitesse de réaction.
- Si l’exposant est égal à 1, cela signifie que l’augmentation de la concentration du réactif concerné fait augmenter la vitesse de réaction de façon linéaire (si vous doublez sa concentration, vous doublez la vitesse de réaction).
- Si l’exposant est égal à 2, la vitesse de réaction augmente au carré de l’augmentation de la concentration du réactif (si vous doublez sa concentration, la vitesse est multipliée par 4).
- La plupart du temps, puisque n’importe quel nombre élevé à la puissance zéro sera toujours égal à 1, les réactifs d’ordre zéro ne sont pas mentionnés dans les équations de vitesse.
-
3Ajoutez l’ordre de tous les réactifs. L’ordre global d’une réaction chimique correspond à la somme des ordres de chacun de ses réactifs. Vous n’avez donc qu’à faire le total des exposants de tous les réactifs pour trouver l’ordre de votre réaction chimique. En général, ce résultat est inférieur ou égal à 2 [3] .
- Par exemple, si votre réactif numéro un est du premier ordre (c’est-à-dire qu’il a un exposant de 1) et que votre réactif numéro deux est aussi du premier ordre (il a aussi un exposant de 1), alors la réaction globale sera de second ordre.
Publicité
Méthode 2
Méthode 2 sur 3:Tracer un graphique à partir des données
-
1Trouvez les variables pour représenter la réaction par une fonction linéaire. Le graphique représentant la réaction est dit linéaire lorsque son taux d’accroissement est constant. En d’autres termes, cela signifie que la variable dépendante changera autant au cours de la première seconde qu’au cours de la deuxième, de la troisième et ainsi de suite. Visuellement, le graphique linéaire apparaitra sur la page comme une ligne droite.
-
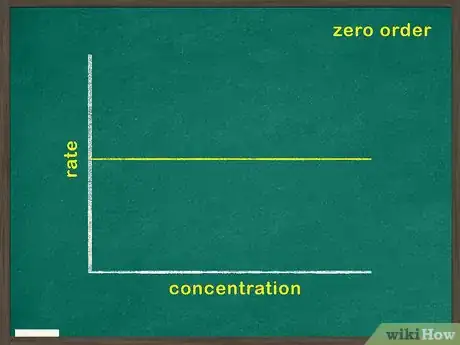
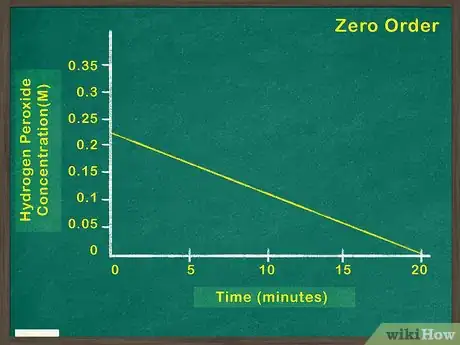
2Représentez la concentration du réactif en fonction du temps. Vous pourrez ainsi voir sur le graphique la quantité de réactif qui reste à n’importe quel instant de la réaction. Si la fonction représentée sur le graphique est linéaire, cela signifie que la concentration du réactif n’a pas d’impact sur la vitesse de déroulement de la réaction. Vous êtes donc face à un réactif de degré zéro [4] .
-
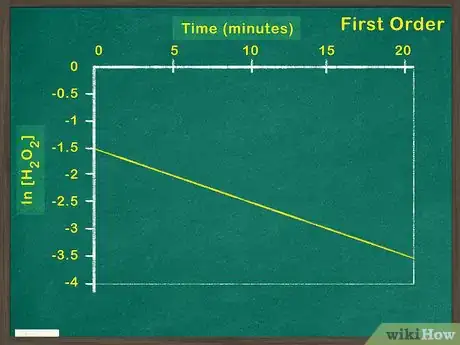
3Tracez le logarithme naturel. Si, en représentant le logarithme naturel de la concentration en réactif en fonction du temps, vous obtenez une fonction linéaire, cela signifie que le réactif est de premier ordre. Si ce n’est pas le cas, vous allez devoir vérifier à partir de votre graphique qu’il s’agit d’une réaction de second ordre [5] .
-
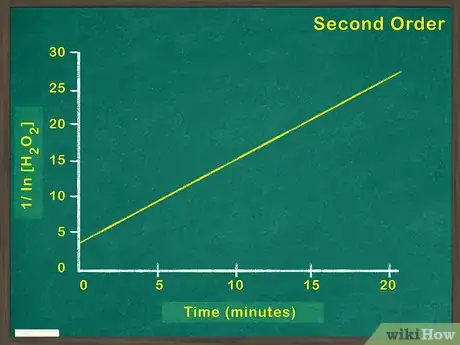
4Représentez l’inverse de la concentration en réactif en fonction du temps. Si la fonction correspondant à [1/concentration en réactif] est une fonction linéaire, c’est que vous êtes face à une réaction de second ordre. Par conséquent, la vitesse de réaction augmentera au carré par rapport à l’accroissement de la concentration en réactif. Si la fonction que vous trouvez n’est pas linéaire, c’est que vous êtes en présence d’une réaction d’ordre zéro ou de premier ordre [6] .
-
5Faites la somme des ordres de tous les réactifs. Une fois que vous êtes parvenu à établir une fonction linéaire correspondant à tous les réactifs, vous êtes en mesure de connaitre l’ordre de chacun d’entre eux. Vous pouvez dès lors calculer l’ordre global. Il vous suffit d’ajouter tous ensemble les ordres des différents réactifs pour obtenir l’ordre global de votre réaction [7] .Publicité
Méthode 3
Méthode 3 sur 3:Résoudre le problème expérimentalement
-
1Repérez un réactif du premier ordre. Trouvez quel est l’ordre d’une réaction quand la vitesse de celle-ci double si l’on multiplie par deux la concentration de l’un des réactifs. Sachez que si l’on double la concentration d’un réactif et que cela multiplie par deux la vitesse de réaction, cela signifie que ce réactif est du premier ordre. Dans ce cas-là, les deux réactifs sont du premier ordre. Vous pouvez donc en conclure que la somme de ces deux réactifs du premier ordre provoque une réaction chimique de second ordre.
-
2Repérez un réactif d’ordre zéro. Déterminez l’ordre d’une réaction pour laquelle aucune modification de la vitesse de réaction n’a lieu lorsque l’on double la concentration des deux réactifs. Si la multiplication par deux de la concentration de l’un des réactifs n’entraine pas de changement de la vitesse de réaction, cela signifie que le réactif en question est d’ordre zéro. Dans ce cas-là, les deux réactifs sont d’ordre zéro. Si l’on mélange deux réactifs d’ordre zéro, on obtient une réaction chimique globale d’ordre zéro.
-
3Repérez un réactif du second ordre. Trouvez de quel ordre est une réaction dont la vitesse quadruple lorsque l’on double l’un des réactifs. Le réactif qui influence de la sorte la vitesse de réaction est de second ordre. L’autre réactif n’aura dans ce cas-là pas d’influence et sera d’ordre zéro. La somme des ordres de ces deux réactifs sera deux, ce qui signifie qu’il s’agit globalement d’une réaction chimique de second ordre.Publicité
Références
- ↑ http://www.chemguide.co.uk/physical/basicrates/orders.html
- ↑ http://www.chemguide.co.uk/physical/basicrates/orders.html
- ↑ http://www.chemguide.co.uk/physical/basicrates/orders.html
- ↑ http://www.sparknotes.com/chemistry/kinetics/ratelaws/section2/page/3/
- ↑ http://www.sparknotes.com/chemistry/kinetics/ratelaws/section2/page/3/
- ↑ http://www.sparknotes.com/chemistry/kinetics/ratelaws/section2/page/3/
- ↑ http://www.chemguide.co.uk/physical/basicrates/orders.html