Cet article a été rédigé avec la collaboration de nos éditeurs(trices) et chercheurs(euses) qualifiés(es) pour garantir l'exactitude et l'exhaustivité du contenu.
L'équipe de gestion du contenu de wikiHow examine soigneusement le travail de l'équipe éditoriale afin de s'assurer que chaque article est en conformité avec nos standards de haute qualité.
Cet article a été consulté 57 018 fois.
La concentration équivalente (ou normalité, de symbole N) mesure le degré de concentration, acide ou basique, d’une solution. Même si elle est un peu désuète aujourd’hui, il y a deux façons de la calculer : soit vous utilisez la molarité soit le poids équivalent (ou équivalent-gramme). Dans le premier, vous utiliserez la formule N = b(n), dans laquelle b est la molarité et n le nombre de moles d’hydrogène ou d’hydroxyde. Dans le second cas, il faudra utiliser une autre formule : N = éq ÷ V, dans laquelle éq est le nombre d’équivalents-grammes et V le volume de la solution.
Étapes
Méthode 1
Méthode 1 sur 2:Calculer une normalité à partir des masses molaires
-
1Additionnez les masses molaires des éléments du composé. Dans un tableau périodique des éléments, repérez les différents éléments chimiques de votre composé afin d’en récupérer les masses (molaires) atomiques. Sur un papier, inscrivez le nom de l’atome et à côté sa masse atomique. Plus loin encore, inscrivez la masse molaire en multipliant la masse atomique par le nombre d’atomes du composé. Pour finir, additionnez toutes ces masses molaires atomiques et vous aurez la masse molaire moléculaire du composé [1] .
- Pour un exercice, vous avez à trouver la masse molaire de l’acide sulfurique, de formule H2SO4. Dans un premier temps, sur le tableau périodique, vous trouverez que la masse atomique de l’hydrogène est de 1 g, celle du soufre de 32 g et celle de l’oxygène de 16 g.
- Multipliez ces masses par le nombre d’atomes contenus dans le composé. Dans H2SO4, il y a 2 atomes d’hydrogène, 2 de soufre et 4 d’oxygène. La masse molaire totale de l’hydrogène est de 2 g (2 x 1 g) et celle de l’oxygène pour ce composé est de 64 g (4 x 16 g).
- Faites la somme de toutes ces masses molaires, ce qui ici donne :
2 g + 32 g + 64 g = 98 g/mol. - À ce stade, si l’on vous donne dans l’énoncé la molarité de la solution, passez directement à la 4e étape.
-
2Divisez la masse du composé par sa masse molaire. La masse du composé est indiquée avec la solution ou donnée dans l’énoncé si c’est un exercice scolaire. Divisez alors la masse du composé par la masse molaire totale calculée précédemment. Vous obtenez le nombre de moles du composé, vous mettrez comme unite mol [2] .
- Admettons que l’on vous demande la concentration équivalente de 100 g de H2SO4 dissouts dans 12 L d’eau. Pour trouver le nombre de moles impliquées, divisez simplement la masse du soluté par sa masse molaire, ce qui donne :
100 g ÷ 98 g/mol = 1,02 mol. - Une mole, unité de base du Système international, contient 6,02 x 1023 atomes ou molécules.
- Admettons que l’on vous demande la concentration équivalente de 100 g de H2SO4 dissouts dans 12 L d’eau. Pour trouver le nombre de moles impliquées, divisez simplement la masse du soluté par sa masse molaire, ce qui donne :
-
3Calculez la molarité. Pour cela, divisez le précédent résultat par le volume, en litres, de la solution. Récupérez le nombre de moles précédemment calculé et divisez-le par le volume total de la solution. Ce que vous obtenez est la molarité (b), laquelle mesure en fait la concentration (en un certain composé) d’une solution [3] .
- Dans notre exemple, 1,02 mol ÷ 12 L = 0,085 M (ou mol/l).
Conseil : à moins que ce ne soit déjà le cas, le volume de la solution doit absolument être en litres. Si vous avez une autre unité de volume, vous obtiendrez un résultat faux.
-
4Multipliez la molarité par le nombre d’ions hydrogène ou hydroxyde. Dans la formule chimique du soluté, comptez le nombre d’atomes d’hydrogène (H) dans le cas d’une solution acide ou d’ions hydroxyde (OH) pour une solution basique. Multipliez la molarité par le nombre d’ions du composé et vous trouverez la concentration équivalente (N). L’unité à mettre est N (pour « Normal [4] »).
- L’acide sulfurique H2SO4 contient 2 atomes d’hydrogène, si bien que :
N = 0,085 M x 2 = 0,17 N. - Prenons l’exemple d’une solution (basique) de soude caustique (NaOH) ayant une molarité de 2 M. La solution n’ayant qu’un seul ion hydroxyde, la concentration équivalente est de : N = 2 M x 1 = 2 N.
Publicité - L’acide sulfurique H2SO4 contient 2 atomes d’hydrogène, si bien que :
Méthode 2
Méthode 2 sur 2:Calculer une normalité à partir du poids équivalent
-
1Trouvez la masse molaire totale du composé. Dans un tableau périodique des éléments, repérez les différents éléments chimiques du composé, récupérez les masses atomiques (en grammes), inscrivez-les en regard des noms des atomes, faites la multiplication par le nombre d’atomes entrant dans le composé et pour finir, additionnez toutes ces masses molaires atomiques pour obtenir, en grammes, la masse molaire moléculaire du composé [5] .
- Pour un exercice, vous avez à trouver la masse molaire de Ca(OH)2 (hydroxyde de calcium). Trouvez la masse molaire atomique du calcium (40 g), de l’oxygène (16 g) et de l’hydrogène (1 g).
- Il y a ici 1 atome de calcium, 2 d’oxygène et 2 d’hydrogène. La masse molaire totale de l’oxygène est de 32 g (2 x 16 g) et celle de l’hydrogène de 2 g (2 x 1 g).
- Faites la somme de toutes ces masses molaires, ce qui ici donne :
40 g + 32 g + 2 g = 74 g/mol.
-
2Divisez la masse molaire par le nombre d’ions hydrogène ou hydroxyde. Comptez le nombre d’atomes d’hydrogène (H) dans le cas d’une solution acide ou d’ions hydroxyde (OH) pour une solution basique. Divisez la masse molaire totale par le nombre d’atomes ou d’ions et vous obtiendrez le poids d’un équivalent, c’est-à-dire la masse d’une mole d’hydrogène ou d’hydroxyde. Mettez comme unité de poids équivalent g/éq.
- Dans notre exemple, Ca(OH)2 renferme deux ions hydroxyde, son poids équivalent est de : 74 g/mol ÷ 2 = 37 g/éq.
-
3Divisez la masse du composé par son poids équivalent. Une fois le poids équivalent déterminé, divisez-le par la masse du composé (que vous aurez mis en œuvre lors d’une expérience ou qui vous aura été donnée dans l’énoncé de l’exercice). Vous obtenez ainsi le nombre d’équivalents de solution, ce qui vous permettra de calculer la concentration équivalente. Le résultat sera complété par son unité : éq [6] .
- Admettons que vous ayez un soluté de 75 g de Ca(OH)2, alors vous obtenez :
75 g ÷ 37 g/éq = 2,027 éq.
- Admettons que vous ayez un soluté de 75 g de Ca(OH)2, alors vous obtenez :
-
4Divisez le nombre d’équivalents par le volume de la solution. Mesurez le volume en litres de votre solution et notez-le quelque part. Partez du nombre d’équivalents obtenus pour le diviser par le volume de la solution, vous obtenez la concentration équivalente (N). L’unité à mettre est N (pour « Normal »).
- Pour une solution de 8 litres d’eau dans laquelle l’on a dissout 75 g de Ca(OH)2, divisez le nombre d’équivalents par le volume, soit :
N = 2,027 éq ÷ 8 L = 0,253 N.
Publicité - Pour une solution de 8 litres d’eau dans laquelle l’on a dissout 75 g de Ca(OH)2, divisez le nombre d’équivalents par le volume, soit :
Conseils
- La concentration équivalente d’une solution acide ou basique mesure les moles d’ions H+ susceptibles d’être libérées par litre de cette solution. Pour toutes les autres solutions qui ne sont pas de ces types, servez-vous de la molarité.
Éléments nécessaires
- Le tableau périodique des éléments (dit de Mendeleïev)
- Une calculatrice
Références
- ↑ https://www.youtube.com/watch?v=QCZMyx_557I&feature=youtu.be&t=210
- ↑ https://www.youtube.com/watch?v=QCZMyx_557I&feature=youtu.be&t=248
- ↑ https://www.youtube.com/watch?v=QCZMyx_557I&feature=youtu.be&t=267
- ↑ http://www.lagoonsonline.com/laboratory-articles/normality.htm
- ↑ https://sciencing.com/calculate-equivalent-weight-6463740.html
- ↑ http://www.lagoonsonline.com/laboratory-articles/normality.htm
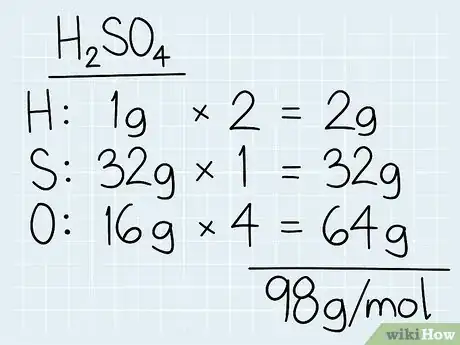

























L'équipe de gestion du contenu de wikiHow examine soigneusement le travail de l'équipe éditoriale afin de s'assurer que chaque article est en conformité avec nos standards de haute qualité. Cet article a été consulté 57 018 fois.