Cet article a été coécrit par Bess Ruff, MA. Bess Ruff est doctorante en géographie à l'université d'État de Floride. Elle a obtenu un master en sciences et gestion de l'environnement à l'université de Californie, Santa Barbara, en 2016. Elle a aussi mené des enquêtes pour des projets de planification des espaces marins dans les Caraïbes et a contribué à la recherche en tant que boursière d'études supérieures pour Sustainable Fisheries Group.
Cet article a été consulté 56 936 fois.
En chimie, une dilution consiste à diminuer la concentration d'une solution donnée. Une dilution en série est tout simplement une dilution répétée d'une solution originale afin d'amplifier rapidement le facteur de dilution [1] . Ce genre de dilution est souvent réalisé au cours d'expériences nécessitant des solutions hautement diluées et une grande précision, comme celles impliquant des courbes de concentration sur une échelle logarithmique ou celles qui permettent de calculer la densité en bactéries de certains milieux. Elles sont très fréquemment réalisées en biochimie, en microbiologie, en pharmacologie ou en chimie.
Étapes
Méthode 1
Méthode 1 sur 2:Réaliser une dilution simple
-
1Déterminez le bon liquide de dilution (ou diluant). Le choix du diluant est très important et dépend de la solution que vous voulez diluer. Le diluant est souvent de l'eau distillée, mais ce n'est pas systématique. Ainsi, avec une solution contenant des bactéries ou des cellules, on utilise plutôt un milieu de culture [2] . Pour une dilution en série, on utilise le même diluant dans tous les tubes.
- Si vous n’êtes pas sûr du diluant à utiliser, faites-vous aider par une personne compétente ou regardez sur Internet ce qu'ont bien pu prendre les internautes pour une expérience similaire.
-
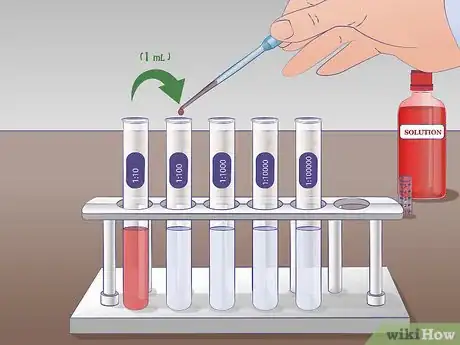
2Préparez plusieurs tubes à essai contenant 9 ml d'un liquide de dilution. Ces tubes à essai serviront à faire les dilutions successives [3] . Le principe est simple, vous allez prélever un échantillon de la solution de départ et la transférer dans le tube suivant, puis prendre un échantillon de ce tube pour le mettre dans le suivant, etc.
- Avant de démarrer les dilutions, il est souhaitable d'étiqueter à l'avance les tubes à essai pour éviter par la suite toute confusion.
- Dans chaque tube, vous aurez une concentration dix plus faible que dans le précédent [4] . Le premier tube contiendra une solution diluée au dixième, le deuxième, au centième, le troisième, au millième, etc. Déterminez à l'avance le nombre de dilutions pour ne pas préparer plus de tubes que nécessaire et gaspiller inutilement du diluant.
-
3Préparez un tube à essai avec votre solution mère. Mettez-en au moins 2 ml. La quantité minimale de solution mère pour faire une dilution en série est d'un millilitre. Prévoyez 2 ml pour une éventuelle seconde dilution. Ce tube de solution mère, vous pouvez le marquer d'un « SM ».
- Avant de démarrer une dilution en série, il faut toujours bien mélanger la solution de départ [5] .
-
4Réalisez la première dilution. Avec une pipette, prélevez 1 ml de la solution mère dans le tube à essai marqué « SM » et transférez cette quantité dans le tube à essai marqué 1/10 qui contient déjà 9 ml de liquide de dilution. Mélangez pour obtenir une solution homogène. Dans ce tube, il y a désormais 10 ml de solution : 1ml de solution mère et 9 ml de liquide de dilution. Cette nouvelle solution est dix fois moins concentrée que la précédente.
-
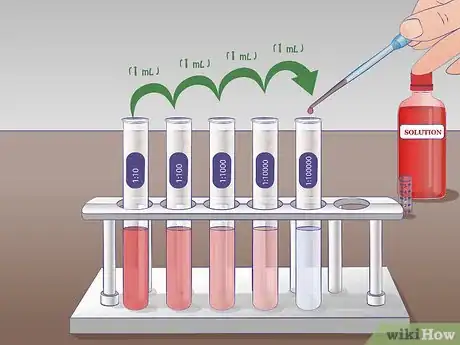
5Réalisez la seconde dilution. Lors de la seconde dilution en série, vous prélèverez 1 ml de la solution du tube marqué 1/10 et vous le verserez dans le tube 1/100 qui contient déjà 9 ml de liquide de dilution. Le tube 1/10 aura été bien mélangé avant le prélèvement. Une fois le transfert fait, mélangez bien le tube 1/100. La solution tirée du tube marqué 1/10 est 10 fois plus concentrée que celle du tube marqué 1/100.
-
6Répétez si nécessaire cette manipulation. Cette façon de procéder peut être répétée autant de fois que désiré jusqu'à obtenir la dilution voulue. Pour une expérience impliquant des courbes de concentration, vous pouvez ainsi obtenir une série de solutions avec des dilutions à l'unité, au dixième (1/10), au centième (1/100) ou au millième (1/1 000).Publicité
Méthode 2
Méthode 2 sur 2:Calculer le facteur de dilution et la concentration finaux
-
1Calculez le ratio de la dilution finale après une dilution en série. Le ratio total de la dilution s'obtient en multipliant le facteur de dilution par lui-même autant de fois qu'il y a de dilutions. Mathématiquement, la formule se présente ainsi : Dt = D1 x D2 x D3 x … x Dn, avec Dt représentant le facteur de dilution total et Dn, le ratio de la dilution [6] .
- Ainsi, admettons que vous réalisiez une dilution au 1/10 d'un liquide 4 fois de suite. Dans la formule, remplacez le facteur de dilution par sa valeur : Dt = 10 x 10 x 10 x 10 = 10 000
- Le facteur de dilution final du quatrième tube dans votre dilution en série est 1/10 000. La concentration de la solution du dernier tube est désormais 10 000 fois plus faible que celle de la solution d'origine.
-
2Déterminez la concentration d'une solution après dilutions. Pour trouver la concentration finale d'une solution après une dilution en série, vous devez connaitre la concentration de départ. La formule est alors : Cfinale = Cinitiale/D, avec Cfinale représentant la concentration terminale de la solution diluée, Cinitiale, la concentration de la solution mère et D, le ratio de la dilution déterminé à l'avance [7] .
- Ainsi, si vous diluez une solution de cellules ayant une concentration de 1 000 000 de cellules par ml et que votre ratio de la dilution a été fixé à 1 000, quelle sera la concentration finale de votre échantillon dilué ?
- Utilisez la formule :
- Cfinale = Cinitiale/D
- Cfinale = 1 000 000/1 000
- Cfinale = 1 000 cellules/ml
-
3Faites attention aux unités employées. Quand vous faites vos calculs, vérifiez toujours que vous utilisez les mêmes unités [8] . Ainsi, si vous partez d'une concentration en cellules par ml, votre résultat final sera aussi en cellules par ml. Si votre concentration de départ est en parts par million (ppm), votre concentration finale sera en parts par million.Publicité
Références
- ↑ http://abacus.bates.edu/~ganderso/biology/resources/dilutions.html
- ↑ http://study.com/academy/lesson/serial-dilution-in-microbiology-calculation-method-technique.html
- ↑ http://study.com/academy/lesson/serial-dilution-in-microbiology-calculation-method-technique.html
- ↑ http://biology.kenyon.edu/courses/biol09/tetrahymena/serialdilution2.htm
- ↑ http://scienceprimer.com/serial-dilution
- ↑ http://abacus.bates.edu/~ganderso/biology/resources/dilutions.html
- ↑ http://www.ausetute.com.au/dfactor.html
- ↑ http://www.ausetute.com.au/dfactor.html