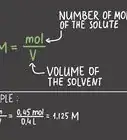
Cet article a été coécrit par Bess Ruff, MA. Bess Ruff est doctorante en géographie à l'université d'État de Floride. Elle a obtenu un master en sciences et gestion de l'environnement à l'université de Californie, Santa Barbara, en 2016. Elle a aussi mené des enquêtes pour des projets de planification des espaces marins dans les Caraïbes et a contribué à la recherche en tant que boursière d'études supérieures pour Sustainable Fisheries Group.
Cet article a été consulté 147 172 fois.
En chimie, le tableau périodique des éléments est un très joli tableau coloré avec plein de lettres et de chiffres, mais allez-y comprendre quelque chose ! Pourtant, il est essentiel pour quiconque ambitionne de faire des études de chimie. Sur un tableau complet, vous serez capable de lire de nombreuses informations qui vous permettront également de faire des calculs (comme celui du nombre de neutrons dans un noyau donné) et de résoudre nombre de problèmes de chimie.
Étapes
Partie 1
Partie 1 sur 3:Comprendre la structure du tableau périodique des éléments
-
1Sachez lire le tableau périodique. Les éléments sont classés, par ordre croissant de numéros atomiques, de droite à gauche et de haut en bas. Le numéro atomique, au-dessus du symbole, est en fait le nombre de protons que contient un atome de l’élément considéré. Et comme les protons ont une masse, la masse atomique des éléments augmente dans le même sens : les atomes les plus lourds (uranium) se trouvent en bas, et les plus légers (hélium) se situent en haut.
- Si la masse atomique augmente de haut en bas et de gauche à droite, c’est que cette dernière est la somme des masses des protons et des neutrons contenus dans les noyaux des atomes. Le nombre de protons augmentant dans le tableau, les masses atomiques augmentent aussi.
- Les électrons sont considérés au point de vue de la masse comme quantités négligeables par rapport à celles des noyaux [1] .
-
2Notez que chaque élément a un proton de plus que l’élément précédent. C’est pour cela que le numéro atomique croit de gauche à droite et de haut en bas. Les rangées se poursuivent sur la rangée inférieure à gauche. Vous noterez aussi les manques sur les trois premières rangées [2] .
- La première rangée ne contient que deux éléments, l’hydrogène à gauche ayant un numéro atomique de 1 et l’hélium, à droite, avec un numéro atomique de 2. Ils sont éloignés, car ils appartiennent à des groupes différents.
-
3Repérez les groupes (ou familles) d’éléments. Tous les éléments d’un même groupe sont sur la même colonne, soit 18 groupes. Chaque colonne est souvent repérable par une couleur unique. Être du même groupe signifie posséder des propriétés physiques et chimiques similaires. Si vous connaissez le comportement d’un élément lors d’une réaction, vous serez à même de deviner le comportement d’un élément moins commun du même groupe [3] . Tous les éléments d’une même famille ont le même nombre d’électrons sur la dernière couche électronique [4] .
- Tous les éléments appartiennent forcément à une famille chimique. Cas particulier, l’hydrogène n’appartient à aucune série : il agit autant comme un alcalin que comme un halogène.
- La plupart des tableaux indiquent le numéro des familles (de 1 à 18). Ces numéros sont indiqués en chiffres romains (I) ou arabes (1), avec ou sans précision de la famille (A = famille principale ou B = famille secondaire).
- Quand vous lisez une colonne du tableau, vous vous déplacez au sein d’un même groupe.
-
4Comprenez le pourquoi des vides du tableau. Les éléments sont classés horizontalement par numéro atomique, mais aussi verticalement selon leur structure électronique : les éléments d’une colonne partagent les mêmes propriétés chimiques. Partant de ces deux critères, il s’avère que le tableau présente des vides. Finalement, plus que le numéro atomique, c’est la structure des atomes qui expliquent le mieux ces espaces laissés libres [5] .
- Ce n’est qu’à partir de l’élément 21 qu’apparaissent les métaux de transition (scandium, titane…) qui viennent remplir les manques des lignes précédentes.
- Les éléments 57 à 71 (lanthane, cérium…) appartiennent au groupe des terres rares et sont représentés par un petit carré dans le tableau, lequel est détaillé dans un petit tableau au bas du tableau principal.
-
5Repérez les périodes. Tous les éléments d’une même ligne appartiennent à une période : ils ont tous le même nombre de couches électroniques. La numérotation de la période correspond au nombre de couches. Le potassium (K) appartient à la période 4 à cause de ces quatre couches électroniques. Pour l’instant, aucun élément connu n’a plus de 7 couches électroniques [6] .
- Pour ne regarder que les périodes extrêmes, les éléments de la période 1 ne possèdent qu’une couche d’électrons et ceux de la période 7, sept.
- Les périodes sont indiquées le plus souvent sur la gauche du tableau, mais il n’y a pas vraiment de règle fixe.
- Quand vous lisez une rangée, vous vous déplacez au sein d’une même période.
-
6Faites la distinction entre les familles d’éléments. Ainsi, il y a, entre autres, des métaux, des non-métaux et entre les deux, les métaux de transition. Des couleurs ont été utilisées pour matérialiser ces groupes. Pour simplifier, disons qu’il y a trois grands groupes d’éléments : les métaux (quatre sous-groupes) à gauche du tableau, les non-métaux (cinq sous-groupes) à droite, et entre les deux, les métaux de transition [7] .
- Dans ce tableau, l’hydrogène, pour les raisons indiquées plus haut (un seul proton et un seul neutron), occupe une place à part et a sa propre couleur : il est inclassable, mais est souvent mis en haut et à gauche.
- Sont considérés comme métaux les éléments qui ont un éclat métallique, sont solides à température ambiante, conduisent la chaleur et l’électricité et sont malléables et ductiles.
- Sont considérés comme non-métaux les éléments mats, qui ne conduisent ni la chaleur ni l’électricité et ne sont pas malléables. Ces éléments sont souvent des gaz à température ambiante, mais aussi certains éléments qui, à des températures extrêmes, sont liquides ou solides.
- Les métaux de transition ont, quant à eux, à la fois des propriétés des métaux et des non-métaux [8] .
Publicité
Partie 2
Partie 2 sur 3:Étudier les éléments chimiques
-
1Notez que les symboles n’ont qu’une ou deux lettres. C’est l’information qui apparait le plus nettement au milieu de chaque carré. Les symboles sont universels afin que tous les scientifiques puissent communiquer. L’emploi de ces symboles est incontournable en chimie, surtout quand il s’agit d’écrire les équations bilans issues des expériences [9] .
- Les symboles ont été créés au fil du temps et des découvertes. Le plus souvent, il s’agit de la première ou des deux premières lettres du nom de l’élément. Ainsi, le symbole de l’hydrogène est H, tandis que celui de l’hélium est He, le fer, Fe… La seconde lettre est souvent là pour éviter la confusion avec d’autres éléments (F, Fe, Fr pour fluor, fer, francium).
-
2Repérez éventuellement le nom de l’élément. Sur certains tableaux très complets, le nom de l’élément (dans la langue du pays de diffusion) est indiqué dans le carré. Ainsi, sous le symbole C peut être imprimé son nom : carbone, sous Sn : étain (du latin, Stannum [10] ).
- Certains tableaux périodiques ne signalent pas le nom des éléments, mais uniquement les symboles.
-
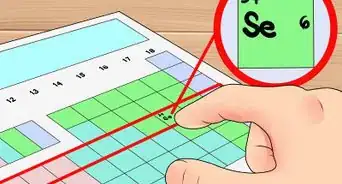
3Repérez le numéro atomique d’un élément. Souvent placé en haut du carré, il n’y a pas de règle concernant son emplacement. Il est toujours bien placé et souvent en gras, car c’est une information capitale. À l’heure actuelle, il y a 118 éléments classifiés [11] .
- Le numéro atomique est toujours un entier, ne confondez pas avec les autres nombres du carré, parfois décimaux.
-
4Sachez ce qu’est le numéro atomique. C’est le nombre de protons contenus dans un atome donné. À la différence des électrons qui peuvent migrer d’un atome à l’autre, un atome ne peut perdre ni gagner de protons, sauf en physique nucléaire, mais c’est une autre histoire [12] !
- Ce numéro atomique permet aussi de calculer le nombre d’électrons et de neutrons d’un atome.
-
5Sachez que tout élément chimique a autant d’électrons que de protons. Cela est vrai autant que l’atome n’est pas ionisé. Les protons ont une charge positive, tandis que les électrons ont une même charge négative, les deux s’équilibrant dans les atomes au repos, mais il peut arriver que lors d’une réaction chimique, un atome perde un ou plusieurs électrons et en ce cas, on obtient des ions positifs ou négatifs [13] .
- Les ions portent une charge électrique. Si un ion a plus de protons que d’électrons, c’est un cation (charge positive) et on lui adjoint un ou plusieurs signes + en exposant. S’il a plus d’électrons que de protons, c’est un anion (charge négative) et on lui adjoint un ou plusieurs signes - en exposant.
- Seuls les ions portent la mention d’une charge, non les éléments stables.
Publicité
Partie 3
Partie 3 sur 3:Utiliser la masse atomique pour trouver le nombre de neutrons
-
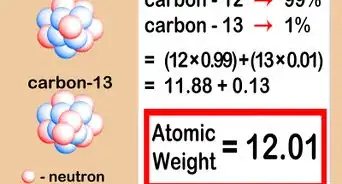
1Trouvez la masse atomique. La masse atomique est inscrite au bas du carré de l’élément, sous le symbole. La masse atomique est la masse de tous les éléments qui composent le noyau d’un atome donné, lequel renferme des protons et des neutrons. Cela vaut pour les atomes au repos. Cependant, pour le calcul de cette masse atomique, il a été décidé qu’il fallait faire une moyenne de toutes les masses atomiques de cet élément au repos, mais aussi de celles de tous ses ions [14] .
- Comme ces masses sont des moyennes, il est fréquent que les masses atomiques soient des nombres décimaux.
- Après ce qui vient d’être dit, il serait logique que les masses atomiques croissent de la gauche vers la droite du tableau et du haut vers le bas, mais ce n’est pas toujours la règle.
-
2Déterminez la masse atomique relative de l’élément étudié. Elle s’obtient en arrondissant la masse atomique à l’entier le plus proche. Cela s’explique par le fait que la masse atomique est une moyenne de toutes les masses atomiques des différentes formes de cet élément, y compris les ions (en fait, c’est encore bien plus compliqué [15] ).
- Ainsi, la masse atomique du carbone est 12,011, que l’on arrondit généralement à 12. De même, la masse atomique du fer est de 55,847, arrondie à 56.
-
3Calculez le nombre de neutrons. Pour cela, il faut ôter le nombre de protons de la masse atomique relative. La masse atomique relative peut se résumer à la somme des protons et des neutrons d’un atome, si bien qu’en connaissant le nombre de protons d’un atome donné, il est facile avec cette masse atomique relative d’en déduire le nombre de neutrons [16] !
- Utilisez la formule suivante : nombre de neutrons = masse atomique relative - nombre de protons.
- Ainsi, le carbone a une masse atomique relative de 12 et a 6 protons. En faisant 12 - 6 = 6, vous en déduisez que le noyau de carbone renferme 6 neutrons.
- Le fer a une masse atomique relative de 56 et a 26 protons. En faisant 56 - 26 = 30, vous en déduisez que le noyau de carbone renferme 30 neutrons.
- Les isotopes d’un élément se distinguent les uns des autres par un nombre de neutrons différent, les nombres de protons et d’électrons étant tous identiques. Ce faisant, les isotopes ont tous des masses atomiques différentes.
Publicité
Conseils
- Ne vous inquiétez pas si vous ne maitrisez pas tout de suite ce tableau. Il faut du temps et beaucoup de pratique.
- Si les couleurs du tableau sont variables, les informations, elles, restent identiques.
- Certains tableaux périodiques des éléments sont simplifiés, ils donnent généralement les symboles des éléments, ainsi que les numéros atomiques. Sachez aussi qu’il existe des tableaux de Mendeleïev bien plus détaillés.
Références
- ↑ http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ http://www.chem4kids.com/files/elem_pertable.html
- ↑ http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ http://www.chem4kids.com/files/elem_pertable.html
- ↑ http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ http://www.csun.edu/~psk17793/G%20Chemistry/reading_the_periodic_table.htm
- ↑ http://www.chem4kids.com/files/elem_pertable.html
- ↑ http://www.chem4kids.com/files/elem_pertable.html)
- ↑ http://www.chem4kids.com/files/elem_pertable.html
- ↑ http://education.jlab.org/qa/pen_number.html
- ↑ http://education.jlab.org/qa/pen_number.html
- ↑ https://education.jlab.org/qa/pen_number.html
- ↑ https://education.jlab.org/qa/pen_number.html
- ↑ https://education.jlab.org/qa/pen_number.html