Cet article a été coécrit par Bess Ruff, MA. Bess Ruff est doctorante en géographie à l'université d'État de Floride. Elle a obtenu un master en sciences et gestion de l'environnement à l'université de Californie, Santa Barbara, en 2016. Elle a aussi mené des enquêtes pour des projets de planification des espaces marins dans les Caraïbes et a contribué à la recherche en tant que boursière d'études supérieures pour Sustainable Fisheries Group.
Il y a 7 références citées dans cet article, elles se trouvent au bas de la page.
Cet article a été consulté 1 983 fois.
La configuration électronique d’un élément chimique permet de rendre compte de la répartition probabiliste des électrons autour du noyau. Plus l’atome a un numéro atomique élevé, plus longue et plus complexe sera sa configuration électronique. C’est pour cela qu’une notation abrégée a été créée… pour ne pas avoir à tout écrire, et cette méthode s’appuie sur la configuration électronique des gaz nobles [1] .
Étapes
Partie 1
Partie 1 sur 2:Établir la configuration électronique standard d’un élément
-
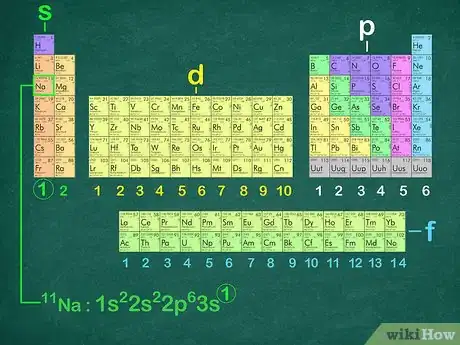
1Récupérez le nombre d’électrons de votre élément. Chaque élément chimique possède un numéro atomique (Z) qui, à l’état fondamental, indique le nombre de protons (de charge positive), mais aussi le nombre d’électrons présents autour du noyau, le tout est donc électriquement neutre. Dans le tableau périodique des éléments, c’est le nombre écrit en gras au-dessus du symbole de l’élément.
- Le symbole du sodium est et son numéro atomique est 11.
-
2Comprenez bien les couches et les sous-couches électroniques. La première couche électronique n’a qu’un seul niveau d’énergie (sous-couche ou orbitale atomique ), la deuxième couche a deux niveaux d’énergie ( et ), la troisième couche électronique en a trois (, et ) et enfin, la quatrième couche en a quatre (, , et ). Il existe d’autres couches, mais nous nous limiterons aux 4 premières [2] :
- 2 électrons au maximum au niveau énergétique d’une sous-couche ;
- 6 électrons au maximum au niveau énergétique d’une sous-couche ;
- 10 électrons au maximum au niveau énergétique d’une sous-couche ;
- 14 électrons au maximum au niveau énergétique d’une sous-couche
-
3Retenez les règles de remplissage des couches. Les électrons ne se répartissent pas n’importe où autour du noyau : il est un principe qui veut qu’un électron doive d’abord être placé sur le plus bas niveau d’énergie. Ce n’est que lorsqu’une couche est remplie, que la suivante peut être remplie. Une couche, sauf la première, contient deux ou plusieurs sous-couches. La sous-couche ne contient qu’une seule orbitale atomique (OA), la contient 3 OA dégénérées, la 5 OA dégénérées et la 7 OA dégénérées [3] .
- En fait, le remplissage se fait, entre autres règles, selon la règle de Klechkowski, à savoir qu’il se fait à croissant (couche après couche donc), mais en cas d’égalité, c’est l’orbitale du plus petit qui est remplie. C’est pour cela que la configuration électronique du zinc est :
, vous le voyez est avant .
- En fait, le remplissage se fait, entre autres règles, selon la règle de Klechkowski, à savoir qu’il se fait à croissant (couche après couche donc), mais en cas d’égalité, c’est l’orbitale du plus petit qui est remplie. C’est pour cela que la configuration électronique du zinc est :
-
4Servez-vous du diagramme de Klechkowski. Il permet d’établir la configuration électronique de n’importe quel élément. Les lignes figurent de haut en bas les couches, tandis que les colonnes de la gauche vers la droite correspondent aux sous-couches. Le remplissage de ces dernières se fait en diagonale du haut à droite vers le bas à gauche, avec décalage à chaque fois vers la ligne du bas suivante [4] .
-
- La configuration électronique du sodium (11 électrons) est la suivante :
.
-
-
5Sachez déterminer la dernière orbitale. À l’aide du tableau périodique, déterminez en premier lieu le bloc auquel appartient votre élément
(, , ou ). Repérez ensuite sur quelle ligne est votre élément, cela vous donnera sa période et son nombre de couches. Enfin, repérez sa colonne, ce qui vous donnera le nombre d’électrons sur la dernière sous-couche [5] .- Le sodium appartient au bloc , donc sa dernière orbitale sera . Ce sodium est sur la troisième ligne et dans la première colonne, donc sa dernière orbitale est . Cette façon de procéder permet de vérifier la configuration que vous avez pu trouver par une autre méthode.
- Les règles de remplissage connaissent des exceptions, notamment avec l’orbitale . Il arrive que pour des raisons de stabilité, la sous-couche de la couche supérieure se remplisse avant la dernière sous-couche de l’avant-dernière couche. Ainsi, la configuration du vanadium se termine par [6] .
- Il est un autre moyen de vérifier que vous ne vous êtes pas trompé, c’est de compter tous les exposants des différentes sous-couches : vous devez retomber sur votre nombre d’électrons. Si vous en avez trop ou pas assez, vérifiez chaque sous-couche.
Publicité
Partie 2
Partie 2 sur 2:Établir une configuration électronique simplifiée
-
1Comprenez bien la configuration électronique à partir des gaz nobles. Il s’agit d’une méthode qui permet d’abréger la configuration un peu longue d’un élément chimique. Cette façon de présenter la configuration permet de bien mettre en évidence la composition de la dernière couche électronique, dite « couche de valence » toujours partiellement remplie [7] .
- La mention du gaz noble dans la configuration d’un élément chimique vous évitera d’écrire la configuration de toutes les couches, sauf la dernière.
- Ces gaz nobles sont au nombre de 6 : l’hélium, le néon, l’argon, le krypton, le xénon et le radon. Dans le tableau périodique, ils sont situés tout à droite dans la dernière colonne.
-
2Repérez le gaz noble dans le tableau périodique. Vous avez repéré votre élément chimique, repérez à présent le gaz noble le plus proche ayant un numéro atomique inférieur à celui de votre élément. Chaque ligne du tableau périodique est… une période. Si votre élément est sur la 4e ligne, c’est qu’il appartient à la 4e période. Pour en revenir à notre propos, le gaz noble qui va servir de raccourci se trouve donc sur la 3e ligne. Ci-dessous, les gaz nobles et leurs périodes [8] :
- l’hélium (période 1) ;
- le néon (période 2) ;
- l’argon (période 3) ;
- le krypton (période 4) ;
- le xénon (période 5) ;
- le radon (période 6) ;
- comme le sodium appartient à la troisième période, c’est le néon, appartenant à la 2e période, qui va servir de raccourci.
-
3Abrégez la configuration avec le gaz noble. Au début, vous serez peut-être amené(e) pour mieux comprendre à écrire la configuration du gaz noble et à la retrouver dans l’élément que vous étudiez. Cela fait, vous remplacerez cette partie commune par la mention du gaz. Sinon, vous ne conservez que la partie terminale (dernière couche) de votre élément, que vous faites précéder de la mention du gaz noble situé avant votre élément dans le tableau périodique [9] .
- Le sodium possède donc 11 électrons et le néon 10.
- La configuration électronique complète du sodium est et celle du néon . Le sodium a un électron de plus que le néon et il est quelque part sur la troisième couche (sous-couche ). De cette constatation, vous allez retirer la configuration du néon et écrire celle du sodium ainsi :
- Vous pouvez également compter les électrons dans la formule (exposants) de gauche à droite, et quand vous arrivez au nombre d’électrons du gaz rare, vous remplacez par le gaz. Le néon a 10 électrons, comptez ces 10 électrons dans la configuration du sodium, remplacez toutes ces couches par et ajoutez ce qui reste, un seul électron ici. La configuration du sodium est :
Publicité
Avertissements
- Seuls les éléments à l’état fondamental (neutre) ont un nombre d’électrons égal à celui du numéro atomique. Quant aux ions, ils possèdent soit des électrons en plus (anions de charge négative, comme , ou ) soit en moins (cations de charge positive, comme , ou
Références
- ↑ https://socratic.org/chemistry/the-electron-configuration-of-atoms/noble-gas-shorthand
- ↑ http://www.chemtube3d.com/A%20Level%20orbitals.htm
- ↑ https://www.youtube.com/watch?v=UHJGlzG4P6s
- ↑ http://terpconnect.umd.edu/~wbreslyn/chemistry/electron-configurations/
- ↑ http://terpconnect.umd.edu/~wbreslyn/chemistry/electron-configurations/
- ↑ https://www.youtube.com/watch?t=3m54s&v=Nz7C08t1eSc
- ↑ https://socratic.org/chemistry/the-electron-configuration-of-atoms/noble-gas-shorthand
- ↑ http://www.ck12.org/chemistry/Noble-Gas-Configuration/lesson/Noble-Gas-Configuration-CHEM/
- ↑ https://www.youtube.com/watch?v=AOxaVdA-Sv0





























![{\displaystyle {[Ne]3s^{1}}.}](./images/1828396914-afb10a36b7441d596105bb89372b4b6cae858c61.webp)
![{\displaystyle {[Ne]}}](./images/2083397559-efabf934c7779cd23ed66736041d6bdd3723377a.webp)